circRNA_0000994通过翻译蛋白抑制心肌细胞肥大相关基因表达*
郭继深, 丰嘉欣, 温艺红, 陈泽润, 李 艺, 朱杰宁,李 晖 , 徐金东 , 方咸宏 , 单志新 ,△
[1南方医科大学第二临床医学院,广东 广州 510280;2华南理工大学生物科学与工程学院,广东 广州 510006;3华南理工大学医学院,广东 广州 510006;4广东省人民医院(广东省医学科学院)广东省临床药理学重点实验室,广东 广州 510080;5广东省人民医院(广东省医学科学院)检验科,广东 广州 510080;6广东省人民医院(广东省医学科学院)麻醉科,广东 广州 510080]
心脏肥大是心脏长期处于压力负荷过重状态,导致心肌细胞代偿性肥大,表现为心肌细胞体积增大,收缩力增强,以维持正常的血液循环,同时使心脏具备一定的储备力[1]。心脏肥大主要分为生理性肥大和病理性肥大,生理性肥大可长期维持心脏功能[2],而病理性肥大是心力衰竭(heart failure,HF)的常见病理前改变[3]。多种信号通路参与调控心脏肥大的病理过程[4],但其具体的机制尚不明确;研究并阐明新的心脏肥大调控机制,可能为临床心脏肥大的预防及治疗提供科学依据和干预靶点。
大多数环状RNA(circular RNA,circRNA)是由宿主编码基因的外显子或内含子序列通过反向剪接(back-splicing)形成的,主要机制可能为长侧翼反向重复元件(如Alu 元件)、RNA 结合蛋白或套索驱动环化等。circRNA 具有稳定的环形结构,相对于线性RNA,具有更高的RNA 稳定性[5]。circRNA 具有多种生物学功能,胞核内的circRNA 可直接参与转录调控、调节宿主基因的表达水平,胞质中的circRNA 可能通过海绵吸附微小RNA、与RNA 结合蛋白(RNA-binding protein,RBP)相互作用或编码蛋白等途径发挥生物学作用[6]。既往研究表明,环状RNA 与多种心血管疾病密切相关,参与调节心血管疾病的发生发展过程[7],但大多数circRNA 发挥生物学作用的机制多集中在通过海绵吸附微小RNA[8]或与RBP 相互作用2种途径[9],通过编码蛋白对心脏肥大表型影响及机制的研究却少有报道。
本课题组前期工作显示,HF 患者心肌组织中circRNA_0000994 表达显著上调,通过在线数据库circBank 预测其可能包含了内部核糖体进入位点(internal ribosome entry site,IRES)及开放阅读框(open reading frame,ORF),提示 circRNA_0000994可能具有编码功能。circRNA_0000994 来源于溶质载体家族 8 成员 A1(solute carrier family 8 member A1,SLC8A1),该基因可编码钠钙离子交换器1(Na+-Ca2+exchanger 1,NCX1;一种逆向膜转运蛋白)。本文利用HF 患者心肌组织检测circRNA_0000994 的表达特征,利用原代分离新生小鼠心室肌细胞(neonatal mouse ventricular cardiomyocytes,NMVCs),通过重组腺病毒rAd-circRNA_0000994 介导过表达该circRNA,探究circRNA_0000994 及其编码蛋白对心肌细胞肥大相关基因表达的调控作用。
材料和方法
1 动物
新生(1~3 日龄)SPF 级C57BL/6 乳小鼠,雌雄不限,购自广州中医药大学实验动物中心,许可证号为SCXK(粤)2013-0034。
2 细胞株和主要试剂
本文所用细胞株购自ATCC 细胞库;胎牛血清(fetal bovine serum,FBS)、胰蛋白酶(0.25% trypsin-EDTA)、胶原酶 II 及 DMEM/F12 培养液购自 Gibco;血管紧张素 II(angiotensin II,Ang II)购自Sigma-Aldrich;iFluor™ 647 标记鬼笔环肽购自 Yeasen;Lipofectamine RNAiMax 和 Trizol 试 剂 购 自 Invitrogen;RIPA 裂解液和考马斯亮蓝超快染色液购自Beyotime;4× SDS loading Buffer 购 自 TaKaRa;预 混 型qPCR 试剂盒(2× SYBR Green Premix)和逆转录试剂预混液(Evo M-MLV RT Premix)购自Accurate Biology;PVDF 膜和ECL 化学发光检测试剂盒购自Millipore;蛋白酶和磷酸酶抑制剂微型片剂及BCA 蛋白定量试剂盒购自Thermo Fisher Scientific;siRNA 购自Ribobio;兔抗 β-肌球蛋白重链(β-myosin heavy chain,β-MHC)抗体、兔抗骨骼肌肌动蛋白α1(skeletal muscle actin alpha 1,ACTA1)抗体、兔抗NCX1 抗体和鼠抗GAPDH 抗体购自Protein Technology;兔抗心房钠尿肽(atrial natriuretic peptide,ANP)抗体购自Bioworld;抗兔和抗小鼠Ⅱ抗购自invitrogen;其他生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1 实验组织 本文所利用的18 份健康器官捐献者和28 份HF 患者心肌组织样品均获得患者知情同意,并经广东省人民医院伦理委员会批准(No.GDREC2016255H),手术样品来源:广东省心血管病研究所。
3.2 NMVCs的分离与培养 取10只1~3日龄的SPF级C57BL/6小鼠心脏置于预冷的PBS溶液中,修剪心脏周围的血管组织,转移至50 mL离心管,加入10 mL胰蛋白酶(0.1%trypsin-EDTA),4 ℃、70 r/min水平震荡消化过夜。次日,加入终止消化后加入7 mL 无血清 F12 和 70 μL 胶原酶 II,37 ℃、70 r/min 水平震荡消化10 min,用巴氏管吹打直至组织完全消化,立即用完全培养液终止消化,使用70 μm滤网过滤,300×g离心5 min,弃上清,用完全培养液重悬细胞沉淀,转移至T75细胞培养瓶中,置于37 ℃、5%CO2细胞培养箱中培养1.5~2 h,进行差速贴壁,未贴壁的即为NMVCs,将分离的NMVCs 悬液均匀铺于预先用鼠尾胶原I包裹的12孔板,待细胞稳定生长24 h,用PBS清洗细胞,更换完全培养液继续培养24 h后处理。
3.3 RT-qPCR 检测 利用Trizol 试剂提取人心肌组织或者 NMVCs 的总 RNA,取 1 μg 总 RNA 采用逆转录试剂预混液(Evo M-MLV RT Premix)逆转录得到cDNA,利用ViiA 7 Quantitative PCR System(Applied Biosystems)进 行 qPCR 检 测 circRNA_0000994、SLC8A1 mRNA 及心脏肥大标志物mRNA 表达水平。以GAPDH 为胞质内参照,U6 为胞核内参照,利用2-ΔΔCt法比较目的基因的表达差异。本文所用qPCR引物序列见表1。

表1 qPCR引物序列Table 1. The sequences of the primers for qPCR
3.4 Western blot 检测 利用RIPA 裂解液(加入蛋白酶和磷酸酶抑制剂)提取细胞样品,采用BCA试剂盒测定样品的蛋白浓度,取20 μg 蛋白样品,加入4×SDS loading buffer 混匀,99 ℃变性 10 min 后进行SDS-PAGE,将凝胶中的蛋白电转至PVDF 膜,5%脱脂牛奶封闭1 h,用Ⅰ抗[β-MHC 和ACTA1 抗体(1∶2 000),ANP和NCX1抗体(1∶1 000),GAPDH抗体(1∶5 000)]4 ℃过夜孵育。TBST 溶液漂洗 3 次,每次 10 min,用相同种属的抗兔或抗小鼠Ⅱ抗(1∶5 000)室温孵育 1 h,TBST 溶液漂洗 3 次,每次 10 min。使用LAS 500 超灵敏化学发光成像仪显影,ImageJ 软件进行图像灰度分析,采用目的蛋白/内参的灰度值比值比较蛋白的表达水平,细胞内参照为GAPDH。
3.5 鬼笔环肽染色 将分离的NMVCs 悬液均匀铺于预先用鼠尾胶原I包裹的共聚焦培养皿,经重组腺病毒感染或siRNA 转染处理24 h 后,吸干培养液,用PBS 漂洗2 次;加入500 μL 4 %多聚甲醛固定液,室温静置20~30 min,弃去多聚甲醛固定液,PBS 漂洗2次,每次 10 min;加入 500 μL 0.5% TritonX-100 透化液,室温静置5 min,弃去透化液,PBS 漂洗2 次;加入500 μL 新鲜配制的鬼笔环肽工作液(1 mL 1% BSA溶液加入1 μL 1 000× iFluor™ 647 标记鬼笔环肽),室温避光染色 60~90 min,PBS 漂洗 2 次,每次 10 min,滴入5 滴DAPI 封片剂,置于4 ℃避光保存,使用SP5-FCS激光共聚焦显微镜拍摄图片。
3.6 考马斯亮蓝染色 染色:蛋白样品利用SDSPAGE分离后,去离子水润洗1次,加入20 mL考马斯亮蓝超快染色液,于水平摇床40 r/min 室温染色30 min;脱色:弃去染色液,加入适量去离子水,于水平摇床40 r/min 室温脱色2 h,每隔30 min 更换新的去离子水,继续在摇床上脱色。
4 统计学处理
应用GraphPad Prism 9.0 软件进行统计分析。数据均采用均数±标准差(mean±SD)表示。两组间均数比较采用t检验;多组间均数比较先进行正态分布和方差齐性检验,方差齐性检验后采用单因素方差分析,并用Bonferroni 校正的t检验进行组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 circRNA_0000994在HF心肌组织中表达增加
RT-qPCR 结 果 显 示 ,circRNA_0000994 及SLC8A1 mRNA 在HF 心肌中表达上调(P<0.05),见图1A。琼脂糖凝胶电泳结果显示,circRNA_0000994 的反向引物能以人的cDNA 模板扩增出特异性条带,而不能以人的基因组DNA(genomic DNA,gDNA)为模板扩增出条带(图1B)。circRNA_0000994 的序列来源于宿主基因SLC8A1第一个外显子的全部序列,长度1 832 nt;Sanger 测序证实检测到的circRNA_0000994 包含特征的接头序列,见图1C。放线菌素D实验结果显示,circRNA_0000994的相对表达水平显著高于SLC8A1 mRNA(P<0.01),见图 1D。RNase R 实验结果证实,circRNA_0000994 能够耐受RNase R 消化,而线性SLC8A1 mRNA 很容易被RNase R 消化(P<0.05),见图1E。RNA 核质分离实验结果显示circRNA_0000994 在人AC16 心肌细胞的胞质中较丰富,见图1F。
2 circRNA_0000994 抑制心肌细胞肥大相关基因的表达
利用定向克隆构建circRNA_0000994 的重组腺病毒rAd-circRNA_0000994 并用于感染NMVCs。rAd-circRNA_0000994感染NMVCs,荧光显微镜视野下可见大部分细胞表达绿色荧光蛋白(green fluorescent protein,GFP),提示rAd-circRNA_0000994 已充分感染NMVCs(图2A);RT-qPCR 结果进一步证实circRNA_0000994 在 NMVCs 中得到有效表达(P<0.01),见 图 2B。在 过 表 达 circRNA_0000994 的NMVCs 中,心脏肥大相关基因Myh7(编码β-MHC 蛋白)、Acta1和Nppa(编码ANP 蛋白)的mRNA 表达水平显著降低(图2C)。Western blot 结果显示,rAdcircRNA_0000994 感染NMVCs 后,心脏肥大相关蛋白β-MHC、ACAT1 和ANP 表达水平也显著下调(图2D)。鬼笔环肽染色结果显示,Ang II处理的NMVCs表面积明显增大,而过表达circRNA_0000994 可有效抑制Ang II诱导的心肌细胞肥大反应(图2E)。
3 circRNA_0000994可翻译蛋白SLC8A1-605aa
根据在线数据库circBank(http://www.circbank.cn/index. html)的预测结果,circRNA_0000994 序列中包含一个跨越接头序列的ORF 和一个IRES,提示circRNA_0000994 具有编码蛋白的潜能。预测circRNA_0000994 的ORF 序列可编码605 个氨基酸,因此命名为SLC8A1-605aa,该蛋白的C 端包含2 个特异的氨基酸RL(图3A、B)。通过SDS-PAGE 分离过表达circRNA_0000994 的人AC16 细胞总蛋白,结合考马斯亮蓝染色,在65~75 kD 之间的可见一条差异条带;切割该位置凝胶行MS shot-gun分析,可鉴定到与预测的SLC8A1-605aa 蛋白一致的肽段序列(图3C),而且利用NCX1多抗通过Western blot 检测可证实SLC8A1-605aa蛋白的表达(图3D)。
4 circRNA_0000994 通过编码蛋白SLC8A1-605aa发挥抑制NMVCs肥大的作用
为了验证SLC8A1-605aa 蛋白的功能,我们构建了可表达SLC8A1-605aa 的重组腺病毒载体,命名为rAd-circRNA_00000994-ORF。 Western blot 结 果 显示 ,利 用 rAd-circRNA_0000994 和 rAd-circRNA_00000994-ORF 分别感染NMVCs,心脏肥大相关蛋白β-MHC、ACAT1 和ANP 表达均显著降低(P<0.05),见图4A。鬼笔环肽染色结果显示,过表达circRNA_0000994 和 SLC8A1-605aa 可一致减弱 Ang II 诱导的NMVCs 肥大反应(P<0.05),见图4B。进一步的,在过表达circRNA_0000994 的NMVCs 中转染SLC8A1-605aa siRNA,Western blot 结果显示,SLC8A1-605aa siRNA 可 降 低 circRNA_0000994 翻 译 SLC8A1-605aa水平,而敲减SLC8A1-605aa 表达能有效减弱circRNA_0000994 抑制NMVCs 中心脏肥大相关蛋白的表达(P<0.05),见图4C。
讨 论
心脏肥大是心脏应对压力或容量负荷时的一种代偿性调节,以维持心脏原有的泵血功能。然而,长时间的病理性刺激引起的心脏肥大将最终导致HF。前期对HF 患者心肌的RNA 测序结果提示circRNA_0000994 表达增加。circRNA_0000994 是人心脏中表达丰度最高的 circRNA 之一[10],它与编码 NCX1 的SLC8A1基因序列同源[11]。有趣的是,我们发现在HF患者心肌组织中circRNA_0000994 表达水平显著高于其宿主基因SLC8A1,提示该circRNA 可能参与心脏肥大病理过程的调节。

Figure 1. Up-regulation of circRNA_0000994 and its host gene in the myocardium of patients with heart failure(HF). A:the expression of circRNA_0000994 and SLC8A1 mRNA in the human myocardium was detected by RT-qPCR(n=18 to 28);B:PCR detection of circRNA_0000994 and SLC8A1 by divergent(◀▶)and convergent(▷◁)primers in human cDNA and genomic DNA;C:circRNA_0000994 sequence is derived from exon 1 of SLC8A1 gene,and the sequence of back splicing site in circRNA_0000994 was confirmed by Sanger sequencing;D:the levels of circRNA_0000994 and SLC8A1 mRNA were measured after treatment with 2 g/L actinomycin D at the indicated time points(n=3);E:the levels of circRNA_0000994 and SLC8A1 mRNA in RNase R-treated total RNA(20 U/mg RNA)were detected by RT-qPCR(n=3);F:circRNA_0000994 was abundant in the cytoplasm of human AC16 cardiomyocytes(n=3). GADPH and U6 were used as positive controls in the cytoplasm and nucleus,respectively. Mean±SD.*P<0.05,**P<0.01 vs healthy donors;#P<0.05,##P<0.01 vs SLC8A1 mRNA;△△P<0.01 vs mock group.图1 环状RNA circRNA_0000994及其宿主基因在心衰患者心肌组织中表达上调
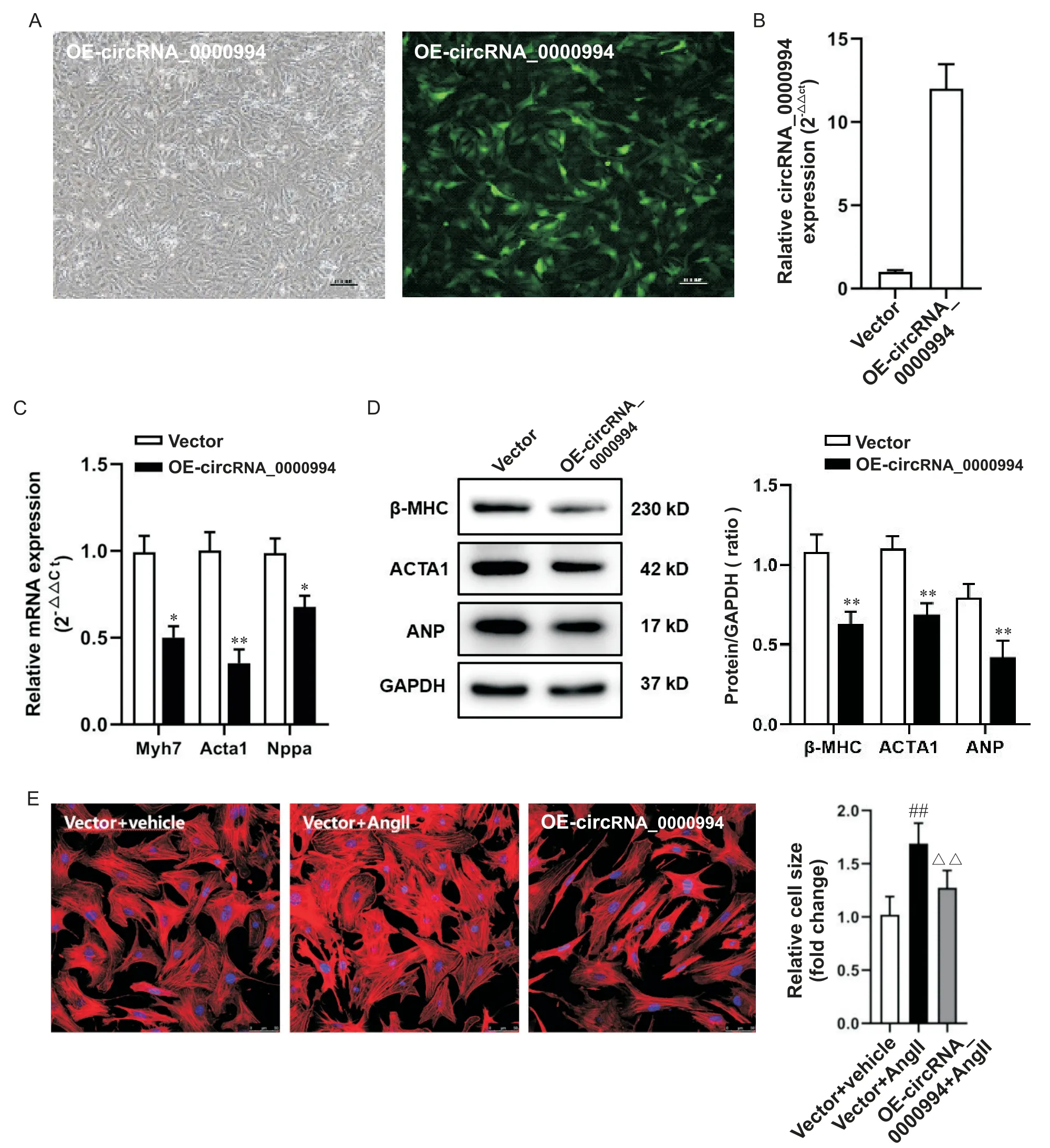
Figure 2. Over-expression of circRNA_0000994 inhibited the expression of cardiac hypertrophy-related genes in NMVCs. A:the infection efficiency of rAd-circRNA_0000994 was monitored by the co-expressed marker green fluorescent protein(scale bar=100 μm);B:the expression of circRNA_0000994 was determined by RT-qPCR;C:the mRNA expression of Myh7,Acta1 and Nppa in NMVCs was detected by RT-qPCR;D:the protein expression of β-MHC,ACTA1 and ANP in NMVCs was detected by Western blot assay;E:morphological changes of NMVCs observed by phalloidin-iFluor 647 staining(scale bar=50 μm). Mean±SD. n=3.*P<0.05,**P<0.01 vs vector group;##P<0.01 vs vector+vehicle group;△△P<0.01 vs vector+Ang II group.图2 过表达circRNA_0000994抑制新生小鼠心室肌细胞中肥大相关基因的表达
circRNA 是由mRNA 反向剪接产生的共价闭合RNA,具有较高的稳定性[12]。人类基因组可编码数以万计的circRNAs,而其中绝大部分功能仍未知[13]。长期以来,人们认为circRNA 是通过海绵吸附微小RNA 或与 RBP 相互作用直接参与各种生物过程[14]。近年来,已有多项证据表明circRNA 可以通过编码蛋白来调节肿瘤的进展[15]。由于编码蛋白与宿主蛋白具有高度同源性,其可能作为“诱饵”减少宿主蛋白的降解[16],从而增强宿主蛋白的功能或通过与宿主蛋白竞争性结合下游信号分子,从而抑制宿主蛋白的功能[14];还可以直接与下游信号分子结合发挥生物学功能[15]。
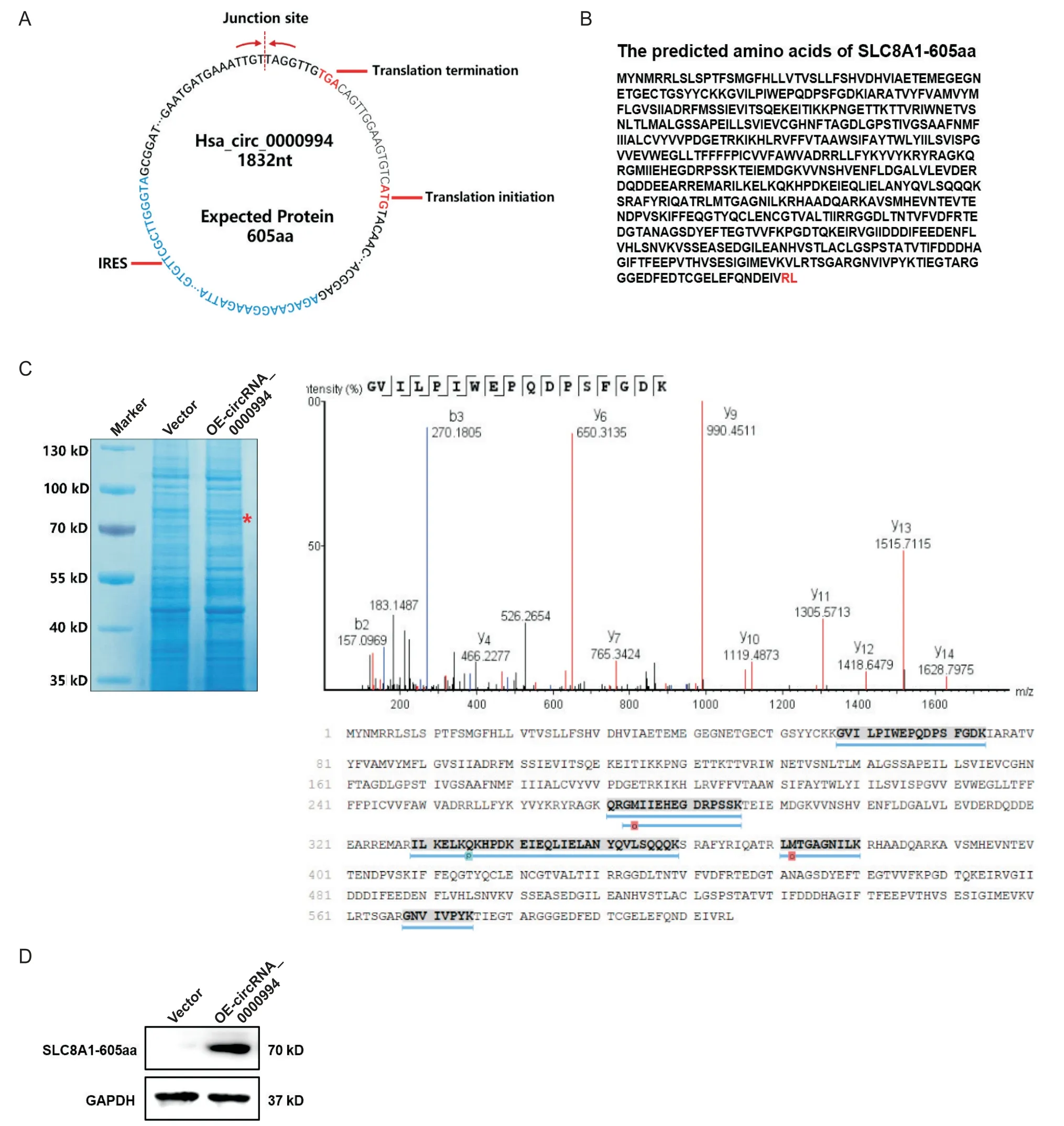
Figure 3. Identification of circRNA_0000994-translated SLC8A1-605aa protein. A:the potential IRES and ORF sequences in circRNA_0000994;B:the predicted amino acid sequences of circRNA_0000994-translated SLC8A1-605aa protein;C:total protein from human AC16 cardiomyocytes with over-expression of circRNA_0000994 was separated by SDS-PAGE,and the differential protein bands between 65 to 75 kD were cut and used for mass spectrum shot-gun analysis;D:the expression of SLC8A1-605aa in AC16 cells with over-expression of circRNA_0000994 was detected by Western blot.图3 circRNA_0000994编码蛋白SLC8A1-605aa的鉴定
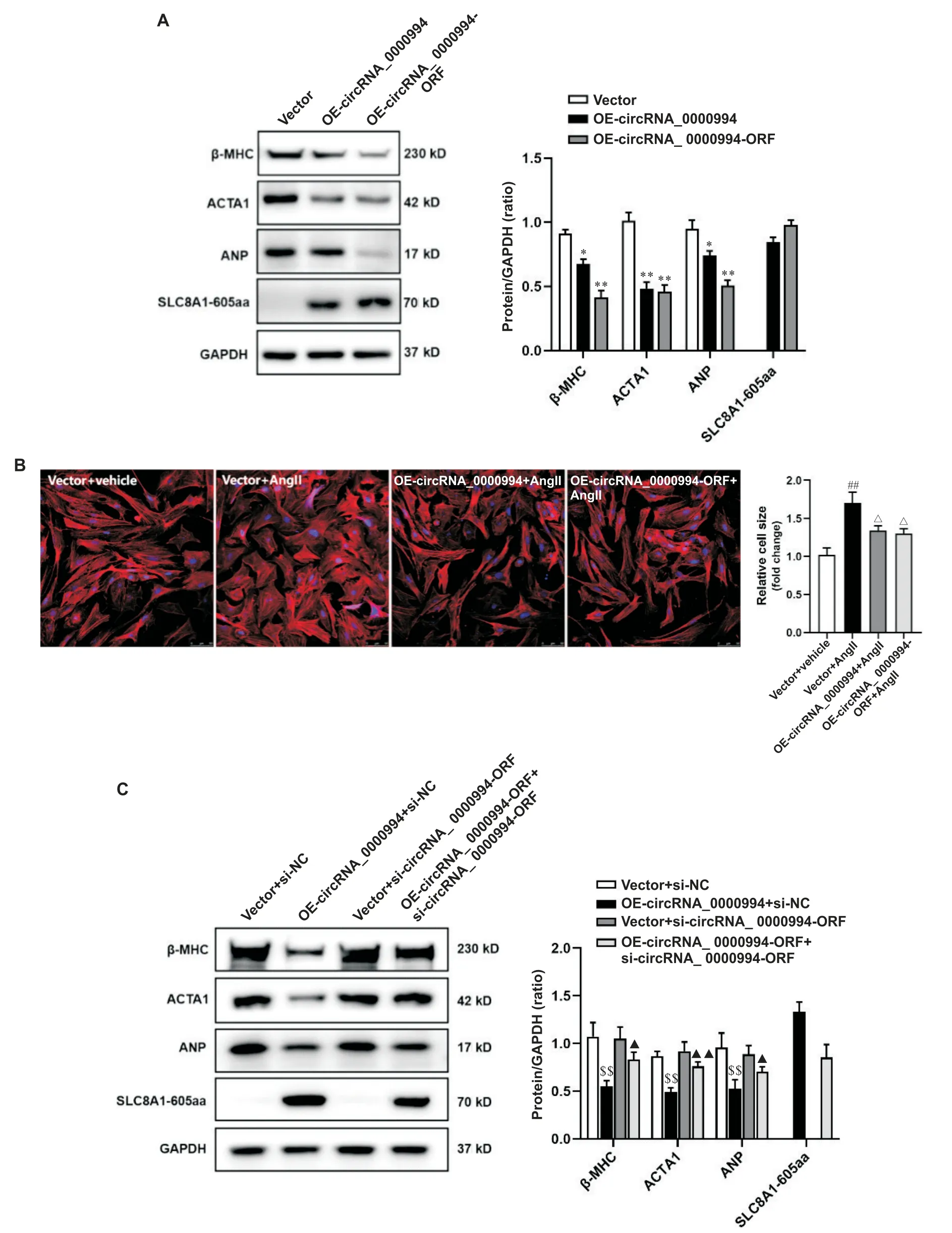
Figure 4. circRNA_0000994 inhibited cardiomyocyte hypertrophy by translating SLC8A1-605aa protein. A:the protein expression of β-MHC,ACTA1,ANP and SLC8A1-605aa in NMVCs with over-expression of circRNA_0000994 or SLC8A1-605aa;B:morphological changes of NMVCs observed by phalloidin-iFluor 647 staining(scale bar=50 μm);C:the protein expression of β-MHC,ACTA1,ANP and SLC8A1-605aa in NMVCs was detected by Western blot. Mean±SD. n=3.*P<0.05,**P<0.01 vs vector group;##P<0.01 vs vector+vehicle group;△P<0.05 vs vector+Ang II group;$$P<0.01 vs vector+si-NC group;▲P<0.05,▲▲P<0.01 vs vector+si-circRNA_0000994-ORF group.图4 circRNA_0000994通过翻译SLC8A1-605aa蛋白发挥抑制心肌细胞肥大的作用
目前,有翻译功能的circRNA 在心肌重构调节方面的报道不多。有研究表明,circRNA-Nlgn 在心肌重构中表达上调,而且能通过翻译蛋白Nlgn173与lamin B 结合入核,进一步激活血清及糖皮质激素诱导激酶 3(serum and glucocorticoid-inducible kinase-3,SGK3)和生长蛋白4 抑制因子(inhibitor of growth protein 4,ING4)启动子参与心肌重构过程[17]。本课题组前期研究发现,circRNA_0036176可通过编码蛋白Myo9a-208aa 发挥抑制心肌成纤维细胞增殖的作用,而 miR-218-5p 可通过与 circRNA_0036176 结合来抑制编码蛋白Myo9a-208aa 的表达,从而减弱circRNA_0036176 对心肌成纤维细胞增殖的抑制作用[18]。本文通过预测 circRNA_0000994 具有的潜在ORF 及IRES 序列,利用特异性抗体及质谱shot-gun技术鉴定了编码蛋白SLC8A1-605aa 的存在。功能实验证实SLC8A1-605aa 与circRNA_0000994 同样具有抑制心肌细胞肥大的作用;进一步的功能回复实验发现,利用siRNA 靶向沉默circRNA_0000994 上SLC8A1-605aa 的ORF 序列,能有效减弱circRNA_0000994 抑制心肌细胞肥大的作用,提示circRNA_0000994 可能通过翻译SLC8A1-605aa 蛋白发挥抑制心肌细胞肥大的作用。
综上所述,本文证实circRNA_0000994 在HF 心肌中表达上调,且能够编码蛋白SLC8A1-605aa 来发挥抑制心肌细胞肥大的作用。而对于SLC8A1-605aa通过何种途径发挥抑制心肌细胞肥大的作用,我们将继续探究其相关信号通路和具体分子机制,为基于circRNA 为干预靶点的心脏肥大治疗研究提供科学资料。

