锰超氧化物歧化酶对氯化钙诱导的小鼠腹主动脉瘤形成的影响及机制*
陈 娇 , 张 蕾 , 郑 飞 , 王 露 , 晏誉文 , 郭凌郧 ,杨建业 , 沈 俊 , 王家宁 △
(1湖北医药学院附属人民医院心内科,湖北 十堰 442000;2湖北医药学院附属人民医院临床研究所,湖北 十堰 442000)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是指腹主动脉的永久性局限性扩张,以肾下腹主动脉扩张为主,其直径超过30 mm 或比邻近血管大50%[1]。且AAA 是导致65岁以上老年男性死亡的一个主要原因[2]。通常AAA 患者多无明显临床表现。一旦出现破裂则导致65%~85%的病例出现致命性出血和死亡[3]。流行病学筛查发现AAA 的主要危险因素包括:高龄、性别、吸烟、家族史、目前患有心血管疾病(包括无症状性心脏病和外周动脉疾病),高血压和血脂异常[4]。
目前认为慢性炎症是AAA 发生的中心环节,而氧化应激可产生过量活性氧(reactive oxygen species,ROS),ROS 可促进炎症细胞分泌炎症因子诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)凋亡,同时激活基质金属蛋白酶(matrix metalloproteinase,MMP)促进主动脉壁内细胞外基质降解并激活胶原蛋白酶造成弹力纤维破坏,从而造成血管壁弹性减弱最终发展成动脉瘤。而超氧化物歧化酶(superoxide dismutase,SOD)是清除ROS 的主要酶之一。目前在哺乳动物中发现的SOD 主要有3 种亚型:Cu/Zn-SOD(SOD1)、Mn-SOD(SOD2)和 Fe-SOD(SOD3)。高等动物细胞内主要有SOD1 和SOD2,其中 SOD1 较多。Ishiyama 等[4]采用 TaqMan 法测定基因型,采用ELISA 法测定蛋白浓度,结果证实SOD2可能通过氧化应激反应参与AAA的形成。
目前对AAA 的治疗仅有血管内修复或手术修复,而其中仅有10%的适合行血管内修复或手术修复,有一部分人虽然不适合手术修复但仍有较高AAA 破裂风险。总之,目前关键是缺乏有效地手段限制主动脉瘤生长,故迫切需要进一步揭示AAA 的分子机制,为临床管理和药物开发提供新的靶点。结合Strauss等的研究结果,认为SOD2可能通过氧化反应与AAA 的形成有关[5]。因此,本课题着眼于SOD2 在AAA 中的表达及其对AAA 发生发展的影响,期望通过阐明SOD2 在CaCl2诱导的小鼠AAA 发生发展中的影响及可能机制,为临床AAA 的治疗提供新的治疗方向和治疗靶点。
材料和方法
1 主要材料和试剂
活性氧检测试剂盒、二氢乙啶(dihydroethidium,DHE;超氧化物阴离子荧光探针)和JC-10 线粒体膜电位荧光探针均购自上海翊圣生物科技有限公司;小鼠 IL-6、IL-10、MMP-9 和 IL-1β ELISA 试剂盒均购自欣博盛生物科技有限公司;总SOD(total SOD,TSOD)和SOD 分型检测试剂盒均购自南京建成生物工程研究所;BCA 蛋白浓度测定试剂盒和RIPA 蛋白裂解液购自上海碧云天生物技术有限公司;兔抗小鼠骨桥蛋白(osteopontin,OPN)抗体购自Immunoway;兔抗小鼠SOD2、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Bcl-2、MMP2 及MMP9 抗体购自Santa Cruz;兔抗小鼠tubulin 抗体购自Sigma;辣根过氧化物酶标记的羊抗兔Ⅱ抗购自Antgene。
2 方法
2.1 实验动物模型构建 C57BL/6J 小鼠,SPF 级,雄性,8~10 周龄,体重 25 g 左右,购于北京维通利华实验动物技术有限公司;在特定无病原体条件下喂养于湖北医药学院附属人民医院动物实验中心,许可证编号为SCXK(京)2016-0006,常规饲养。予以0.75 mmol/L氯化钙外敷腹主动脉诱导AAA模型[6]。
2.2 细胞实验 原代培养Sprague-Dawley 大鼠主动脉平滑肌细胞并鉴定,用含有10%胎牛血清的高糖DMEM培养,置于5%CO2、37 ℃恒温培养箱中。给予不同浓度(0、0.25、0.5、0.75、1 和 1.5 mmol/L)的H2O2处理细胞诱导细胞凋亡,并在处理后不同时间点镜下观察。后续收集细胞行Western blot 检测。另取细胞给予有/无Ad-SOD2(MOI 100)处理 48 h 诱导SOD2 过表达,同时给予1 mmol/L H2O2处理细胞2 h,收集细胞行Western blot检测。或按说明书行ROS检测、DHE 检测、JC-10 检测、Annexin-V/PI 试剂盒进行流式细胞术检测。
2.3 动物取材和标本收集 给予10%水合氯醛(50 mg/kg)腹腔注射麻醉,剪开皮肤,暴露心前区,抽取心室血约1 mL 入抗凝管中。4 ℃静置(分层后离心取上清)。依次剪开胸部肌肉、胸骨和心包膜,暴露心脏。心尖部穿刺,右心耳处剪开,肝素生理盐水顺沿左心室行全身灌注,同时剪开腹部皮肤、肌肉及腹膜,肉眼见肝脏颜色变白后换用预冷的4%多聚甲醛(或生理盐水)快速灌注后取主动脉组织。标本放入冰醋酸固定液(去离子水、甲醇、冰醋酸体积比为6∶3∶1)中,室温固定7 d,拟用于免疫组化检测。而生理盐水灌注的组织,放入液氮中,组织变脆后转入-80 ℃冰箱保存备用或直接研磨,组织蛋白的提取和制样,拟行Western blot 检测。
2.4 组织病理检测 取石蜡包埋组织块,厚度约5 μm。切片行HE 染色,烤片、脱蜡、水化、苏木素染色、分化、伊红复染、脱水、透明后封片,显微镜下观察并拍照,观察整个血管形态,细胞核着深蓝色,胞质和胶原呈浅红色。另外切片行弹力纤维染色,先烤片、脱蜡、水化、Verhoeff 染液 A 滴染 20 min、Verhoeff 分化液分化组织、95%乙醇快速分化、VanGieson 染液(9∶1)复染、脱水、透明后封片,镜下可见弹力纤维呈黑色,胶原呈灰色。
2.5 Western blot检测SOD2及凋亡相关蛋白表达每组取0.1 mg 组织加入裂解液,冰上匀浆器破碎组织,低温离心后取上清。BCA 法测量蛋白浓度。每孔取10 μg蛋白样本上样进行SDS-PAGE。电泳结束后,冰浴中电转移法转印蛋白至PVDF 膜上,5%BSA封闭液室温封闭后,根据抗体说明书,分别加入1∶1 000 比例稀释的 SOD2、α-SMA、OPN、Bax、Bcl-2、MMP2、MMP9 单克隆抗体,孵育后,弃去 I 抗,TBST洗膜3 次,然后加入HRP 标记的II 抗(1∶5 000)室温孵育1 h,洗膜后加入ECL试剂进行曝光显影。
3 统计学处理
采用GraphPad Prism 8 统计软件进行数据分析处理及作图。实验数据采用均数±标准差(mean±SD)表示。如果数据为正态分布且方差齐,则采用Student'st检验比较两组间的差异,多组间比较采用单因素方差分析和Tukey 事后分析。对于未通过正态性检验的数据,采用Mann-WhitneyU检验比较两组间的差异,多组间采用单因素方差分析和Tukey事后分析。以P<0.05为差异有统计学意义。
结 果
1 CaCl2诱导小鼠AAA模型的鉴定
于CaCl2外敷腹主动脉后不同时间点(1、2、4和6周),取腹主动脉组织并行HE 染色,与对照组相比,AAA 组腹主动脉直径明显增大。弹力纤维染色提示AAA 组小鼠不仅腹主动脉直径增大,同时还伴有明显的弹力纤维断裂现象,见图1。
2 SOD2在AAA 小鼠中的表达及其与细胞表型、炎症因子等的关系
Western blot 结果提示瘤体组织中α-SMA 和SOD2的表达较对照组降低,但随着时间延长,在第6周时有所上升;免疫组化染色中α-SMA及SOD2结果与Western bot 一致,但OPN 表达在各组间无明显改变,见图2A、B;同时由图1B 可见AAA 组腹主动脉术后炎症反应明显,局部组织明显粘连,但检测小鼠血清中炎症因子(IL-6、IL-10 和IL-1β)及MMP9 水平,结果无统计学差异,见图2C。此外,T-SOD 活性和SOD2活性有明显改变,结果提示T-SOD在AAA成瘤后明显下降,而SOD2 在外敷CaCl2早期水平较高,随后下降至正常水平以下。
3 Ad-SOD2对H2O2诱导氧化应激模型中RASMCs凋亡的影响
为了探讨SOD2 是否参与AAA 的发病过程,本实验原代培养大鼠主动脉平滑肌细胞后传代,给予不同浓度(0、0.25、0.5、0.75、1 和 1.5 mmol/L)的H2O2处理细胞2 h 诱导细胞凋亡,镜下观察,同时采用 Western blot 检测 SOD2、MMP2、MMP9、Bax 和 Bcl-2 的表达。结果提示 MMP2、MMP9 和 Bax 的表达随着H2O2浓度增加而增加,SOD2 和Bcl-2 的表达随着H2O2浓度增加而下降。培养RASMCs 至合适密度,有/无 Ad-SOD2 感染 RASMCs 48 h 诱导 SOD2 过表达,于感染46 h时加入1 mmol/L H2O22 h诱导细胞凋亡,光镜下可见SOD2 过表达明显延缓细胞凋亡,采用Annexin-V/PI 试剂盒进行流式细胞术检测亦支持这一结果。见图3。
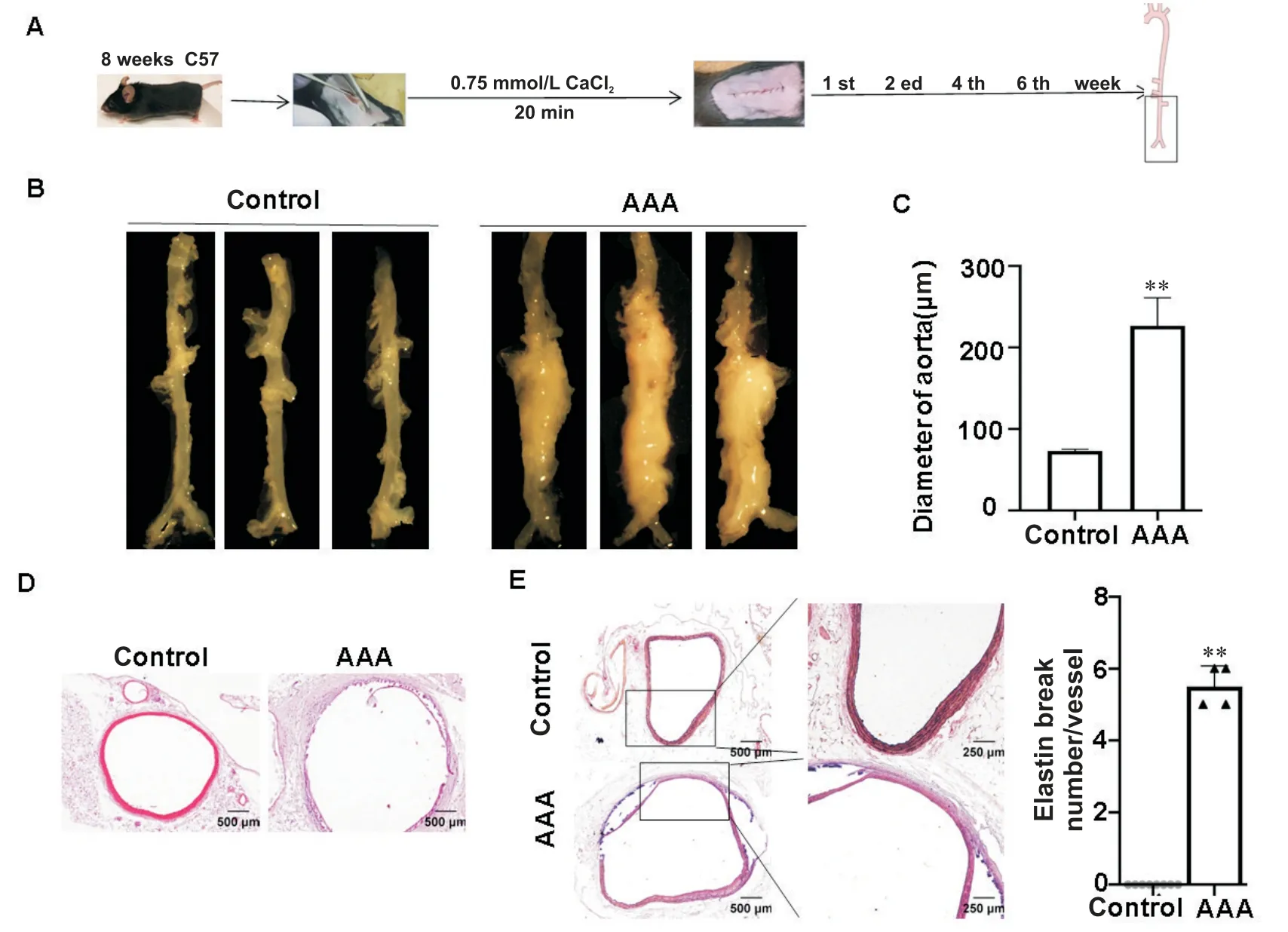
Figure 1. CaCl2-induce AAA model and identification. A:schematic diagram of CaCl2 induced AAA model;B:endoscopic images of the abdominal aorta;C:the maximum diameter of abdominal aorta;D:HE staining;E:elastic fiber staining CaCl2 external application of abdominal aorta for 6 weeks in AAA group. Mean±SD. n=5.**P<0.01 vs control group.图1 CaCl2诱导的AAA模型及其鉴定

Figure 3. Morphological changes of RASMCs and expression of SOD2 and other proteins in RASMCs treated with H2O2. A:morphological changes of RASMCs after H2O2 treatment;B:Western blot results of Bax,Bcl-2,MMP2,MMP9 and SOD2;C:morphological changes of Ad-null/Ad-SOD2-infected RASMCs treated with H2O2;D:apoptosis of RASMCs was detected by flow cytometry. Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;△△P<0.01 vs Ad-null group;#P<0.05,##P<0.01 vs Ad-null+H2O2 group.图3 H2O2处理RASMCs后细胞形态及SOD2等蛋白表达的变化
4 Ad-SOD2 对 H2O2 诱导 RASMCs 线粒体膜电位的影响
检测有/无 Ad-SOD2 感染 RASMCs 时 H2O2诱导的细胞中ROS水平,结果显示SOD2过表达可明显清除ROS,见图4A。同时也检测有/无Ad-SOD2 感染RASMCs 并予以H2O2诱导细胞凋亡中的超氧化物阴离子水平,结果证实SOD2可明显降低超氧化物阴离子荧光水平,提示SOD2可清除ROS中的超氧化物阴离子,见图 4B。检测有/无 Ad-SOD2 感染 RASMCs 时H2O2诱导细胞凋亡后细胞线粒体的膜电位水平,结果提示Ad-SOD2 感染可延缓RASMCs 线粒体膜电位下降,见图4C。
5 Ad-SOD2 基因转移可减轻CaCl2 诱导的小鼠AAA形成
体外细胞实验证实SOD2 可减轻RASMCs 的凋亡,为进一步明确SOD2 在CaCl2外敷诱导AAA 中是否起保护作用,本实验在动物建模时腹腔注射Ad-SOD2(1×109pfu),6 周时取腹主动脉进行检测发现Ad-SOD2 组腹主动脉炎症减轻;HE 检测发现SOD2可延缓腹主动脉直径扩张。弹力纤维染色提示给予Ad-SOD2 腹腔注射后可抑制腹主动脉直径增大,同时减少弹力纤维断裂。见图5。
6 Ad-SOD2 对AAA 小鼠细胞表型和炎症因子的影响
为进一步阐明机制,我们检测了AAA 组腹主动脉的SOD2等表达,结果提示Ad-SOD2组腹主动脉组织中 α-SMA 和 SOD2 的表达较 AAA 组升高,OPN 无明显改变;由大体标本可见Ad-SOD2 组腹主动脉的炎症反应明显减轻,主动脉直径相对减少。检测各组小鼠血清中炎症因子(IL-6、IL-10 和 IL-1β)及MMP9 水平,差异无统计学意义;对照组血清T-SOD的水平较高,AAA 组血清T-SOD 水平明显下降,Ad-SOD2 组又明显升高,差异均有统计学意义。同时AAA组较control组血清SOD2活性有所下降,但差异无统计学意义,而Ad-SOD2 组SOD2 活性明显升高,与AAA相比有显著差异。见图6。

Figure 4. Effect of Ad-SOD2 on mitochondrial membrane potential of H2O2-induced RASMCs. A:ROS levels;B:the level of superoxide anion;C:JC-10 staining. Mean±SD. n=3.*P<0.05,**P<0.01 vs Ad-null group;#P<0.05,##P<0.01 vs Ad-null+H2O2 group.图4 Ad-SOD2对H2O2诱导的RASMCs线粒体膜电位的影响
讨 论
AAA 是一种主动脉疾病,患者早期无典型症状,大多数的AAA 病变在肾动脉水平以下[1]。在发达国家,多数患者在接受其他检查时偶然发现或者常规超声检查发现。流行病学筛查发现AAA的主要危险因素包括:高龄、性别、吸烟、家族史、目前患有心血管疾病(包括无症状性心脏病和外周动脉疾病),高血压和血脂异常。流行病学提示女性患AAA的概率低于男性,超过70 岁曾吸烟的女性AAA 的患病率约1%,AAA的主要并发症是瘤体破裂,据估计全世界每年有15万到20万人死于主动脉瘤破裂。虽然AAA女性患病率较男性低,但因AAA 的形态学和血流动力学特征具有非常明显的性别差异,导致女性AAA 的破裂风险更高。目前主要治疗手段为经典外科手术或主动脉腔内介入治疗,尚无有效的药物手段证实可抑制或逆转主动脉瘤的进展[1]。故迫切需要发现预防、抑制甚至逆转主动脉瘤进展的药物和方法。
目前常用的AAA 动物模型有多种,主要有皮下泵入输注血管紧张素II、弹力蛋白局部灌注、氯化钙或磷酸钙诱导的模型以及异种移植模型等。本研究采用常用的、经济的、技术难度中等的CaCl2诱导的小鼠 AAA 模型[1]。CaCl2可以在组织中产生不溶性盐,引发慢性炎症,从而促进动脉瘤的发展,最终导致外敷CaCl2的主动脉段直径扩大主动脉壁变薄。CaCl2外敷的腹主动脉在组织病理变化包括外膜炎症与细胞浸润,激活炎症信号分子如 JNK 和 NF-κB[7],分泌各种MMPs 并降解弹性纤维等[8]。亦有研究表明磷酸钙诱导的小鼠腹主动脉瘤模型中,主动脉组织弹力纤维断裂明显,炎症加重[9]。这和本研究实验模型结果一致,外敷CaCl2后腹主动脉周围炎症明显增加,弹力纤维破坏明显。同时该模型的不足,主要在于一方面它没有进展到动脉瘤的破裂,另一方面在于此模型动脉瘤不合并动脉粥样硬化或壁内血栓。
Strauss 等[5]采用 TaqMan 法测定基因型,采用ELISA 法测定蛋白浓度,结果证实SOD2 可能通过氧化应激反应参与AAA 的形成。本研究中CaCl2外敷腹主动脉后诱导慢性炎症发生,而炎症发生后ROS增加,是机体自我保护引起SOD2应激性增加以利于清除ROS所致。为探讨SOD2对小鼠AAA的影响,我们采用致病性低、转导效率高、无宿主细胞基因组整合的腺病毒为载体的Ad-SOD2腹腔注射诱导小鼠SOD2过表达。本研究检测了CaCl2诱导的AAA 小鼠血清中促炎因子(IL-6 和IL-1β)和抗炎因子(IL-10),结果均无显著差异。支持这一结果的是,有报道称CaCl2诱导的AAA 模型中,动脉瘤组织局部炎症因子有明显变化,但循环血中炎症因子差异无统计学意义[8]。我们同时检测了血清T-SOD 和SOD2活性,结果提示AAA 早期T-SOD 活性明显升高,随后呈下降趋势,而SOD2 活性在外敷CaCl21 周时最高,随后亦逐渐下降。这些结果提示在AAA发病过程中SOD活性随之改变。理论上SOD2可减轻炎症反应,而本研究观察到,腹腔注射Ad-SOD2诱导SOD2过表达的AAA小鼠的腹主动脉炎症明显减轻,弹力纤维破坏减少,同时主动脉直径的进展受到抑制,与理论推测一致。这些结果提示SOD2可延缓CaCl2诱导的AAA进展。

Figure 5. Protective effect of Ad-SOD2 on CaCl2-induced AAA in mice. A:schematic diagram of CaCl2-induced AAA model;B:endoscopic images of the abdominal aorta and the maximum diameter of the abdominal aorta;C:HE staining;D:elastic fiber staining. Mean±SD. n=5.**P<0.01 vs control group;##P<0.01 vs AAA group.图5 Ad-SOD2在CaCl2诱导的小鼠AAA中的保护作用
ROS 主要来源于线粒体,能激活细胞信号传导,增加促炎细胞因子的产生和释放,从而维持炎症反应。而炎症反应亦可引起氧化应激,加重细胞损伤。ROS 的相对过量积累会破坏细胞内稳态,导致氧化应激和线粒体功能障碍,进一步产生ROS。同时MMP2 和MMP9 被认为是细胞外基质降解中最重要的两种MMPs,也是AAA 形成和发展的关键因素[10]。早期一项由弹力蛋白酶诱导的小鼠AAA 模型表明,早期病变组织SOD2 升高,同时MMP2 的活性升高[11]。而本研究细胞实验结果证实伴随OS 诱导细胞凋亡越明显MMP2、MMP9 的表达亦越高,和这项研究结果基本一致。本研究采用细胞流式术检测结果证实SOD2 可明显抑制RASMCs 凋亡。同时证实H2O2所致氧化应激诱发细胞凋亡时ROS 水平升高、超氧阴离子水平升高同时细胞线粒体膜电位明显下降。而给予Ad-SOD2后ROS及超氧阴离子水平明显下降,同时延缓了线粒体膜电位下降,说明SOD2 对线粒体膜电位有一定的保护作用。
本研究的最大缺陷在于未能排除同龄小鼠腹主动脉起始直径的差异;同时该模型由给予外敷CaCl2造成急性炎症所致,而人患AAA多由慢性炎症所致,这与人类的AAA 发病机制亦有所不同,故不能完全模拟AAA的发病机制;因为该模型为急性起病,亦不利于长期的临床药物研究。但是动物实验结果提示SOD2 可通过减轻主动脉周围炎症、减少主动脉壁内弹力纤维破坏从而对AAA起一定的保护作用。这对临床AAA的治疗提供新的治疗方向和治疗靶点。也为进一步研究AAA发病机制提供了新思路。
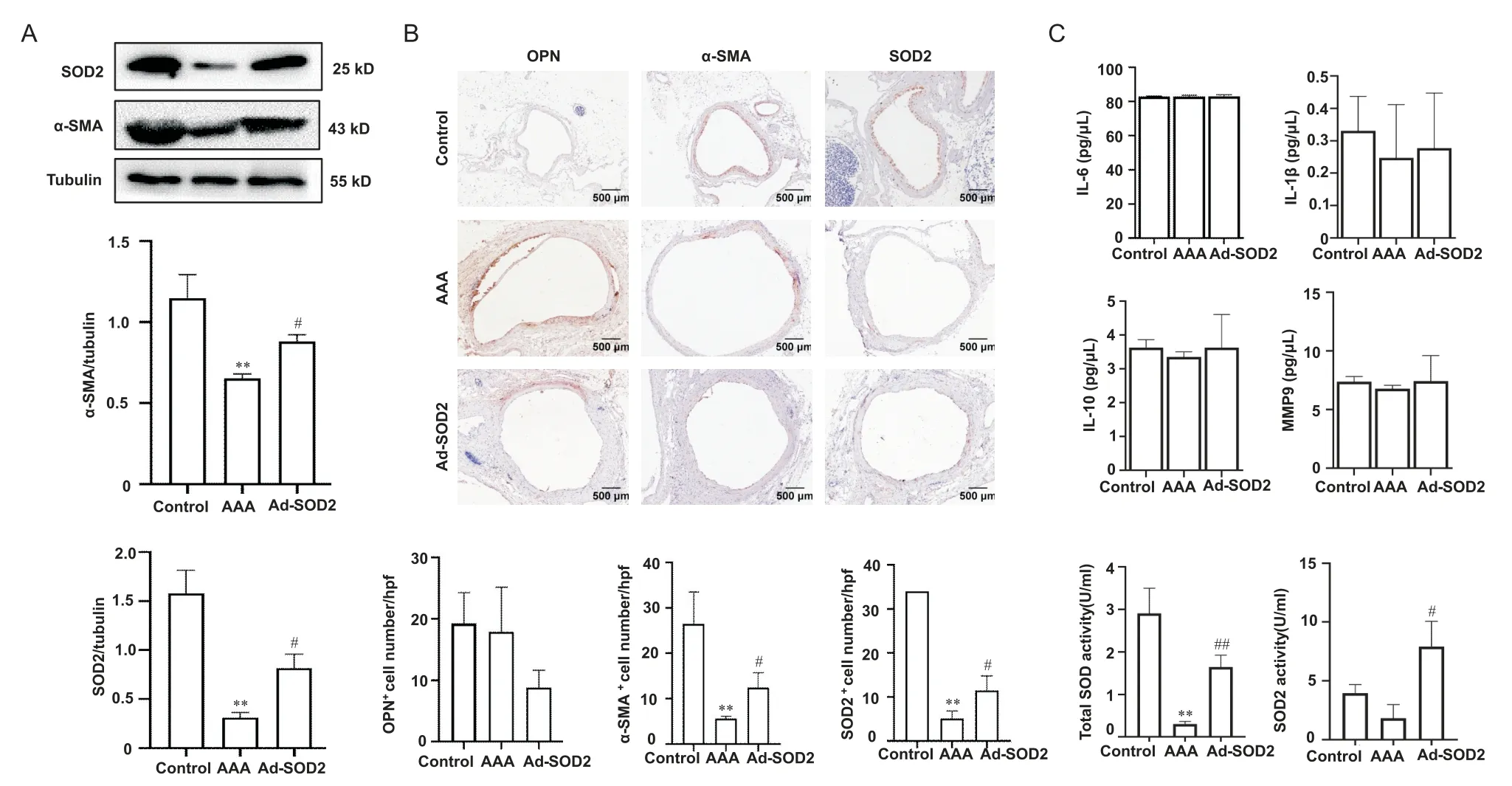
Figure 6. Effects of Ad-SOD2 transfer on expression of inflammatory factors in AAA mice. A:Western blot results of α-SMA and SOD2;B:immunohistochemical staining of α-SMA,OPN and SOD2;C:the content of IL-6,IL-10,IL-1β and MMP9,and the activity of SOD2 and total SOD. Mean±SD. n=5.**P<0.01 vs control group;#P<0.05,##P<0.01 vs AAA group.图6 Ad-SOD2腹腔注射对AAA小鼠主动脉细胞表型和炎症因子的影响

