肉桂醛对神经胶质瘤U251细胞生物学行为的影响
白敬洋 桂志勇 叶党华
胶质瘤是颅内最常见的原发性恶性肿瘤[1,2],近年来在临床治疗方面虽然取得了一定的进展,但预后仍不理想[1]。肉桂醛是肉桂挥发油的主要成分,具有抗菌、抗氧化、抗肿瘤等作用[2~5]。本文探索肉桂醛对胶质瘤细胞增殖、侵袭、迁移和凋亡的影响。
1 材料与方法
1.1 实验材料 人神经胶质瘤细胞系U251 购自中国上海科学院生物化学与细胞生物学研究所;肉桂醛(纯度98%)购自上海纯优生物科技有限公司;CCK-8试剂盒、超敏ECL化学发光试剂盒购自上海碧云天生物科技有限公司;结晶紫染色试剂盒购自上海哈灵生物科技有限公司;Annexin V-FITC/PI 凋亡检测试剂盒购自美国Sigma-Aldrich 公司;小鼠抗人p-PI3K、PI3K、p- Akt、Akt、C- Myc、cycling- D、βcatenin、Cleaved-Caspase-3、Bcl-2、Bax 抗体购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗小鼠IgG购自生工生物工程(上海)股份有限公司。
1.2 细胞培养与分组 将人神经胶质瘤细胞系U251置于含10%胎牛血清的DMEM中培养,分为对照组、低剂量肉桂醛组和高剂量肉桂醛组。肉桂醛组分别加入40 μmol/L、80 μmol/L 肉桂醛,而对照组加入等体积肉桂醛溶剂二甲基亚砜。
1.3 平板克隆形成实验 将U251 细胞悬液接种于含10%胎牛血清的细胞培养基中培养2周;PBS清洗细胞3次,甲醇固定并用结晶紫染色,拍照并分析。
1.4 CCK-8 检测细胞增殖能力 将U251 细胞按104个/孔接种到96 孔板培养24 h、36 h、48 h、72 h,根据试剂盒说明书每孔加入10 μl CCK-8 试剂孵育2 h,酶标仪检测450 nm波长处吸光度值。
1.5 流式细胞术检测细胞凋亡 收集细胞,使用预冷PBS 轻柔冲洗,并用200 μl 结合缓冲液重悬细胞。按照Annexin-v-FITC/PI 试剂盒说明操作,分别加入Annexin V-FITC 与PI 试剂在避光条件下染色15 min,流式细胞仪检测细胞凋亡率。
1.6 Transwell 小室实验 将U251 细胞接种于有Matrigel基质的上室,加入不含胎牛血清的200 μl培养液;下室加入含10%胎牛血清培养液500 μl。培养1 d 后,用棉签除去上室膜上未迁移的细胞,而通过基质膜完成侵袭的细胞用甲醇固定,并用0.1%结晶紫溶液染色,对侵袭细胞进行检查和计数。
1.7 细胞划痕实验 在6 孔板底部用marker 笔画出2条横线,间隔为5 mm,然后将U251 细胞接种于6 孔板培养,每孔加入2 ml 含10%胎牛血清的细胞培养基。待细胞密度达80%后,用200 μl 吸管尖沿6 孔板底部横线垂直刮擦细胞培养板。用PBS冲洗每孔细胞3 次,然后丢弃清洗液,以除去未贴壁的细胞,加入含有不同浓度肉桂醛的新培养基。倒置显微镜拍照记录各组在不同时间点(0 h、36 h)的划痕面积,利用Image J软件计算划痕距离变化。
1.8 免疫印迹法检测蛋白表达 提取细胞总蛋白,测定蛋白质浓度,SDS-PAGE电泳分离蛋白,并转移到PVDF膜上;用5%脱脂奶粉封闭PVDF膜1 h,加入一抗[Bcl-2(1:1 000)、Cleaved-Caspase-3(1:500)、Bax(1:500)、p-PI3K(1:300)、PI3K(1:300)、p-Akt(1:300)、Akt(1:300)、C-Myc(1:400)、cycling-D(1:500)、β-catenin(1:500)和β-actin(1:500)]4 ℃孵育过夜;用辣根过氧化物酶标记山羊抗小鼠IgG(1:2 000)室温孵育1.5 h;使用超敏ECL 化学发光试剂盒作用后,Image J软件进行蛋白质定量分析。
1.9 统计学分析 使用Graphpaid 8.0 软件分析;计量资料以±s表示,采用单因素方差分析和Tukey 检验;P<0.05为差异具有统计学意义。
2 结果
2.1 肉桂醛抑制U251 细胞增殖 与对照组比较,肉桂醛组细胞集落形成能力、细胞增殖能力明显下降(P<0.01);而且,随剂量增大,肉桂醛抑制细胞增殖作用显著增强(P<0.01)。见图1。
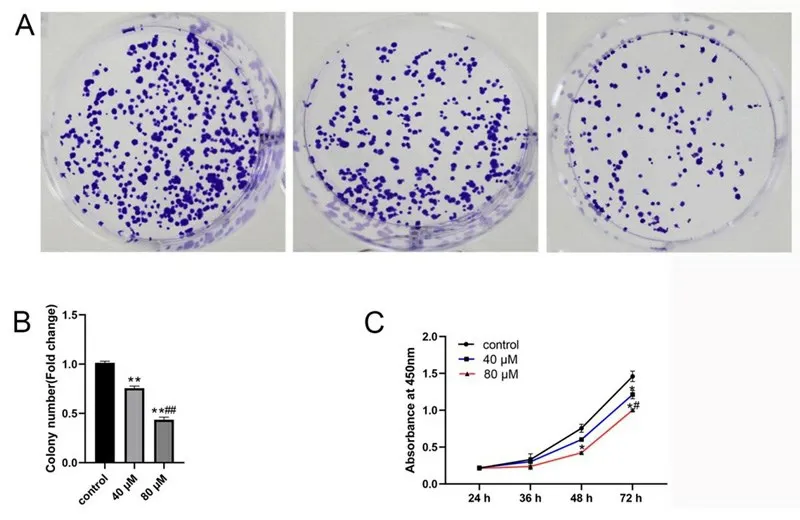
图1 肉桂醛对胶质瘤U251细胞增殖的影响
2.2 肉桂醛促进胶质瘤细胞凋亡 与对照组相比,肉桂醛组细胞凋亡率显著增加(P<0.05),抗凋亡蛋白Bcl-2 表达显著降低(P<0.05),促凋亡蛋白Bax 和Cleaved caspase-3 表达显著增加(P<0.05);而且,随剂量增大,肉桂醛抑制细胞凋亡作用显著增强(P<0.05)。见图2。

图2 肉桂醛对胶质瘤U251细胞凋亡的影响
2.3 肉桂醛抑制胶质瘤细胞侵袭和迁移 与对照组相比,肉桂醛组侵袭细胞数量明显降低(P<0.05),划痕距离明显增大(P<0.05);而且,随剂量增大,肉桂醛抑制细胞侵袭和迁移作用明显增强(P<0.05)。见图3。
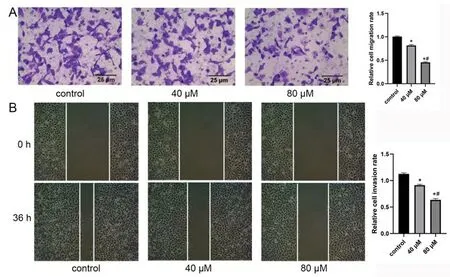
图3 肉桂醛对胶质瘤U251细胞侵袭和迁移的影响
2.4 肉桂醛能抑制PI3K/Akt和Wnt/β-catenin信号通路 与对照组相比,肉桂醛组细胞p-PI3K/PI3K 比值、p-Akt/Akt 比值和cycling D、C-Myc、β-catenin 蛋白表达显著降低(P<0.05);而且,随剂量增大,肉桂醛对细胞PI3K/Akt 和Wnt/β-catenin 信号通路抑制作用显著增强(P<0.05)。见图4。
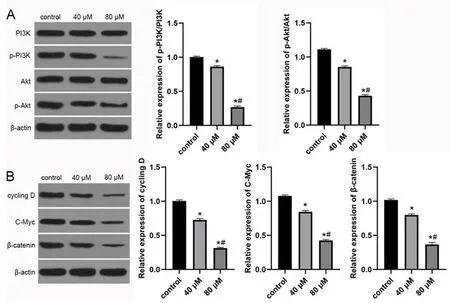
图4 肉桂醛对胶质瘤U251细胞PI3K/AKT和Wnt/β-catenin信号通路的影响
3 讨论
目前,胶质瘤仍然是神经外科最大的挑战之一[6]。化疗等技术虽然可以带给病人良好的治疗效果,但同时也会产生副作用损害身体。近年来,中医药防治神经胶质瘤的探索与研究逐渐成为热点。肉桂的主要活性成分肉桂醛能抑制多种肿瘤,但其潜在机制尚不完全清楚。本实验结果表明肉桂醛可能通过Wnt/β-catenin 和PI3K/Akt 信号通路抑制神经胶质瘤细胞增殖、迁移和侵袭,促进细胞凋亡。
研究表明,Wnt/β-catenin 信号通路的异常激活和β-catenin 的高表达与胶质瘤的异常组织学形态和细胞的异常增殖分化有关[7]。当β-catenin 在细胞质中积累到特定浓度时,开始转向细胞核,并与核转录因子结合,导致下游靶基因启动因子的激活,引起细胞异常增殖和凋亡抵抗,促进肿瘤的形成[8]。cycling D、C-Myc 是Wnt/β-catenin 信号通路的下游因子。cycling D 是调节细胞进入增殖期的主要因子,在多种肿瘤细胞中高表达,其异常表达会导致细胞周期运行失控和细胞恶性转化[9]。C-Myc 是Wnt信号通路的靶基因。研究表明,肉桂醛可以通过抑制Wnt/β-catenin 信号通路抑制骨肉瘤细胞活性[10]。此外,肉桂醛还可以通过抑制Wnt/β-catenin 信号通路诱导非小细胞肺癌细胞凋亡并逆转上皮-间充质转化,从而达到遏制肿瘤发生发展的作用[11]。本研
A.Transwell 小室检测细胞侵袭的能力;B.划痕实验检测细胞的迁移能力;与control 组相比较,*P<0.05,**P<0.01;与40 μM 组相比,#P<0.05,##P<0.01;control.对照组;40 μM.低剂量肉桂醛组;80 μM.高剂量肉桂醛组究的结果反映肉桂醛通过下调β-catenin 以及下游靶蛋白cycling D、C-Myc的表达,抑制Wnt/β-catenin信号通路。此外,本实验结果显示肉桂醛显著抑制PI3K 与Akt 的磷酸化,从而抑制PI3K/Akt 通路。PI3K/Akt通路在调节肿瘤细胞的增殖和生存中发挥重要作用[12]。PI3K/Akt 不仅抑制肿瘤细胞凋亡,而且诱导肿瘤细胞周期进展[13]。有研究报道激活Akt可以诱导多种抗凋亡蛋白的表达或通过多种信号耦合途径抑制细胞凋亡[14]。Akt 是PI3K 信号通路中重要的下游靶点。Akt被激活后,可以通过磷酸化多种胞内底物蛋白来调节其活性。研究表明肉桂醛可以通过PI3K/AKT 通路抑制卵巢癌细胞的上皮间质转化过程,从而抑制卵巢癌进展[15]。在人结直肠癌细胞中,肉桂醛可以通过抑制PI3K/Akt的转录功能,从而抑制肿瘤细胞增殖、迁移和侵袭等生物学行为[16]。
本文存在一定的局限性,例如未采用基因沉默/过表达等方法明确肉桂醛是否通过PI3K/Akt和Wnt/β-catenin 信号通路来发挥抑制神经胶质瘤作用。此外,本文仅用了一株神经胶质瘤细胞系U251,还需使用多株细胞加以验证。
综上所述,肉桂醛抑制胶质瘤细胞增殖、侵袭、迁移,促进细胞凋亡,其机制可能与下调PI3K/Akt和Wnt/β-catenin信号通路有关。

