1 132例早产儿感染病原菌的分布特征及耐药性分析*
杜欣欣,张金铃,杨萌婷,王鉴***
(1.贵州医科大学 临床医学院,贵州 贵阳 550000;2.贵州医科大学附属医院 新生儿科,贵州 贵阳 550004)
新生儿感染是导致新生儿死亡的重要原因之一,早产儿由于免疫系统不成熟、住院时间延长及频繁接受侵入性的操作更易发生感染,也使其成为院内感染的高危群体[1-3]。新生儿感染的主要致病菌及临床特征不尽相同、且临床表现具有不典型性及非特异性、早期确诊较为困难,作为金标准的细菌培养标本所需等待时间长、检出阳性率低,检出结果相对滞后;因此,临床工作中常在细菌培养及药敏结果回报前必须进行经验性抗生素治疗。广谱抗生素的广泛使用可能诱导敏感病原菌发生基因突变继发耐药,近年来新生儿感染由多重耐药菌(multidrug-resistant organisms,MDROs)引起的报道日益增多[4-5],给新生儿院内感染的防控带来了严峻挑战[6]。由于不同地区及医院新生儿感染病原菌分布、耐药性有一定差异,本研究拟通过分析本院新生儿重症监护病房(neonatal intensive care unit,NICU)早产儿的感染情况、病原菌类型及耐药情况,为合理使用抗生素提供参考。
1 对象与方法
1.1 研究对象
选取2019年1月1日—2020年12月31日NICU收治的胎龄<37周新生儿(早产儿)为研究对象,要求新生儿感染性疾病诊断标准符合第5版《实用新生儿学》[7]标准,院内感染诊断标准符合《医院感染诊断标准(试行)》[8],且为本院分娩、生后当天由产科直接转入新生儿科,排除住院48 h内死亡或放弃治疗、母亲病历资料不完整者。共纳入早产儿1 132例,男632例、女500例,胎龄26~36+6周,出生体质量890~3 950 g;按出生胎龄及出生体质量分组,其中出生胎龄<28周、28≤~≤31+6周、32≤~≤33+6周及34≤~≤36+6周,分别为超早、极早、中期及晚期早产儿;按出生体质量<1 000 g、1 000 g≤~≤1 499 g、1 500 g≤~≤2 499 g、2 500 g≤~≤3 999 g,分别为超低、极低、低及正常体质量早产儿组。本研究经医院伦理委员会(2020伦审第278-01号,2021伦审第665号)批准。
1.2 研究方法
1.2.1资料收集 通过查阅电子病历,收集新生儿临床资料,包括性别、胎龄、出生体质量、主要诊断、侵袭性操作[气管插管、经外周中心静脉置管(peripherally inserte central catheter,PICC)]、机械通气情况、静脉营养及住院时间等。
1.2.2标本采集 对怀疑感染的患儿,在使用抗生素前均完善血培养,有呼吸道症状症状或体征者完善痰培养,未开奶患儿入院时即完善胃液培养,从患儿血液、痰液、尿液、分泌物液或导管等收集病原菌标本,按微生物标本专家共识[9]中规定的方法采集后立即送检;如患儿住院期间发生疑似院内感染或感染表现时,再次行病原学检查,据病情酌情完善PICC导管尖端或气管导管尖端培养、痰培养或其他感染部位标本培养。
1.2.3细菌培养鉴定及药物敏感试验 取1.2.2项下标本按照《全国临床检验操作规定》使用BD BACTECTMFX全自动微生物培养仪(美国BD公司)进行细菌培养,若24~48 h内出现细菌生长报警,则使用MicroScan WalkAway 96 plus全自动细菌鉴定药敏分析仪(美国Beckman Coulter公司)进行细菌鉴定及药敏试验;若持续培养5 d后无细菌生长报警,观察至第7天,则认定为无细菌生长。药敏试验结果判定参照美国临床实验室标准化研究所(clinical and laboratory standars institute,CLSI)标准[10]。
1.3 统计学分析
使用SPSS 26.0 统计软件处理及分析数据,计数资料以例或率(%)表示。
2 结果
2.1 感染发生情况
2019—2020年纳入早产儿1 132例,590例确诊感染,感染检出率为52.12%(590/1 132);其中448例患儿有明确感染部位,142例无明确感染部位,共感染624例次(包括双重感染或多重感染)。感染性疾病前三依次为肺炎(424例次)、脓毒症(142例次)、细菌性脑膜炎(20例次)。32例发生院内感染,早产儿院内感染检出率为2.83%(32/1132),共感染38例次,感染检出部位为血液(共22例次)和呼吸道(共16例次)。
2.2 早产儿感染的病原菌分布
590例感染早产儿共检出病原菌271株(排除污染或定植21株),主要分离自痰液163株(60.15%)、血液66株(24.35%)及胃液32株(11.81%);其中革兰阴性菌202株(74.54%)、革兰阳性菌66株(24.35%)、真菌3株(1.11%),以克雷伯菌属(主要为肺炎克雷伯菌)、黏质沙雷菌、肠杆菌属(主要为大肠埃希菌)、表皮葡萄球菌、粪肠球菌为主。见表1。
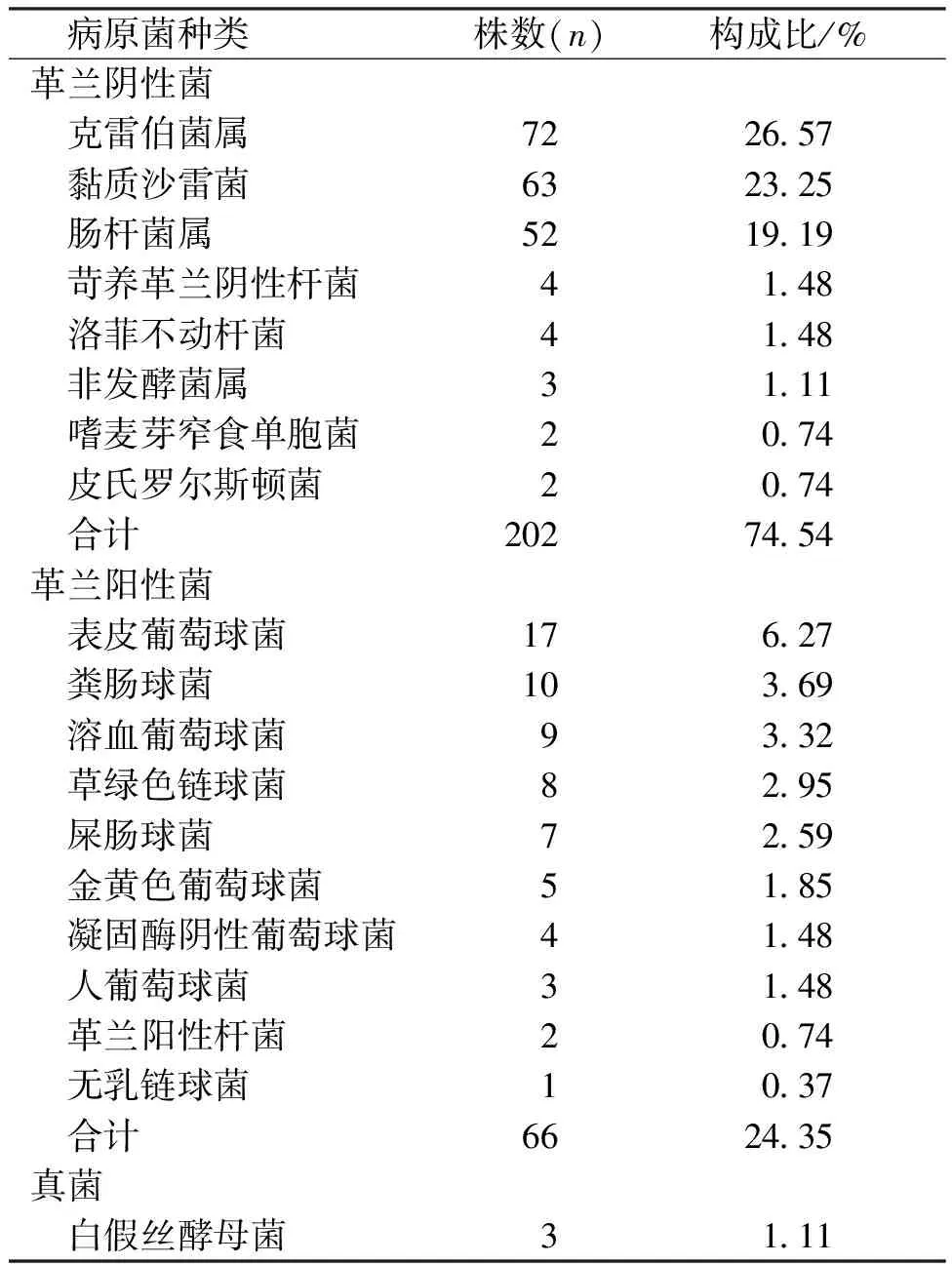
表1 早产儿感染的病原菌分布
2.3 不同胎龄及不同出生体质量早产儿感染的主要病原菌
各胎龄组早产儿检出菌株均以革兰阴性菌为主,革兰阴性菌以超早及极早产儿组检出株数最多、检出比例最高;革兰阳性菌在中期早产儿组中检出株数最多,在晚期早产儿组检出比例最高;革兰阴性菌主要分布于超低、极低出生体质量儿组及低出生体质量儿组,革兰阳性菌及真菌在各组间检出株数相同,在正常出生体质量儿组检出比例最高(表2)。
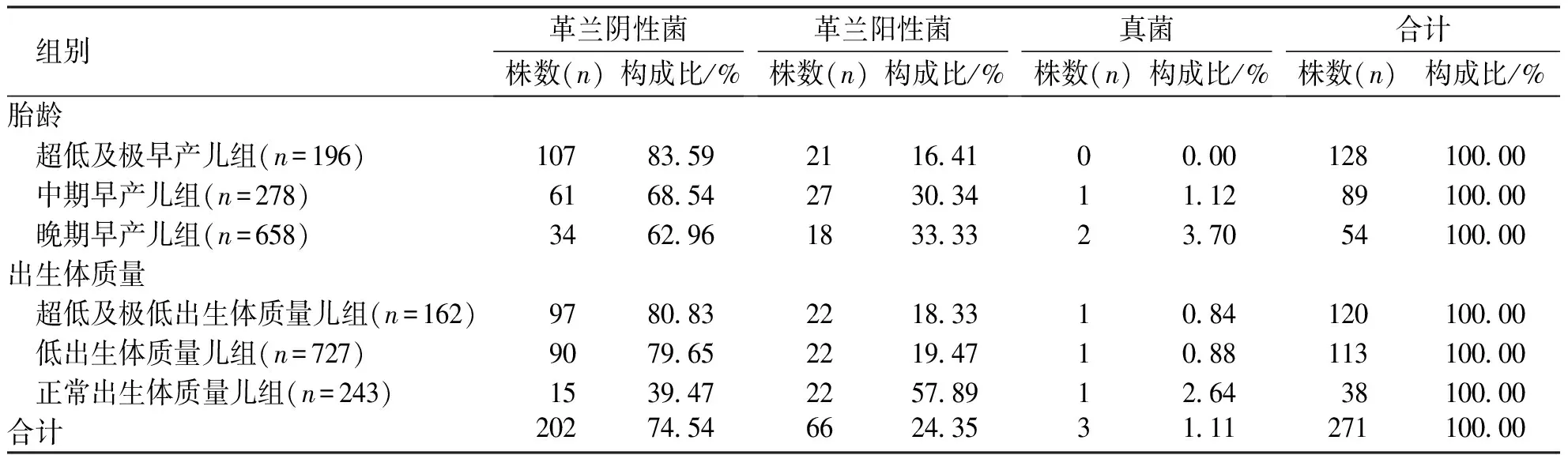
表2 不同胎龄和出生体质量组早产儿感染的主要病原菌构成
2.4 早产儿感染的病原菌标本分布及主要致病菌构成
164例病原学检查结果阳性患儿中,共送检各类型标本1 055份,检出阳性标本271份,检出率为25.69%(271/1 055);其中痰培养检出率最高、占阳性菌株60.15%(163/271),检出主要病原菌为肺炎克雷伯菌、黏质沙雷菌等革兰阴性菌;其次为血培养占24.35%(66/271),主要病原菌为表皮葡萄球菌等革兰阳性菌;胃液培养阳性率为11.81%(32/271),检出病原菌以肠杆菌(大肠埃希菌)为主;除此之外,真菌全部由胃液培养检出。
2.5 院内感染早产儿的病原菌分布
32例发生院内感染患儿中,检出主要标本部位为血液、呼吸道,检出菌株38株(排除同患儿相同时间及部位的重复菌株),以革兰阴性菌为主,其中黏质沙雷菌检出最多;检出革兰阳性菌中以表皮葡萄球菌为主。药敏试验均提示多重耐药,其中产超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)的菌株10株(表3)。
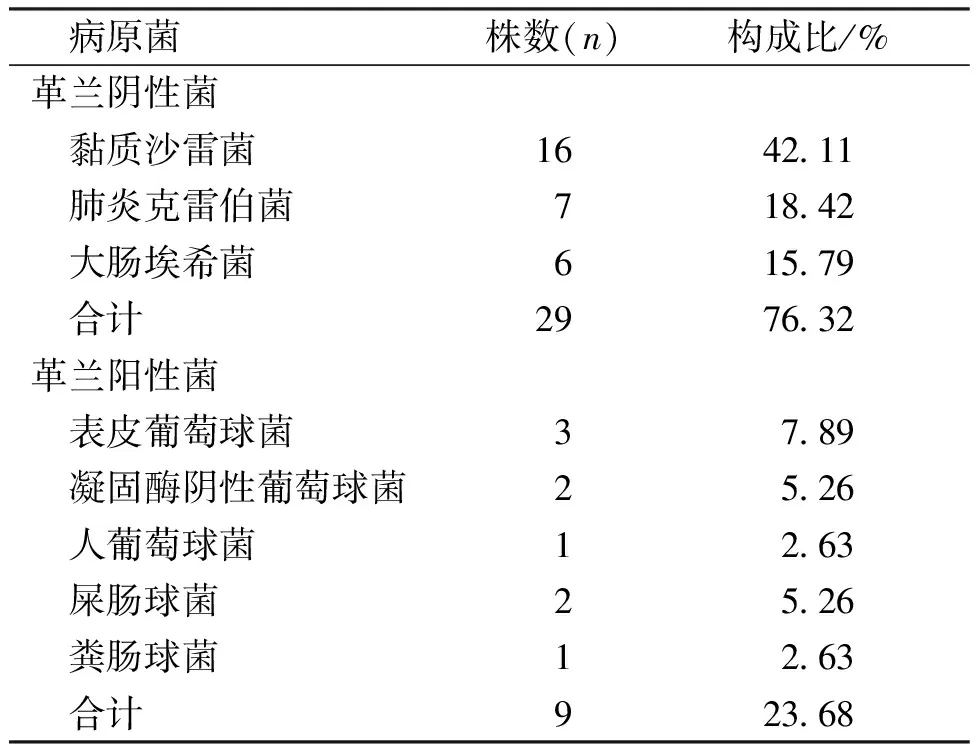
表3 院内感染早产儿的感染病原菌分布
2.6 常见革兰阴性菌的耐药性分析
590例发生感染早产儿检出的主要革兰阴性菌中,肺炎克雷伯菌对氨苄西林、第三代头孢菌素类、氨基糖苷类、磺胺类耐药率为47.69%~96.92%,对碳青霉烯类抗生素耐药率低于10%;黏质沙雷菌对喹诺酮类、氨基糖苷类、磺胺类、碳青霉烯类抗生素耐药率低,均在10%以下;大肠埃希菌对各类抗生素均有不同程度耐药,耐药率为31.03%~68.97%,未检出对碳青霉烯类耐药菌株(表4)。
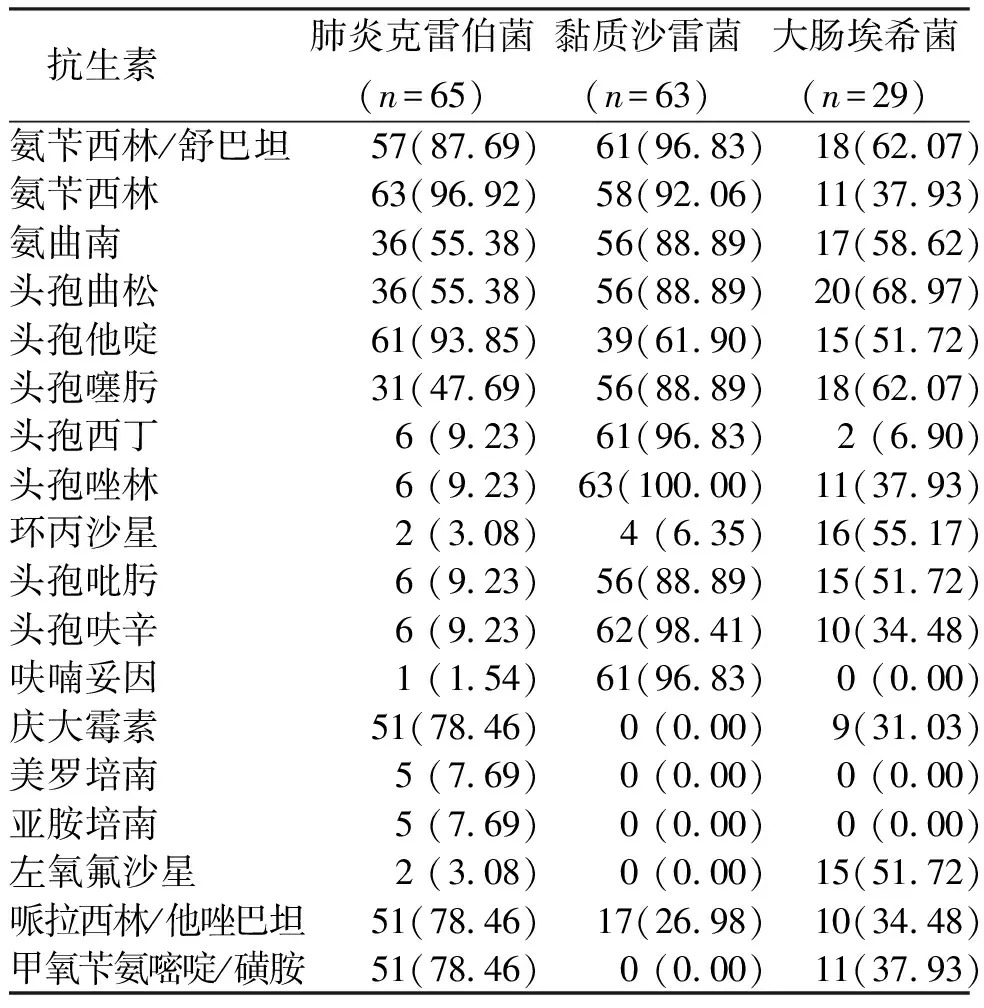
表4 感染早产儿标本中常见革兰阴性菌的耐药情况[n(%)]
2.7 常见革兰阳性菌的耐药性分析
所检出的凝固酶阴性葡萄球菌(coagulase negativestaphylococcus,CoNS;表皮葡萄球菌、溶血葡萄球菌)对青霉素类、3代头孢菌素类抗生素全部耐药,粪肠球菌对青霉素类、利福平未出现耐药性,对其余各类抗生素均有不同程度耐药(表5)。
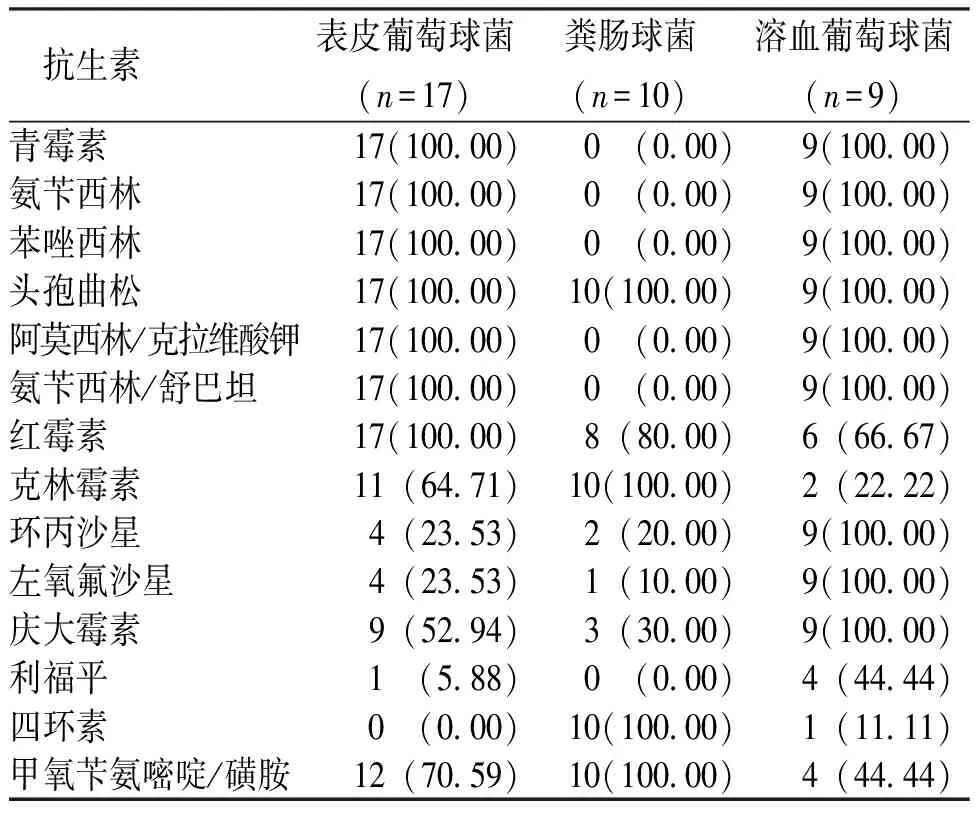
表5 感染早产儿标本中常见革兰阳性菌的耐药情况[n(%)]
3 讨论
本组资料显示,早产儿感染检出率为52.12%,与刘晓兰[11]研究一致,感染部位以下呼吸道为主,与国内相关报道一致[12];新生儿,尤其是胎龄小、出生体质量低的早产儿,因肺部结构及功能上的发育极不成熟,且生后常需呼吸机辅助通气,肺部感染风险增加[13]。早产儿院内感染检出率为2.83%,感染检出部位为血液、呼吸道,考虑为机械通气、PICC置管、动静脉置管及肠外营养等有创操作增加了细菌进入血液循环的可能性[14]。另外,早产儿长时间的呼吸机辅助通气、反复吸痰会降低支气管纤毛摆动,破坏气道黏膜屏障功能,从而增加肺部感染风险[13]。与国内外相关报道[15]相比,本院早产儿院内感染检出率相对较低,感染主要部位略有差异,考虑不同地区、不同医院院内感染发生情况具有差异性,医院感染防控力度及措施的策略不同,也会导致感染发生率及发生部位的不同。本院早产儿院内感染检出率低于国内相关报道,这与近年本院对新生儿院内感染高度重视,制定新生儿病房医院感染管理的制度、措施及流程,加强各级医务人员培训、督导,抓医院感染关键环节,如医务人员手卫生、喂养、沐浴、配液及侵袭性操作等密不可分。在临床工作中,应提倡母乳喂养、尽早达全肠内营养,进一步加强对患儿病情评估、严格掌握机械通气及侵入性操作指征,严格无菌操作,减少早产儿院内感染。
本组资料中痰培养检出阳性率最高,检出致病菌以革兰阴性菌株为主,以肺炎克雷伯菌最多,与国内相关文献报道一致[16];血培养则以表皮葡萄球菌检出最多,与本单位2013—2018年血培养检出主要病原菌一致[17],也与国内报道一致[18];在不同胎龄、不同出生体质量患儿病原菌分布上,胎龄越小、出生体质量越低,检出革兰阴性菌比例越高。早产儿尤其是极早产儿/超早产儿、极低/超低出生体质量儿,由于生存能力差,常需呼吸机辅助通气,易发生条件致病,而肺炎克雷伯菌、大肠埃希菌等主要革兰阴性菌可定植于患儿黏膜及呼吸机管道等非生物表面,为呼吸道常见致病菌[19]。CoNS是NICU的重要致病菌之一,常定居与皮肤黏膜表面,其感染途径主要为侵入性操作如气管插管、PICC置管及皮肤接触等[7,14]。尽管有研究者认为血培养中表皮葡萄球菌是常见的污染菌,且临床表现较轻,不一定是真正的病原体,但仍应该引起足够重视,尤其是发生在皮肤完整性受到破坏的极早和超早产儿、极低及超低出生体质量儿机体时,更易经皮肤屏障而发生感染[7]。
本研究显示早产儿发生院内感染检出主要病原菌为革兰阴性菌且以黏质沙雷菌为主,检出菌株均为MDROs,与相关报道[20]一致。黏质沙雷菌是近些年来引起医院感染的重要致病菌,尤其在重症监护室可导致多次暴发感染[21]。黏质沙雷菌在医疗器械表面或消毒液中能存活几个月,难以完全消灭[21],而且可以产生β内酰胺酶,对头孢菌素类和氨基糖苷类抗生素易发生耐药。国内散发病例逐渐增多,应该高度关注,尤其是在胎龄小、体质量低的早产儿中。
不同病原菌对抗生素耐药性存在差异,且同一菌种对不同抗生素耐药性也有所不同。本研究结果显示,早产儿感染中常见革兰阴性菌对临床常用药物如头孢菌素类、青霉素类等抗生素均具有较高耐药性;而院内感染患儿MDROs检出产ESBLs菌株,如肺炎克雷伯菌、大肠埃希菌。有研究显示,肺炎克雷伯菌的耐药机制与β-内酰胺酶密切相关,可以通过多种途径使产酶菌株由敏感菌变成致病菌,产ESBLs肺炎克雷伯菌株可经质粒介导将耐药性传递给大肠埃希菌等革兰阴性菌,而引起耐药性的扩散,造成院内感染的暴发与流行[22]。除此之外,由于广谱抗生素的广泛使用,产ESBLs的肺炎克雷伯菌株通携带对多种抗菌药物的多种耐药基因,从而引起多重耐药[23]。本研究中虽检出对碳青霉烯类抗生素耐药率低,但近些年来对碳青霉烯类药物耐药菌株报道也逐渐增多[4],仍应引起重视;另一方面,肺炎克雷伯菌可定植于生物或非生物体表面,有极强的生物膜形成能力,而生物膜的形成会使其引起的感染呈现静止期与急性发作期交替的现象,导致感染容易复发且难以根治,久之产生耐药性[24]。而常见的条件致病菌如黏质沙雷菌、大肠埃希菌等,在医院环境中广泛存在,早产儿因自身特点,可经多种途径感染,导致早产儿发生医院内感染。因本研究对头孢哌酮钠舒巴坦钠未行该药物药敏试验,故未能统计其耐药率,临床中仍需加强3代头孢类抗生素的管理,以避免产生多重耐药。本研究中早产儿感染革兰阳性菌未发现对利奈唑胺、万古霉素耐药菌株,与相关研究一致[17,25]。这可能与新生儿病房将青霉素钠作为基本用药广泛使用有关,提示在以后的临床工作中,对于怀疑革兰阳性菌感染患儿,应当更加慎重使用青霉素,如何正确合理应用万古霉素为亟待解决的问题。
综上所述,对出生胎龄小、出生体质量低的早产儿,预防、控制感染性疾病的暴发,尽可能减少侵入性操作并严格遵守无菌操作原则,严格掌握机械通气指征以缩短机械通气时间;定期开展细菌药敏监测,及时了解所在地区所在医院的感染性疾病分布情况及病原菌分布、药敏情况,实施有效预防,帮助临床医生进行经验性治疗,降低医院感染发生率,也为合理使用抗生素提供参考依据。

