缺氧诱导Caveolin-1靶向Vimentin调控肝癌细胞迁移及侵袭*
李英,王兴,李永宁,刘鹏,刘松柏,潘耀振
(贵州医科大学 临床医学院 外科学教研室,贵州 贵阳 550004)
如何有效防治肝癌的复发及转移是改善肝癌患者预后、提高生存率的关键[1]。缺氧是实体肿瘤微环境的基本特征之一,在肿瘤的生长、转移、放化疗耐药中发挥重要作用[2-5]。缺氧标志物在肝癌中可作为独立预后因素,其表达预示着肝癌患者的不良预后[6]。缺氧参与恶性肿瘤侵袭、转移的一个重要机制就是对肿瘤细胞上皮间质转化(epithelial-mesenchymal transition, EMT)的调节作用[7-8]。EMT是由调节因子经过各种信号转导通路导致上皮细胞特性消失,而表达间质细胞特性的细胞转化过程。研究证实,EMT的发生可促进肝癌的侵袭及转移[9-10]。小窝蛋白-1(caveolin-1, CAV1)是细胞膜小窝(caveolae)的主要支架蛋白,参与了细胞增殖、信号转导,影响了肿瘤的发生、发展和转移[11-12],其异常表达在多种类型的肿瘤中被研究报道,特别是在晚期癌症转移灶中表达明显上调[13]。CAV1的过度表达与肿瘤侵袭性临床行为和不良预后密切相关,在肝癌中已有少数研究报道[14-15]。然而,CAV1在缺氧条件下的作用机制尚不清楚,本研究旨在分析CAV1表达与缺氧微环境的关系,探讨其对肝癌细胞迁移、侵袭能力的影响及分子机制。
1 材料与方法
1.1 材料
正常肝细胞系LO2及肝癌细胞系HepG2、HCC-9810、MHCC-97H和Hep3B购自上海生科院细胞资源中心,DMEM培养基、0.25%胰蛋白酶及胎牛血清购自Gibco公司,青霉素-链霉素双抗购自Hyclone公司,CAV1、Vimentin、E-cadherin及N-cadherin抗体购自武汉三鹰公司,β-actin抗体购自CST公司,羊抗鼠及羊抗兔二抗购自博士德生物公司,siRNA及转染试剂盒购自锐博生物科技公司,Protein A+G Agarose beads购自碧云天公司,CCK-8试剂盒购自日本同仁。
1.2 研究方法
1.2.1细胞培养及缺氧模型构建 细胞接种于含10%胎牛血清及1%青链霉素双抗的DMEM培养基中,于37 ℃、5% CO2的恒温培养箱中常规培养。取生长状态良好的MHCC-97H与Hep3B细胞接种于96孔板中(4 000个/孔),待细胞贴壁后,更换为含50、100、150、200、250 μmol/L氯化钴(CoCl2)的培养基继续培养24 h,对照组不予CoCl2干预,采用CCK-8法检测细胞活力。选取100 μmol/L CoCl2分别处理细胞0、12、24、48、72 h后, CCK-8法检测不同时间下细胞活力。酶标仪检测波长为450 nm,细胞活力(%)=(处理组OD450值/对照组OD450值)×100%。
1.2.2siRNA转染 siRNA由锐博生物公司(广州、中国)构建合成。取生长状态良好的MHCC-97H和Hep3B细胞接种于6孔板中,细胞融合度达70%时,按照说明书采用转染试剂盒将干扰序列(si-CAV1)及干扰对照序列(si-NC)转染MHCC-97H和Hep3B细胞,12 h后更换培养基,48 h后收集细胞用于进一步的实验。
1.2.3qPCR 采用TRIzol试剂提取细胞总RNA,以cDNA逆转录试剂盒进行逆转录,以 SYBR®Premix Ex TaqTM进行荧光定量PCR分析。每组设置5个复孔,反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,扩增40个循环。数据采用Bio-Rad CFX Manager 软件进行处理。结果取平均值进行计算,管家基因GAPDH作为内参,采用2-ΔΔCt计算目的基因mRNA的相对表达量。引物序列:CAV1 正向引物为5′-GCGACCCTAAACACCTCAAC-3′,反向引物为5′-ATGCCGTCAAAACTGTGTGTC-3′。
1.2.4蛋白质免疫印迹 采用RIPA裂解液提取细胞中的总蛋白,行10% SDS-PAGE 凝胶电泳分离蛋白,300 mA湿转120 min将目的蛋白转移至PVDF膜上,封闭液室温封闭2 h后分别将目的条带放入对应的一抗溶液中4 ℃孵育过夜;次日洗涤条带后放入羊抗鼠(1∶2 000)或羊抗兔(1∶2 000)二抗中,室温孵育1 h。采用ECL法对条带进行显影,以β-actin作为内参比较目的蛋白CAV1表达。
1.2.5划痕实验 细胞计数按5×105(个/孔)均匀的接种于6孔板内,细胞融合度达到90 %时,用已消毒的直尺置于孔径上,固定直尺两端勿挪动,用200 μL枪头沿着直尺划垂直线,用PBS清洗2遍后加入2 mL无血清DMEM培养基,立即于倒置显微镜下观察并拍照,待培养48 h后再观察拍照。
1.2.6Transwell细胞迁移及侵袭实验 细胞消化、无血清培养基重悬计数,按2×104(个/孔)接种于未包被或基质胶包被的Transwell细胞培养小室内,补充无血清培养基至总体积200 μL。下室加入700 μL含10%胎牛血清的DMEM培养基。常规培养24 h后取出小室,用棉签去除滤膜内侧的细胞,加入4%多聚甲醛固定30 min,1%结晶紫染色30 min,清洗掉多余的结晶紫染料后烘干,显微镜下观察并拍照。
1.2.7免疫共沉淀 细胞中加入500 μL NP40裂解液(蛋白酶抑制剂10 μL、磷酸酶抑制剂10 μL及PMSF 5 μL)提取总蛋白,加入20 μL Protein A+G Agarose beads于4 ℃摇床孵育2 h,对蛋白提取物进行预纯化。将纯化后的提取物分为3份,分别加入纯化IgG(IgG组)、CAV1抗体(IP组)、留50 μL不加任何抗体作为对照组(Input组),于4 ℃摇床孵育过夜。IgG组及CAV1组孵育后的提取物中各加入40 μL Protein A+G Agarose beads,收集沉淀加入蛋白上样缓冲液100 ℃变性5 min,采用SDS-PAGE蛋白凝胶电泳进行检测分析。
1.3 统计学方法
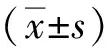
2 结果
2.1 肝癌细胞系中CAV1的表达
CAV1 mRNA及蛋白的表达在HepG2、HCC-9810、MHCC-97H、Hep3B等肝癌细胞系中较人正常肝细胞LO2中的表达量高(P<0.05),并且在MHCC-97H和Hep3B细胞中的表达最明显。见图1。故选取MHCC-97H及Hep3B细胞进行后续缺氧模型的构建。

注:与LO2比较,(1)P<0.01,(2)P<0.001。
2.2 缺氧对肝癌细胞中CAV1表达的影响
以0、50、100、150、200、250 μmol/L CoCl2诱导MHCC-97H及Hep3B细胞缺氧24 h,CCK-8实验结果显示,0~100 μmol/L CoCl2时,肝癌细胞的生长无明显影响;当浓度高于150 μmol/L后,MHCC-97H及Hep3B 细胞的存活率均有不同程度的下降。选取100 μmol/L CoCl2分别处理细胞0、12、24、48、72 h,结果显示,24 h时,细胞的增殖活性最大(P<0.05,见图2),故以100 μmol/L CoCl2作用24 h作为细胞缺氧模型的最佳浓度和时间,与对照组相比(0 h),缺氧环境明显促进了CAV1蛋白表达。见图3。
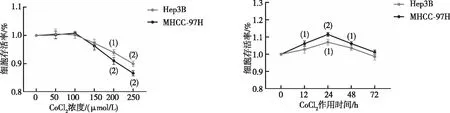
注:与0 μmol/L或0 h比较,(1)P<0.05,(2)P<0.01。
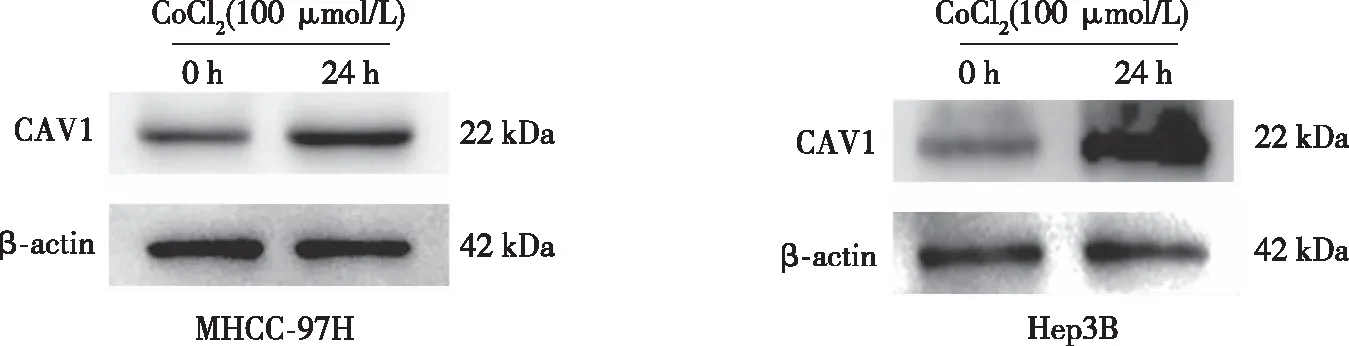
图3 缺氧对肝癌细胞中CAV1表达的影响
2.3 缺氧对肝癌细胞迁移、侵袭能力的影响
划痕实验结果示,与对照组比较(0 h),MHCC-97H及Hep3B细胞在缺氧环境下细胞的相对迁移率明显增加(P<0.05)。见图4。Transwell实验结果示,与对照组相比(0 h),缺氧明显促进了细胞迁移和侵袭(P<0.05)。见图5。

注:与0 h比较,(1)P<0.01。

注:与0 h比较,(1)P<0.05,(2)P<0.01。
2.4 缺氧对肝癌细胞中EMT相关指标的影响
Western blot结果显示,与对照组相比(0 h),缺氧环境下EMT相关指标Vimentin、N-cadherin蛋白明显增加,E-cadherin的表达明显降低(P<0.05)。见图6。

图6 缺氧对MHCC-97H及Hep3B细胞中EMT相关指标表达的影响
2.5 CAV1对肝癌MHCC-97H及Hep3B细胞迁移、侵袭的调控作用
采用siRNA干扰CAV1的表达后,进一步验证在缺氧环境中CAV1对肝癌细胞株MHCC-97H及Hep3B转移能力的影响。划痕实验结果示,与对照组相比(si-NC),干扰CAV1的表达后细胞的相对迁移率明显减弱,差异有统计学意义(P<0.05)。见图7。Transwell细胞迁移及侵袭实验结果示,与对照组相比(si-NC),si-CAV1组细胞的迁移及侵袭能力明显降低,差异有统计学意义(P<0.05)。见图8。

注:与si-NC相比,(1)P<0.001,(2)P<0.01。

注:与si-NC比较,(1)P<0.05,(2)P<0.01。
2.6 CAV1对肝癌细胞中EMT相关指标的影响
Western blot实验结果示,缺氧环境下与si-NC组比较,下调CAV1表达后MHCC-97H及Hep3B细胞中Vimentin、N-cadherin蛋白表达水平明显降低,E-cadherin表达明显增加(P<0.05)。见图9。

图9 下调CAV1对肝癌细胞株MHCC-97H及Hep3B中EMT相关指标的影响
2.7 CAV1可通过招募Vimentin促进肝癌的进展
免疫共沉淀实验显示(图10),在MHCC-97H及Hep3B细胞中,CAV1能与Vimentin在蛋白水平存在直接或间接结合的可能性。

图10 CAV1与EMT互作关系的验证
3 讨论
肿瘤细胞转移作为肝癌恶性表型的特征之一,提示了肝癌患者的不良预后。肿瘤细胞及其微环境的相互作用与肿瘤的侵袭、转移密切相关[16]。实体肿瘤由于生长过程中肿瘤细胞的快速增殖、局部微血管形成相对滞后,使局部肿瘤组织的血供不足导致肿瘤细胞处于相对缺血缺氧的环境[17]。研究表明,在缺氧微环境的作用下,肿瘤细胞的粘附能力降低,可主动从原发灶脱离侵入间质、血管或淋巴系统,然后定植在远处组织中形成转移灶[18]。而该过程受多种调控因子、基因和信号通路的调控,具体机制还有待进一步研究。在肺癌、结直肠癌及胃癌等多种实体瘤中,研究发现CAV1能促进肿瘤侵袭性、药物耐受性、抗凋亡等特性[19]。本研究结果提示CAV1在肝癌中发挥促进细胞迁移及侵袭的作用。首先,qPCR及Western blot结果显示CAV1在多株人肝癌细胞系中高表达,提示其一定程度上发挥着促癌作用。缺氧微环境已被证明可以选择侵袭性较强的癌细胞在缺氧条件下适应和生存。因此,了解与肝癌细胞侵袭性相关的缺氧基因是非常重要的。通过构建细胞缺氧模型发现,在缺氧应激条件下CAV1表达进一步增强,功能上表现为促进MHCC-97H及Hep3B细胞的体外迁移和侵袭能力。通过小干扰RNA技术下调CAV1的表达后,明显抑制了缺氧环境下细胞的迁移及侵袭。上述结果表明缺氧微环境中CAV1对肝癌细胞的迁移及侵袭能力具有重要的调控作用。
近年来EMT被认为是实体肿瘤转移的初始环节,被广泛关注和研究[20]。EMT的典型特征是上皮细胞标志物下调,如E-cadherin、紧密连接蛋白-1(ZO-1),同时伴随间质标志物表达的升高,如Vimentin、N-cadherin;且有研究发现,肿瘤的缺氧微环境可诱导EMT的发生,通过改变能量代谢途径、促进血管形成、改变基因表型等方式促进肿瘤细胞适应缺氧,促进细胞发生侵袭和转移[21]。本研究首先观察到缺氧条件下肝癌细胞中E-cadherin表达减少,Vimentin和N-cadherin表达增加。进一步分析CAV1促进肝癌细胞迁移及侵袭的分子机制,研究发现干扰CAV1表达后明显抑制了Vimentin、N-cadherin的表达,而促进了E-cadherin的表达。上述结果表明,CAV1在缺氧微环境中能调控肝癌细胞的EMT过程。最重要的是,本研究通过免疫共沉淀实验发现CAV1与Vimentin在蛋白水平存在直接或间接结合的可能。
综上所述,一定程度的缺氧能够促进肝癌细胞的迁移及侵袭能力,其机制可能与CAV1的表达水平增加、激活EMT途径促进了肝癌细胞的侵袭性有关。因此,CAV1可能作为分子靶点之一在肝癌缺氧微环境调控中发挥重要作用,并为下一步探索CAV1是否可作为预后标志物在临床肿瘤诊断和治疗中发挥价值提供理论基础。

