右美托咪定对脑缺血再灌注损伤大鼠氧化应激及炎性反应的作用机制*
魏红芳,陈永学,迟晓慧,赵广平,刘盼盼
(邯郸市中心医院 麻醉科,河北 邯郸 056008)
急性缺血性脑卒中是因局部脑血流短暂或永久性中断而造成的区域神经元、内皮细胞、神经胶质细胞等坏死,患者可表现出运动、意识、语言等脑功能受损的症状[1-2]。临床对急性缺血性脑卒中患者多给予药物溶栓或血管内介入取栓治疗,但治疗后的缺血再灌注可能对患者的脑缺血区域造成二次损伤[3-4]。Notch信号通路在脊椎动物和非脊椎动物体内广泛存在,该通路在心包受体和配体相结合,被激活后,可调控细胞、组织、器官的分化和发育,对于细胞的增殖、分化、凋亡及血管新生等过程均有重要调控作用[5]。已有研究发现Notch信号通路可能介导缺血性脑损伤,通过激活Notch信号通路,可以减少神经元凋亡、促进细胞增殖,进而改善缺血性脑损伤患者的预后[6]。右美托咪定(dexmedetomidine, DEX)具有抗炎效果,能够减少炎症细胞因子表达、提高机体免疫炎症应答,进而发挥神经保护功能[7],提示如给予患者DEX治疗可能缓解患者的炎症反应、改善脑损伤。本文探讨DEX与Notch1通路对脑缺血再灌注损伤大鼠的作用及机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性SD大鼠40只,日龄为49~64 d、平均(54.12±4.96)d,体质量250~300 g、平均(280.65±16.75)g,从广东省医学实验动物中心[SCXK(沪)2021-0104]购入,动物适应性喂养7 d,给标准饲养和自由饮水,室温23 ℃。
1.1.2主要仪器与试剂 (1)主要仪器:超净工作台(中国,Airtech),超低温冰箱(美国,Thermo),细胞培养箱(上海,力申),精密电子天平(德国,Sartorius),恒温水浴箱(上海,Lichen),转膜仪(美国,BIO-RAD),倒置荧光显微镜(日本,OLYMPUS),电泳仪(美国,BIO-RAD),细胞冻存管(美国,Corning)、96孔细胞培养板(美国,Costar),高速离心机(德国,Eppendorf),脑立体定位仪(上海,欣软信息科技有限公司),脑立体微量注射泵(北京,中西华大科技有限公司),流式细胞仪(赛默飞世尔科技有限公司);(2)主要试剂:乙二胺四乙酸、异硫氰酸荧光素、磷脂结合蛋白、聚酰亚胺、四氮唑红溶液、Trizol裂解液(北京,索莱宝科技有限公司),牛血清白蛋白(杭州,弗德生物科技有限公司),兔抗鼠二抗(美国,Cell Sigllaling Tecllll0109y公司),一抗(上海,碧云天生物技术有限公司)。
1.2 研究方法
1.2.1分组及造模 (1)分组:40只模型大鼠随机均分为模型组、DEX组、γ分泌酶抑制剂DAPT组(DAPT组)及DAPT+DEX组。造模前,DAPT组大鼠腹腔注射DAPT 5 mg,其余3组注射等体积生理盐水;造模后30 min内,DEX组和DAPT+DEX组大鼠腹腔注射100 μg/kg的DEX,模型组和DAPT组注射等体积生理盐水;(2)依据Longa等[8]的线栓法制备模型:大鼠制备模型前12 h均禁食,2%戊巴比妥钠(40 mg/kg)麻醉,仰卧位固定,常规消毒,于颈正中2 cm纵行切口,暴露左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),用动脉夹夹闭CCA和ICA,在ECA上剪口,将被生理盐水浸泡过的鱼线线栓插入到ICA内、并上行约18 mm;用激光多普勒血流仪检测脑血流量迅速降低为基础值的70%,则完成大脑中动脉阻塞局灶性脑缺血模型,2 h后拔出线栓,结扎ECA,开放CCA动脉夹,再灌注22 h,完成脑缺血再灌注损伤模型制备;(3)造模成功标准为大鼠麻醉清醒后出现左侧肢体瘫痪、站立不稳、提尾侧向转圈。
1.2.2神经功能评分 造模后2 h和24 h,采用Longa神经功能评分法[9]评估各组大鼠的神经功能,0分为无神经损伤症状,1分为提尾时病灶对侧前肢无法完全伸直,2分为行走时出现向瘫痪侧转圈,3分为行走时向病灶对侧跌倒,4分为丧失意识、且无法自发行走,其中0分和4分为造模失败。
1.2.3脑梗死情况 造模后24 h,对各大鼠进行戊巴比妥钠麻醉,向断头法处死并取出脑组织,置于低温冰箱内冷冻30 min,制作脑组织切片、2%四氮唑红溶液内孵育20 min、4%多聚甲醛溶液固定24 h,使用Image J软件扫描并测量脑梗死面积,计算脑梗死体积占比。
1.2.4脑神经细胞氧化应激和炎性因子水平 取5 mg脑梗死组织,制备脑组织匀浆液,使用酶联免疫吸附法,检测脑神经细胞神经元特异性烯醇化酶(neuron-specific enolase, NSE)、丙二醛(malonic dialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)和白细胞介素-6(interleukin 6, IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor, TNF-α)水平。
1.2.5Notch通路相关蛋白Notch1、Notch2及家族多毛强化子-1基因(hairy and enhancer of split 1, Hes1)蛋白表达水平检测 采用Western blot检测,使用Trizol裂解液提取脑脑组织总蛋白,使用BCA检测总蛋白含量。离心取蛋白裂解液上清液,体积质量比1∶0.5加入5×Loading Buff,震荡混匀(10 min),置于100 ℃沸水内5 min变性,每孔加入30 μg等量蛋白样品,电泳,取出蛋白凝胶,转PVDF膜;于10%脱脂奶粉内浸泡,室温下封闭2 h,加一抗(1∶1 000)孵育,4℃下过夜,加二抗(1∶800)孵育2 h,加发光液显影,以β-actin为内参,使用Image J软件分析各蛋白条带灰度值,计算相关蛋白的相对表达水平。
1.3 统计学分析
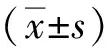
2 结果
2.1 神经功能评分
结果显示,与DAPT+DEX组相比,DAPT组、模型组、DEX组大鼠造模后2 h和24 h的神经功能评分升高,且DAPT组>模型组>DEX组,差异有统计学意义(P<0.05)。见表1。

表1 各组大鼠造模后2 h和24 h的神经功能评分比较
2.2 造模后24 h脑梗死情况
结果显示,造模后24 h时,DAPT组、模型组、DEX组大鼠梗死灶体积、梗死灶与全脑体积比,都高于DAPT+DEX组,且DAPT组高于模型组,模型组高于DEX组,差异有统计学意义(P<0.05);但全脑总体积比较,差异无统计学意义(P>0.05)。见表2。
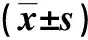
表2 各组大鼠造模后24 h时的脑梗死情况
2.3 造模后24 h的脑神经细胞氧化应激水平
结果显示,造模后24 h时,DAPT组、模型组、DEX组大鼠的脑神经细胞NSE、MDA水平均较DAPT+DEX组升高,且DAPT组>模型组>DEX组;DAPT组、模型组、DEX组的脑神经细胞SOD水平均较DAPT+DEX组降低,且DAPT组<模型组 表3 各组大鼠造模后24 h的脑神经细胞氧化应激水平比较 结果显示,造模后24 h时,DAPT组、模型组、DEX组大鼠的脑神经细胞IL-6、IL-1β、TNF-α水平均较DAPT+DEX组升高,且DAPT组>模型组>DEX组,差异有统计学意义(P<0.05)。见表4。 表4 各组大鼠造模后24 h的脑神经细胞炎性因子水平 与DAPT+DEX组相比,DAPT组、模型组大鼠造模后24 h的脑组织细胞Notch1、Notch2、Hes1水平均降低,且DAPT组低于模型组,DEX组大鼠造模后24 h的脑组织细胞Notch1、Notch2、Hes1水平均升高,差异有统计学意义(p<0.05),见表5和图1。 表5 各组大鼠造模后24 h脑组织细胞Notch通路相关蛋白表达 图1 各组大鼠造模后24 h的脑组织细胞Notch通路相关蛋白表达(Western blot) 大脑作为人体最重要的生命器官之一,其具有高耗氧、高灌注、高能量储备、高代谢等特点,但是其对于缺血缺氧的耐受能力较差[10]。临床中虽然可以给予缺血性脑卒中患者早期溶栓治疗促进血液再通,但是治疗后血液再灌注可导致机体产生大量氧自由基,损伤脑神经组织,加重脑组织损伤,随病情进展还会导致患者出现肢体功能障碍和认知功能障碍,对患者的家庭和社会均有重要影响[11-12]。因此给予脑缺血再灌注损伤患者适当的药物治疗对于改善患者预后有重要意义,结合既往有学者指出麻醉药物具有一定的神经保护效果[13],本文选取临床中广泛应用的DEX作为研究对象,建立脑缺血再灌注损伤大鼠模型,分析了DEX通过调控Notch1通路对脑缺血再灌注损伤大鼠的作用机制,以期能为今后临床治疗提供指导。 Notch信号通路主要在哺乳动物大脑皮层和海马神经元内表达,正常状态下,大脑发育时机体的Notch信号通路状态对神经细胞的命运有重要影响,其能够对神经干细胞的增殖、分化和凋亡过程进行调节[14-15]。既往Stump等[16]指出,激活Notch信号通路能够促进神经干细胞增殖,促进缺血后神经功能缺损恢复。Zhao等[17]发现,使用电针刺激Notch信号通路活化,可防治脑缺血所致神经功能缺损。但脑组织内Notch信号通路的变化所产生的效应在临床中尚存争议,有学者认为通过阻断Notch信号通路后机体可通过其他途径改善脑缺血状态,而多数学者则认为活化Notch信号通路则能够减少神经元凋亡,保护脑缺血大鼠的脑功能,同时可促进海马新生神经元整合[18-19],因此本文对其展开探究。 本文研究结果显示,与DAPT+DEX组相比,DAPT组、模型组、DEX组大鼠造模后2 h和24 h的神经功能评分均升高,DAPT组、模型组、DEX组大鼠造模后24 h的梗死灶体积、梗死灶与全脑体积比、脑神经细胞NSE、MDA、IL-6、IL-1β、TNF-α水平均升高,且DAPT组高于模型组、DEX组,模型组高于DEX组;DAPT组、模型组、DEX组大鼠造模后24 h的脑神经细胞SOD水平、脑组织细胞OD值均降低,且DAPT组低于模型组、DEX组,模型组低于DEX组。其中MDA为氧自由基和生物不饱和脂肪酸过氧化反应所产生的代谢产物,其是毒性最大的脂质过氧化总产物,因此其水平高低能够反映出脑梗死病灶情况[20]。SOD为人体内重要的氧化镁和自由基清洁剂,其能够将体内过量氧自由基有效清除,发挥器官保护效果[21]。NSE水平高低与继发性脑损伤存在相关性,因此神经元坏死或损伤可能造成NSE水平升高[22]。提示本研究中给予脑缺血再灌注损伤模型大鼠DEX而调控了多炎性反应,进而保护了海马神经元,促进脑组织内γ-氨基丁酸含量升高,促进了脑细胞增殖,发挥了脑神经保护效果。同时Notch受体作为跨膜蛋白,激活后可促进细胞内片段NICD,其与细胞核内DNA相结合而形成复合物,进而促进Hes1表达,Hes1作为螺旋-环-螺旋转录因子家族中的负调控因子,能够维持神经元细胞增殖[23-24]。本文结果显示,与DAPT+DEX组相比,DAPT组、模型组大鼠造模后24 h的脑组织细胞Notch1、Notch2、Hes1水平均降低,且DAPT组高于模型组,DEX组大鼠造模后24 h的脑组织细胞Notch1、Notch2、Hes1水平均升高。肢体远端缺血预处理(remote ischemic preconditioning, RIPC)介导的神经保护作用与其预先激活缺血脑区神经元细胞的Notch1信号相关,DAPT可阻断RIPC激活的Notch1信号和下游保护基因的上调,进而逆转RIPC的神经保护效应,而Notch1通路的激活在RIPC介导的抗MCAO/R损伤的神经保护作用中有重要意义,因此上述结果提示DEX可能通过上调Notch信号通路而发挥脑保护效果[25-27]。 综上所述,DEX可通过上调Notch1通路而影响缺血再灌注损伤大鼠的氧化应激反应和炎性反应,提高细胞活力,缩小梗死灶体积,改善脑神经功能,具有一定的脑神经保护功能。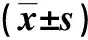
2.4 造模后24 h的脑神经细胞炎性因子水平
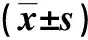
2.5 造模后24 h的脑组织细胞Notch通路相关蛋白表达水平
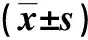

3 讨论

