抑制AngⅡ受体对糖尿病肾病的作用及JAK2/STAT3/SOCS1通路的影响
陆萍,蔡珣,石向丽, 冉江华,李爱红
(南通大学附属如皋医院 血液科, 江苏 南通 226500)
糖尿病肾病(diabetic nephropathy,DN)是长期高血糖导致肾损害的结果,是糖尿病微血管并发症之一,又称为糖尿病性肾小球硬化症,是以进行性蛋白尿、高血压和进展性肾衰竭为特征的一组临床综合征[1-2]。虽有研究表明,随着糖尿病健康管理的加强,与糖尿病相关的心血管疾病的发病率逐渐降低,但这些对终末期肾病发生率的影响较小[3]。目前临床上治疗DN常采用血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)受体拮抗药物[4-5],其中血管紧张素Ⅱ1型受体(AT1R)是目前研究最透彻的受体[6]。研究发现,AT1R拮抗剂联合中药免疫抑制剂对早中期的DN有一定的临床疗效[7],但关于单独使用AT1R拮抗剂对DN的作用机制报道较少。Janus激酶/信号转导和转录活化因子(jauns kinase/signal transducer and activator of transcription,JAK/STAT)信号通路参与多种慢性炎症性疾病的发生发展[8]。研究发现,细胞因子信号抑制因子(suppressor of cytokine cignaling,SOCS)是JAK/STAT信号通路中重要的负性调控蛋白之一[9],可介导多种疾病的发生发展。有文献显示,SOCS1能通过抑制JAK2的活性诱导STAT3发生磷酸化,进而发挥生物学作用[10]。本研究通过用血管紧张素Ⅱ1型受体拮抗剂干预糖尿病肾病大鼠,观察其通过调控JAK2/STAT3/SOCS1信号通路对DN大鼠的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性SD大鼠均从青岛市实验动物和动物实验中心购买,共计35只,动物许可证号SCXK(鲁)2016-0002。大鼠均为SPF级,体质量200~220 g,所有大鼠饲养在统一的动物房内,保持室内温度20~25 ℃,光照12 h循环1次,大鼠自由饮食饮水。
1.1.2试剂和仪器 缬沙坦(南京长澳制药有限公司,批号180925),小鼠抗JAK2单克隆抗体、兔抗p-JAK2多克隆抗体(美国Millipore公司),STAT3抗体、p-STAT3抗体(上海博湖生物科技有限公司),兔抗SOCS1多克隆抗体(美国Immunoway公司),DAB显色试剂盒(武汉博尔夫生物科技有限公司),NAW1-XTY5血糖测定仪[博邦方舟医疗科技(北京)有限公司]。
1.2 研究方法
1.2.1动物分组和DN模型制备 将35只实验大鼠随机分为3组,即NC组(健康大鼠不做任何干预,正常饲养)10只,DN组(糖尿病肾病大鼠模型组)和ARB组(DN组基础上灌胃缬沙坦干预治疗)共25只。将DN组和ARB组大鼠制备DN模型,大鼠均用高脂高糖饲料喂养4周后,大鼠腹腔注射链脲佐菌素(STZ)用0.1 mol/L柠檬酸钠缓冲液pH4.4配制(剂量为30 mg/kg);4周后,连续3次测定大鼠随机血糖值,结果>16.7 mmol/L且24 h蛋白尿≥30 mg/L即为造模成功;造模后有5只大鼠造模失败剔除,剩余20只大鼠每组10只。造模成功后,NC组和DN组大鼠均灌胃等体积的生理盐水,ARB组大鼠灌胃40 mg/kg·d缬沙坦干预,各组大鼠均连续干预8周。
1.2.2生化指标检测 灌胃第8周末收集各组大鼠尾尖血,置于离心机离心10 min(3 000 r/min),收集上层血清,血糖测定仪测定各组大鼠空腹血糖(first fasting blood glucose,FBG),测定血清中三酰甘油(triglyceride,TG)、血肌酐(Serum creatinine,Scr),血尿素氮(blood urea nitrogen,BUN)水平;同时分别用代谢笼收集大鼠24 h尿液,测定大鼠24 h尿蛋白总量(24-hour urine total protein quantity,24 hUTP)和尿微量白蛋白(Urine micro albumin,UmALB,全自动生化分析仪)。
1.2.3肾组织形态学观察 取血尿后标本后,处死各组大鼠并取出肾皮质,置于甲醛溶液中固定、脱水、石蜡包埋组织,将组织切成4 μm 薄片HE染色,显微镜下观察组织学变化。
1.2.4蛋白质印迹检测肾皮质组织匀浆 中JAK2、p-JAK2、STAT3、p-STAT3、SOCS1蛋白表达 取出肾皮质组织,冰上裂解并研磨组织呈组织匀浆,用BCA法测定总蛋白浓度。电泳蛋白样品,后转移至PVDF膜转上,用5%的脱脂奶粉封闭2 h,用PBS稀释后添加一抗JAK2(1∶1 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶1 000)、SOCS1(1∶1 000)、GAPDH(1∶500)抗体,4 ℃环境孵育过夜,TBST缓冲液洗膜,20 min/次,共3次;加入PBS稀释辣根过氧化物酶标记的二抗IgG(1∶5 000)室温孵育1.5 h。洗膜样品后用显微镜观察蛋白条带灰度值。
1.3 统计学方法
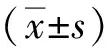
2 结果
2.1 FBG、TG水平
与NC组比较,DN组大鼠血清FBG和TG水平显著升高,差异有统计学意义(P<0.05);与DN组比较,ARB组大鼠FBG和TG水平显著降低,差异有统计学意义(P<0.05)。见图1。
注:A为大鼠FBG水平,B为大鼠TG水平;(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05。
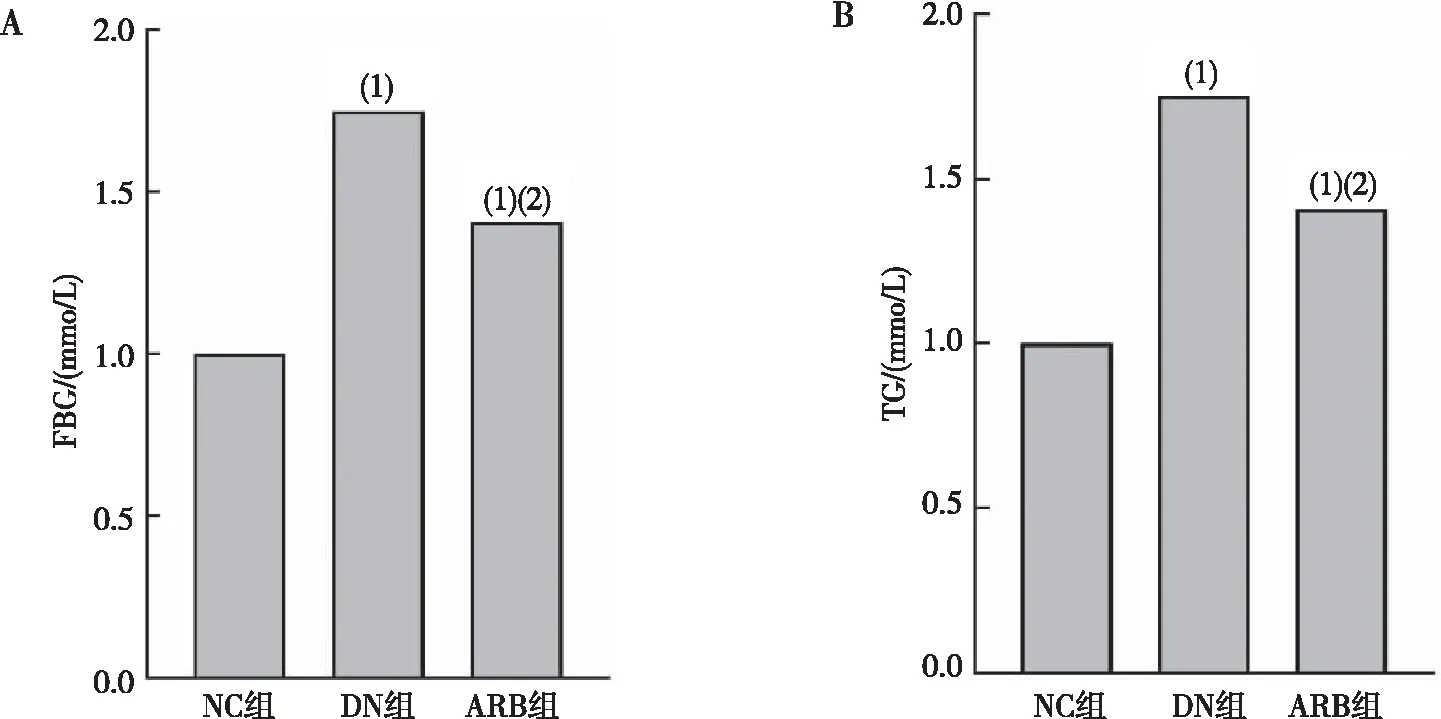
2.2 Scr、BUN水平
与NC组比较,DN组大鼠血清中Scr、BUN水平均显著增加,差异有统计学意义(P<0.05);与DN组比较,ARB组大鼠血清中Scr、BUN水平均显著降低,差异有统计学意义(P<0.05)。见图2。
注:A为大鼠Scr水平,B为大鼠BUN水平;(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05。
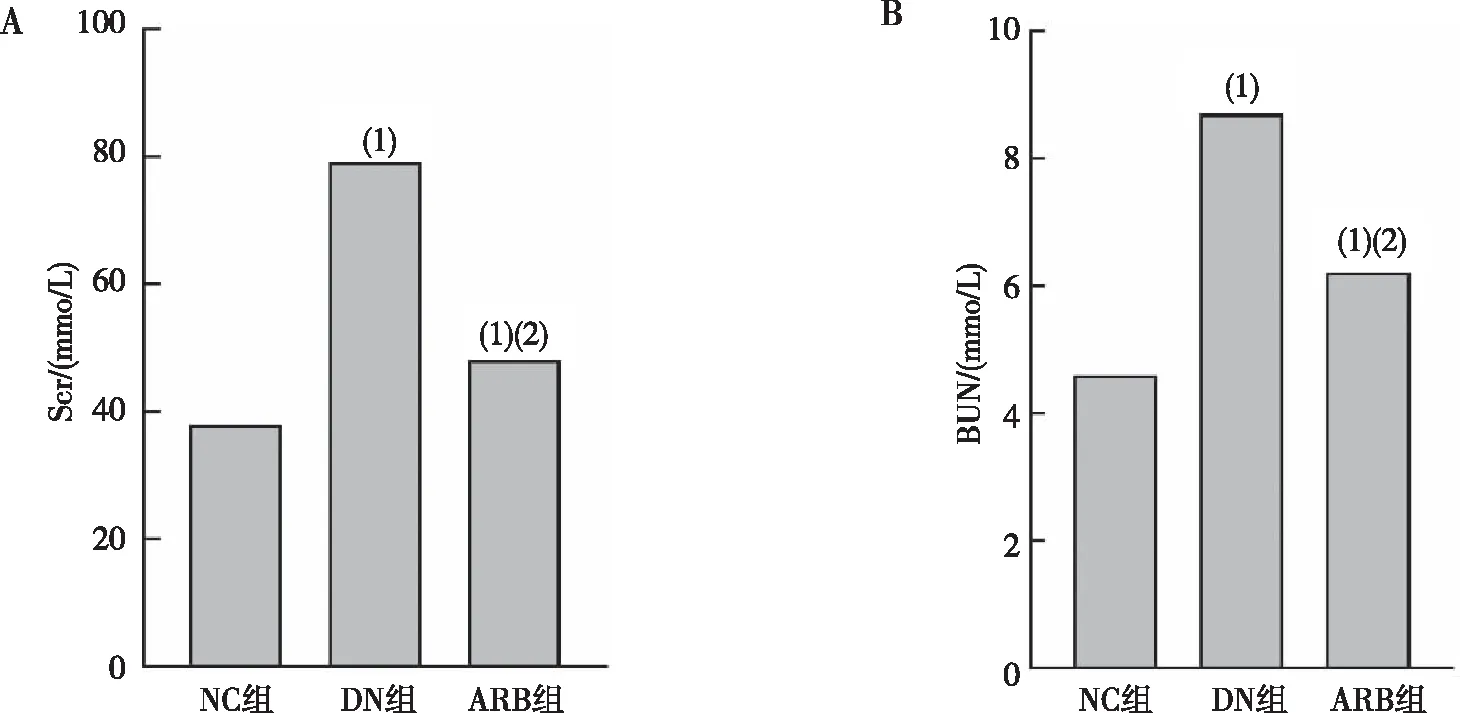
2.3 UmALB、UTP水平
与NC组比较,DN组大鼠血清中UmALB、UTP水平显著增加,差异有统计学意义(P<0.05);与DN组比较,ARB组大鼠血清中UmALB、UTP水平显著降低,差异有统计学意义(P<0.05)。见图3。
注:A为大鼠UmALB水平,B为大鼠UTP水平;(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05。
2.4 肾皮质组织学观察
与NC组比较,DN组大鼠肾小球体积增加,系膜细胞数量变多,肾小球上皮细胞形成大量空泡;与DN组比较,ARB组大鼠肾小球形态区域正常,基底膜轻微增生,肾小管排列区域整齐,病变程度模型减轻。见图3。
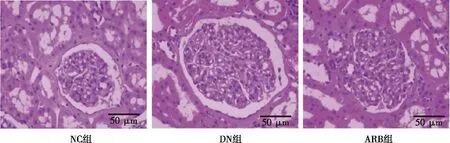
图4 各组大鼠肾皮质组织学特点(HE,×200)
2.5 肾皮质组织匀浆中JAK2、p-JAK2、STAT3、p-STAT3、SOCS1蛋白表达
与NC组比较,DN组大鼠肾皮质组织中p-JAK2/JAK2比值和p-STAT3/STAT3比值明显升高,SOCS1蛋白表达显著增加,差异有统计学意义(P<0.05);与DN组比较,ARB组大鼠肾皮质组织中p-JAK2/JAK2比值和p-STAT3/STAT3比值显著降低,SOCS1蛋白表达显著升高,差异有统计学意义(P<0.05),说明AT1R拮抗剂可影响DN大鼠肾皮质组织中JAK2/STAT3/SOCS1蛋白表达水平。见图5。
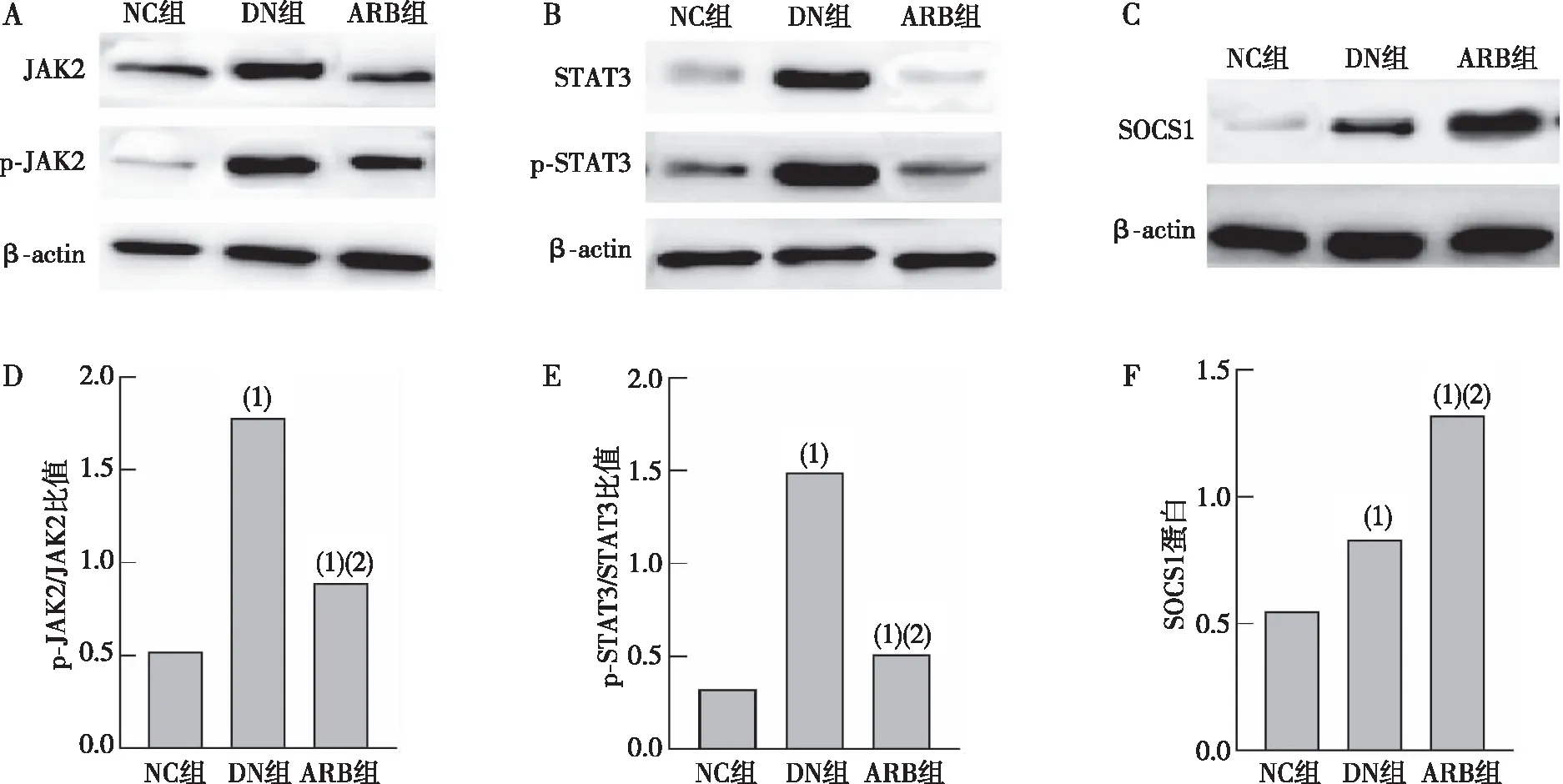
注:A为大鼠肾皮质组织中p-JAK2、JAK2蛋白表达,B为大鼠肾皮质组织中p-STAT3、STAT3蛋白表达,C为大鼠肾皮质组织中SOCS1蛋白表达,D为p-JAK2/JAK2,E为p-STAT3/STAT3,F为SOCS1蛋白表达;(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05。
3 讨论
DN是众多糖尿病并发症中最常见且最严重的并发症糖尿病(DM),其以血管损伤所致肾小球病变为主要病理特征[11]。有学者研究发现,控制糖尿病肾病患者血糖,改善血流动力学变化,不仅能有效延缓微量蛋白尿的发生,而且还能减少已有微量蛋白尿患者的临床蛋白尿症状[12]。研究发现,肾素血管紧张素系统(RAS)的激活可导致足细胞损伤,抑制RAS激活对足细胞损伤具有保护作用[13],进而能有效延缓DN的进展。AngⅡ作为肾素血管紧张素系统的主要效应因子,其在机体血容量、血流动力学及内环境稳态的调节中发挥主导作用,目前已有研究发现,AngⅡ水平在肾内局部升高,其与高血压、糖尿病时肾脏病变的发生发展密切相关[14]。因此本研究采用AngⅡ拮抗剂干预DN模型大鼠,观察其对大鼠的作用机制及相关信号通路的影响。
高糖可通过诱导大鼠肾病病变而降低肾小球的滤过功能,抑制肾功能指标Scr、BUN等的吸收。糖尿病肾病发生过程中伴随着异常的脂质代谢,有学者通过对DN大鼠研究发现,肾小管中有大量的脂质沉淀,通过下调脂质生成基因的表达可减轻糖尿病肾病大鼠的肾损伤[15]。本研究结果显示,DN组大鼠FPG、TG、Scr、BUN、UmALB、UTP水平升高,提示DN模型制备成功。通过给予大鼠AngⅡ拮抗剂发现,AngⅡ拮抗剂对糖尿病肾病大鼠肾组织损伤有一定修复作用。研究发现,AngⅡ能有效的改善肾小球滤过膜通透性,且AngⅡ能和结合其受体,通过减少滤过膜负电荷起到减弱电荷的屏障作用,进而改变肾小球滤过膜的通透性[16]。
JAKs是STATs信号转导通路上游激酶,其可激活JAKs表达,通过诱导STATs磷酸化而形成STATs二聚体,进而调控核内的基因表达。当JAK/STAT途径被过度激活时,靶细胞的生物学功能会因异常活跃而损伤机体,因此通过抑制JAK/STAT途径的过度激活对维持机体的稳定性有重要作用。SOCS家族是目前研究最多的负性调节因子之一,通过负反馈调节JAK/STAT途径而减轻机体产生过度的免疫反应,一定程度阻止了疾病的进展,同时对组织损伤有一定改善作用。SOCS1能通过其特异性酶活性抑制区域与JAK2相应催化部位结合,从而抑制信号传导,目前SOSl对JAK2/STAT3信号通路的负调控作用已被证实。研究发现,SOCS1能抑制JAK2诱导的STAT3磷酸化,进而发挥生物学作用[17]。本研究结果显示,AngⅡ受体拮抗剂可抑制DN大鼠肾皮质组织中JAK2/STAT3信号通路,提高SOCS1蛋白表达水平,对肾组织具有保护作用。有研究证实,SOCSl可通过负向调节JAK2/STAT3通路抑制STAT3磷酸化的生成,机体中的SOCS1含量随着疾病的加重而增加,进而一定程度减轻炎症损伤[18]。目前,尚无相关文献证实AngⅡ受体拮抗剂可调控JAK2/STAT3/SOCS1信号通路,因此,后续本研究将完善实验内容,通过更多的实验方案证实AngⅡ与JAK2/STAT3/SOCS1表达的相关性。
综上所述,AngⅡ受体拮抗剂能减轻糖尿病肾病大鼠肾损伤,影响JAK2/STAT3/SOCS1蛋白的表达水平,对肾组织有保护作用,为临床治疗糖尿病肾病提供实验依据。

