高分辨MRI在脑梗死患者颅内责任血管管壁特征评估中的应用价值观察
张敏 许丹 曲其志 肖太星
聊城市第三人民医院CT磁共振室,聊城 252000
脑梗死具有较高的致残率、致死率,严重威胁患者的生命安全。目前临床中脑梗死诊断以数字减影血管造影(DSA)为金标准,但为有创检测,具有一定风险[1-2]。磁共振血管造影(MRA)、CT血管造影(CTA)为无创检测手段,也可显示颅内大血管近端闭塞或者狭窄,但对于远端、分支以及血管管壁特征显示有限[3]。随着医疗技术的发展,高分辨MRI(HR-MRI)技术进展迅速,在检测动脉管壁病变方面具有显著优势[4-5]。脑梗死患者机体炎症引起血管内皮通透性增加、新生毛细血管以及细胞外间质体积增加,从而促进斑块增强,因此斑块增强程度反映了炎症活动水平[6-7]。HR-MRI—颅内血管壁MRI(vessel wall MRI,VW-MRI)采用“黑血”技术,抑制血流信号使得血管内流动的血液表现为低信号,可消除血流搏动伪影,清晰显示血管管壁特征[8-9]。本研究对80例脑梗死患者的HR-MRI资料进行回顾性分析,以探究其应用效果,为临床提供参考。
对象与方法
1、研究对象
选取2020年10月至2022年2月在聊城市第三人民医院接受治疗的脑梗死患者80例,收集所有患者的临床就诊资料,进行回顾性分析。其中男67例、女13例;年龄22~75(58.4±6.00)岁;合并症:高血压者63例、糖尿病者44例、高脂血症者27例、心房颤动者5例;狭窄程度:轻度狭窄49支、中度狭窄16支、重度狭窄15支。(1)纳入标准:①患者符合脑梗死的诊断标准[10];②患者的临床就诊资料完备;③患者均存在显明显狭窄血管。(2)排除标准:①患者合并有颅内出血、延髓肿瘤;②因以往病史导致神经功能损伤者。
2、方法
采用3.0 TMR(GE)对患者进行头部扫描,采用相控阵头颅线圈,头先进。T1WI、T2WI、液体衰减反转恢复序列(FLAIR)T2WI、弥散加权成像(DWI)、三维时间飞跃法(3D-TOF)、HR-MRI扫描。T1WI扫描参数:TE=29.0 ms、TR=2 533.8 ms、矩阵512×512、层厚5 mm。FLAIR T2WI扫描 参 数:TE=98.7 ms、TR=9 000.0 ms、矩 阵512×512、层厚5 mm。DWI参数设置:TE=79.5 ms、TR=4 880.0 ms、矩阵256×256、层厚5 mm。3D-TOF MRA扫描参数:TE=3.4 ms、TR=25.0 ms、矩 阵512×512、层 厚1.4 mm,VR重 建。CUBE-T1WI参数设置:TE=16.1 ms、TR=560.0 ms、矩阵512×512、层厚0.8 mm。双回波反转恢复T1WI,采用“黑血”2D FSE序列,TE=50.0 ms、TR=1 200.0 ms、TI=3 000.0 ms,回波链22,4次信号平均、宽带=14.71 Hz。HR-MRI扫描分为FRFSE T2WI序列、冠状位CUBET1WI两部分。FRFSE-T2WI检查参照MRA图像,定位血管长轴垂直面,参数TE=49.9 ms、TR=3 194.0 ms、矩阵512×512、层厚2.0 mm,FOV=13 mm。
图像分析:在科室中选择2名高年资(主任医师医生职称)影像科诊断医师,独立阅片。MRA、HR-MRI图像分析脑卒中患者颅内责任血管、管壁斑块特征。(1)责任血管:根据狭窄的管腔进行确定,头颅MRA显示动脉管腔狭窄、DWI显示相应供血区急性梗死,即供血范围内存在梗死灶的动脉。(2)根据患者脑卒中症状发生至MRI检查时间,将其分为早期组(间隔时间<4周)、中期组(4周≤间隔时间≤12周)、晚期组(间隔时间>12周)。(3)记录对比各组患者的斑块的增强强度。0级:增强小于同一个体种无斑块的颅内动脉壁;1级:增强强度低于垂体柄;2级:增强强度与垂体柄类似或大于垂体柄[11]。
3、统计学分析
采用SPSS 20.0软件处理数据。计数资料以例(%)表示,行χ2检验,等级资料行秩和检验;符合正态分布的计量资料以(±s)表示,两组间行独立样本t检验。检验水准为α=0.05,P<0.05为差异有统计学意义
结 果
1、责任血管以及颅内硬化性斑块表现
80例脑梗死患者中,责任血管为大脑中动脉(MCA)者52例,基底动脉(BA)者28例。其中早期患者52例、中期18例、晚期10例。MCA责任血管者血管分布区出现皮层梗死灶、腔隙性梗死灶,BA责任血管者相应供血区出现桥旁脑梗死或小脑半球梗死。责任血管斑块多表现为管壁月牙形、偏心增厚,T1WI信号高低不均,T2WI信号显示均匀或混杂稍高信号,增强扫描显示偏心强化。
2、不同责任血管脑梗死患者颅内斑块分布情况
MCA狭窄患者位于背侧壁、下侧壁的斑块占比较高,BA狭窄患者的斑块则位于腹侧壁、背侧壁较多,两组患者的斑块位置差异有统计学意义(χ2=9.881,P=0.02),见表1。
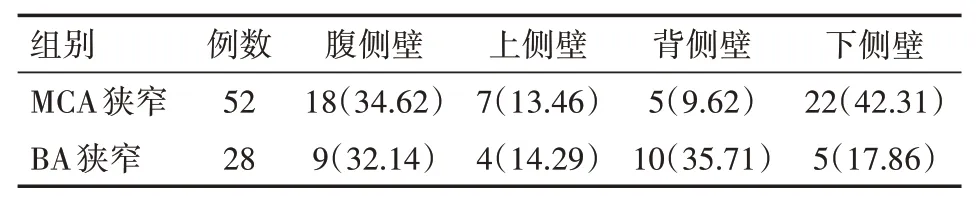
表1 不同责任血管狭窄脑梗死患者颅内斑块位置分布情况[例(%)]
3、不同时期脑梗死斑块强化特点
早期、中期、晚期患者的斑块强度逐渐降低(Z=26.510,P<0.001),见表2。

表2 不同时期脑梗死患者的斑块强化特点(例)
4、具体病例
脑梗死患者的VW-HR见图1至图6。
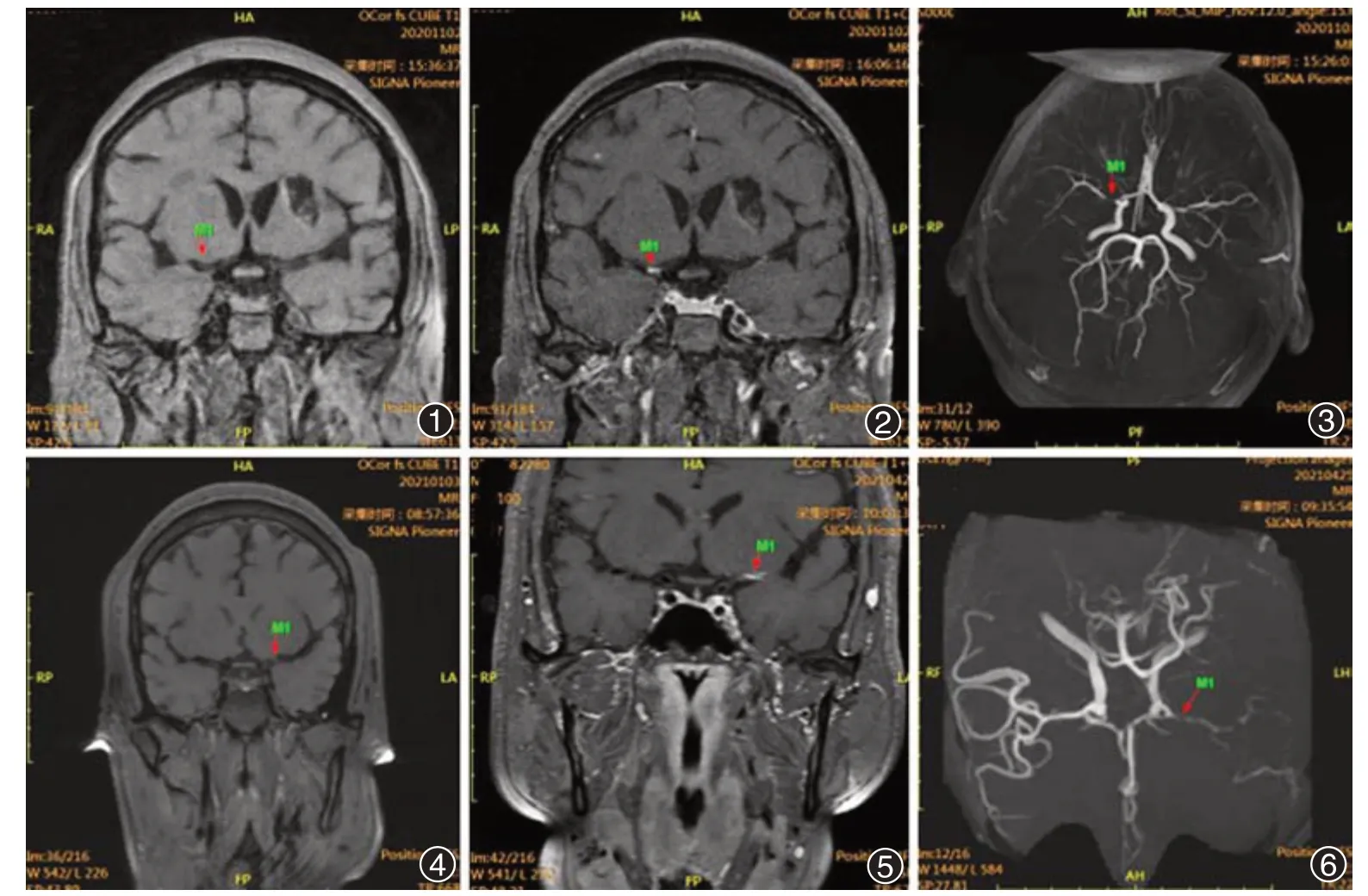
图1 VW-HR MRI血管壁成像(冠状位),右侧大脑中动脉M1段管壁偏心样增厚,管腔明显狭窄大于50%图2注入钆喷酸葡胺(Gd-DTPA)增强扫描后右侧大脑中动脉M1段血管壁偏心样强化 图3磁共振血管造影(MRA)成像,责任血管为右侧大脑中动脉:右侧大脑中动脉M1段狭窄,血流信号减弱,远端分支稀疏(M1为右侧大脑中动脉M1段,箭头指狭窄病变处) 图4 VW-HR MRI血管壁成像(冠状位),左侧大脑中动脉M1段性偏心性增厚,管腔不规则狭窄,狭窄程度70%~80% 图5注入钆喷酸葡胺(Gd-DTPA)增强扫描后:病变管壁呈线样异常强化 图6责任血管为左侧大脑中动脉:左侧大脑中动脉主干显示欠佳,远端及分支明显稀疏,血流信号减弱(M1为左侧大脑中动脉M1段,箭头指狭窄病变处)
讨 论
HR-MRI中的“黑血”效应是利用磁场、继发回波引发流动血液自旋而产生体素去相位[12-14],血管管径越小、相位分散效应越强。陈雅筝等[15]在血管壁成像特征检测的相关研究中指出,VW-MRI影像可从多方面评估血管壁成像特征。本研究对脑梗死患者的HR-MRI资料进行回顾性分析,探究HR-MRI检测对脑梗死患者颅内责任血管管壁特征评估价值。
颅内斑块阻塞穿支血管而引起脑梗死,了解斑块的位置有利于颅内介入术的进行。本研究结果显示,MCA狭窄患者斑块多分布于下壁、腹侧壁,这是因为MCA的穿支血管多发于血管上侧壁、背侧壁,而斑块多位于穿支相对处[16]。同时,BA狭窄患者的斑块多位于腹侧壁和背侧壁,应与BA的解剖结构相关。靠近穿支动脉开口位置的斑块,更容易诱发堵塞、局部分支梗死,同时栓子脱落也更易堵塞附近开口的分支血管[17-18]。这也正好解释了BA狭窄患者术后缺血事件发生率较高、多数MCA狭窄患者无显著症状的原因。王潇玉和徐成[19]的研究指出,脑梗死患者责任血管管壁特征可通过MR管壁成像显示,量化责任血管内斑块有利于临床精确评估患者病情发展状态。
脑梗死的发生多与斑块稳定性有关,而斑块强化是评估斑块稳定性的重要因素,斑块增强可以检测高风险血管壁的特征[20]。本研究结果显示,早、中、晚期患者斑块强化程度逐渐降低,显示强化时间与卒中时间呈负相关。分析原因,这可能与斑块血管管壁通透性增强、新生血管有
关[21]。细胞因子、炎症因子以及脂质经新生血管进入斑块,导致白细胞在斑块周聚集;同时斑块内的新生血管多为不成熟的血管,容易出血,斑块内的出血可促进胆固醇和磷脂的释放,扩大脂质核心,进一步促进炎症细胞的聚集,从而加重斑块易损性[22-23]。早期患者新生血管丰富,血管通透性高,斑块强化明显,随着时间的推移,炎症逐渐减弱、斑块内血管机化,最终导致强化程度降低[24]。张君和马林[25]的研究表示,HR-MRI可清晰显示颅内动脉硬化斑块强化程度,临床可用于评估脑梗死患者斑块破裂、继发性脑梗死发生风险。脑梗死可分为近端动脉粥样硬化和远端小血管玻璃样变,即穿支动脉病变和小血管病[26]。王艳等[27]关于HR-MRI检测脑梗死责任血管的相关研究中表示,HR-MRI在诊断穿支动脉的载体血管狭窄程度具有显著优势。需要注意的是,本研究因条件限制,样本量受限,同时对责任血管其他特征(纤维帽、坏死核心、斑块表面钙化情况)进行分析,研究结果存在一定的局限性。在今后的研究中,会进一步完善研究方案、增加样本量,提高结果科学性。
综上所述,HR-MRI在脑梗死患者颅内责任血管管壁特征评估中具有重要应用价值,应引起临床关注。
利益冲突所有作者均声明不存在利益冲突

