GABA Transporter-2在克罗恩病中的表达及意义的临床研究
韩微 周彩婷 马怡君 丁岩冰 廖月霞 邓彬 王磊
1扬州大学附属医院病理科,扬州 225000;2大连医科大学研究生院,大连 116044;3扬州大学附属医院消化科,扬州 225000;4扬州大学医学院,扬州 225000
克罗恩病(Crohn’s disease,CD)是一种发病原因尚未明确的慢性非特异性肠道炎症性疾病,近年来发病率逐年上升[1]。其临床常表现为腹痛、腹泻、体质量减轻,肛周脓肿和肛瘘,还可出现肠外免疫性疾病,如强直性脊柱炎和游走性关节炎等[2]。目前临床研究已证实,γ-氨基丁酸(GABA)能系统 可通过肠道微生物群-肠-脑轴(microbiota-gut-brain axis)影响宿主的免疫功能,在CD的发生发展中起重要作用[3-4]。同时最新研究提示,在GABA能系统中GABA转运蛋白(GATs)具有信号传导功能,参与免疫细胞的炎性反应,其包含GAT-1、GAT-2、GAT-3和BGT-1亚单位。GAT-2除了在肠、肝、肾等组织中被发现,也存在于多种免疫细胞中,如T淋巴细胞、树突状细胞、小胶质细胞和NK细胞[5]。已报道的相关研究表明,GAT-2在免疫性疾病多发性硬化症(MS)中异常表达,参与了促炎机制及其下游效应[6],但目前还未有GAT-2在CD中表达研究的相关报道。我们推测GAT-2可能参与了CD发生发展过程,其表达水平与疾病状态有一定关联。本文对此展开研究,以期为CD临床诊断与评估提供有效的客观指标,现将研究结果报道如下。
资料与方法
1、研究对象
选取2010年3月至2021年3月期间于扬州大学附属医院进行肠镜检查及相关实验室检查后确诊为CD的患者56例作为观察组。上述患者符合《炎症性肠病诊断与治疗的共识意见(2018年٠北京)》[7]有关CD的诊断标准,同时满足以下标准:⑴符合CD诊断标准且为初次诊断,并经病理检查证实;⑵患者年龄范围为18岁以上,不超过50岁;⑶临床资料、病理诊断资料完整。排除了以下情形者:⑴合并恶性肿瘤;⑵伴有严重心、肝、肾功能障;⑶伴有感染性疾病或其他自身免疫性疾病。选择同期行肠镜检查的健康体检者68例作为对照组。观察组中男性27例,女性29例,年龄18~47(32.30±9.40)岁,体质量指数(body mass index,BMI)(21.20±2.24)kg∕㎡。对照组中男性32例,女性36例,年龄21~48(34.76±7.70)岁,BMI(22.45±2.02)kg∕㎡。两组患者性别、年龄、BMI方面比较,差异均无统计学意义(均P>0.05)。
本研究获得扬州大学附属医院医学伦理委员会批准(2022-YKL1-20-005),所有研究对象及其亲属签署临床试验知情同意书。
2、研究方法
2.1、临床资料收集收集研究对象的年龄、性别、BMI、吸烟史、病变位置(回肠末段、结肠、回结肠)、C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、疾病行为(非穿透非狭窄、狭窄、穿透)和肛周病变等完整临床信息。
2.2、GAT-2检测收集56例CD患者和68例健康体检患者肠黏膜组织,用10%的中性甲醛(南京化学试剂股份有限公司)进行固定,经梯度浓度乙醇(国药集团化学试剂有限公司)脱水,采用组织包埋机(常州市中威电子仪器有限公司)将组织用石蜡包埋成块,再用组织切片机(赛默飞世尔(上海)仪器有限公司)将组织切成4μm厚切片,依次采用二甲苯(国药集团化学试剂有限公司)、梯度浓度乙醇进行脱蜡、EDTA抗原修复(北京索莱宝科技有限公司)及内源性过氧化物酶(北京中杉金桥生物科技有限公司)阻断,磷酸盐缓冲液(phosphate buffer solution,PBS)(北京中杉金桥生物科技有限公司)漂洗3次后加山羊血清(北京中杉金桥生物科技有限公司)进行封闭,滴加经1∶150倍稀释的鼠抗人GAT-2(艾博抗(上海)贸易有限公司)多克隆抗体,置于4℃冰箱孵育过夜,PBS漂洗3次后加入羊抗鼠免疫球蛋白(Ig)G二抗(北京中杉金桥生物科技有限公司)于25℃孵育30 min,PBS漂洗,使用DAB显色试剂盒(北京中杉金桥生物科技有限公司)显色,再用苏木素(珠海贝索生物科技有限公司)复染、梯度乙醇脱水及中性树脂(上海标本模型厂)封片,显微镜下观察GAT-2的表达情况。
2.3、CD疾病活动指数评价使用简化CD疾病活动指数(CDAI)评分标准对CD患者进行评分,根据过去1周内全身健康状况进行自我评分,包括腹痛、腹部包块、腹泻和伴随疾病等。CDAI评分≤4分为缓解期,>4分为活动期。CDAI评分4~7分为轻度活动期,>7~16分为中度活动期,>16分为重度活动期[8]。
3、结果判定标准
CRP>8 mm∕L定义为升高,ESR>21 mm∕h定义为升高;GAT-2阳性表达于细胞胞浆中,由3名经验丰富的主治病理医师根据细胞染色强度和阳性细胞所占百分比进行综合评分。判定标准如下。染色强度:0分为不着色,1分为浅黄色,2分为黄色,3分为棕黄色;阳性细胞数:0分为阳性细胞比率<5%,1分为阳性细胞比率≥5%~25%,2分为阳性细胞比率>25%~50%,3分为阳性细胞比率>50%~75%,4分为阳性细胞比率>75%。最终得分=染色强度计分×阳性细胞数计分,最终得分<4分为阴性表达,≥4分为阳性表达[9]。
4、统计学处理
采用SPSS 25.0软件进行统计分析,符合正态分布的计量资料用均数±标准差(±s)表示,采用卡方检验比较CD患者肠黏膜组织和健康体检患者肠黏膜组织GAT-2表达水平;采用卡方检验比较不同临床病理特征CD患者肠黏膜组织中GAT-2表达水平;两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;进行相关性分析。P<0.05为差异有统计学意义。
结 果
1、GAT-2在健康体检者肠镜标本与CD患者肠镜标本中的表达情况比较
68例健康体检者肠镜组织中有63例(92.65%)呈阴性表达(图1A);56例CD患者肠镜组织中有47例(83.93%)呈阳性表达(图1B和图1C),CD患者肠镜组织中GAT-2阳性表达率显著高于在健康体检者,差异有统计学意义(P<0.05)(表1)。同时观察到在健康体检者肠镜组织中,GAT-2仅少量表达于腺上皮细胞的胞浆中(图1A);在CD患者肠镜组织中,GAT-2不仅明显地表达于腺上皮细胞的胞浆中,而且较多地表达于间质炎症细胞胞浆中,胞浆呈黄色或棕黄色颗粒状(图1B和图1C)。

图1 GAT-2在68例健康体检者肠镜组织与56例克罗恩病患者肠镜组织中的表达情况。A:GAT-2在健康体检者肠组织中呈阴性表达,仅少量腺上皮细胞胞浆着色(二步法10×20);B:GAT-2在克罗恩病患者肠黏膜组织中呈阳性表达,广泛表达于腺上皮细胞与间质炎症细胞中(二步法10×20);C:GAT-2阳性表达于细胞胞浆中,可见胞浆呈黄色或棕黄色颗粒状(二步法10×40)

表1 GAT-2在克罗恩病患者和健康体检者肠镜标本表达情况比较[例(%)]
2、GAT-2表达评分与CD患者CDAI评分的相关性分析
按照CDAI评分将CD患者分为缓解期(9例)、轻度活动期(16例)、中度活动期(14例)、重度活动期(17例),各期患者GAT-2表达评分分别为(2.44±2.01)、(6.41±2.42)、(8.14±2.07)、(10.19±1.68)分,组间比较差异有统计学意义(F=28.486,P<0.05);重度活动期患者的GAT-2表达评分明显高于中度活动期患者、轻度活动期患者与缓解期患者,差异均有统计学意义(均P<0.05),GAT-2表达评分与CDAI评分间散点图提示GAT-2表达评分与CDAI评分呈正相关(r=0.756,P<0.05),随着GAT-2表达评分的增加,CD患者疾病的严重程度也随之升高(图2),两者之间数据序列符合正态分布。GAT-2表达的强度与阳性率在缓解期(图3A)、轻度活动期(图3B)、中度活动期、重度活动期(图3C)中逐渐增加。者GAT-2表达阳性率显著高于血清CRP正常、ESR正常、无肛周病变的CD患者,差异均有统计学意义(均P<0.05)。这提示血清CRP水平升高、ESR水平升高、有肛周病变可能是CD疾病进展的危险因素。见表2。
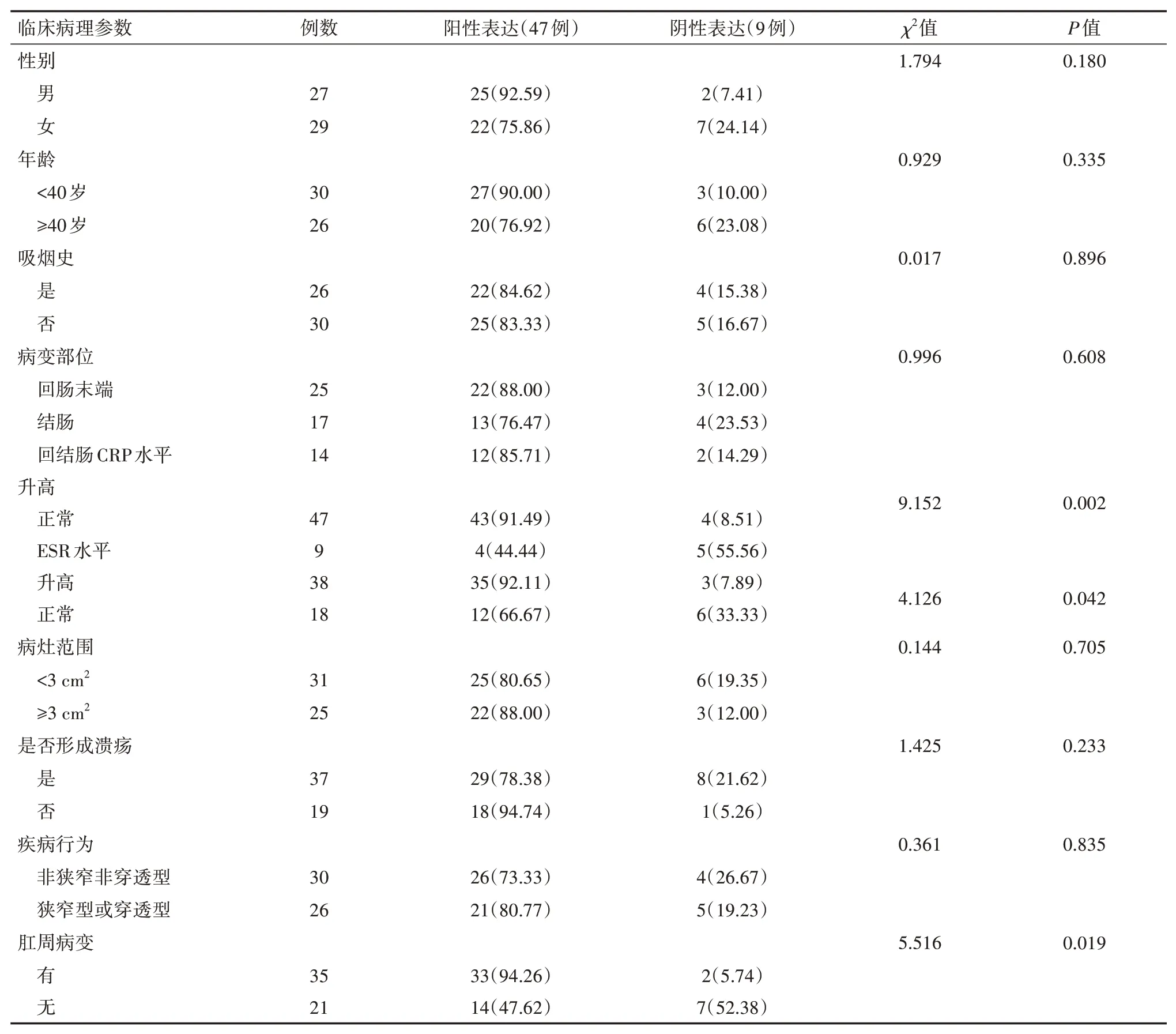
表2 GAT-2表达情况与56例CD患者临床病理特征的关系[例(%)]
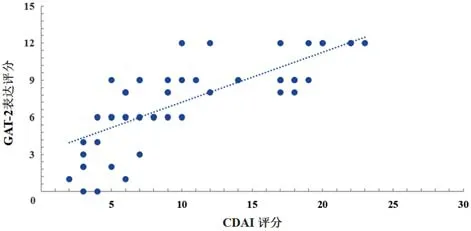
图2 56例克罗恩病患者GAT-2表达评分与CDAI评分间散点图

图3 GAT-2在56例不同临床分期克罗恩病患者中的表达(二步法10×20)。A:GAT-2在缓解期中的表达;B:GAT-2在轻度活动期中的表达;C:GAT-2在重度活动期中的表达
讨 论
3、GAT-2表达情况与CD患者临床病理特征的相关性分析
GAT-2表达情况在性别、年龄、吸烟、病变部位、病灶范围(内镜下多个溃疡面积相加之和)、病变部位是否形成溃疡、疾病行为方面比较,差异均无统计学意义(均P>0.05);而血清CRP水平升高、ESR水平升高、有肛周病变的CD患CD发病年龄有两个高峰,分别为20~40岁和60~70岁,最常见于回肠末端和邻近结肠。近年来CD发病率逐年上升,且因CD病情特点复杂多变,治疗时间长,有终身复发倾向[10]。CD早期临床表现与肠结核、急慢性肠炎、溃疡性结肠炎等症状相似,内镜检查误诊率高。诊断需结合临床表现、内镜和病理组织学进行综合分析[11]。但因CD病理组织学形态多变,且疾病各阶段表现不一,无绝对组织学诊断标准。同时由于活检部位、数量、病史缺陷等因素,导致对于CD的病理诊断具有较高主观性,不利于CD的早诊断与早治疗[12]。因此,鉴于目前CD临床病理诊断过程中出现的问题,越来越需要客观指标作为CD确诊过程中的辅助诊断方法,这也是此次临床研究的出发点。
1、GABA能系统与CD的关联
肠道和大脑之间存在的复杂的双向通信系统,最初被称为“肠-脑轴”,其与宿主心理和神经系统疾病的发生发展密切相关[13]。随着研究的进展,发现肠道微生物群在维持局部和全身稳态也起到了关键作用,它可通过“肠-脑轴”影响宿主的免疫、神经内分泌和迷走神经功能,因而将“肠-脑轴”变更为“微生物群-肠-脑轴”。最新的研究证实中枢神经的信号系统通过“肠-脑轴”可控制肠道运动、感觉、分泌和免疫功能。反过来,来自肠道的信号被传递到中枢影响宿主行为、认知和情绪调节等高级功能而导致疾病状态[14]。肠道微生物群通过多种代谢产物参与肠-脑交流,如GABA、色氨酸前体、5-羟色胺、谷氨酰胺、组胺等,构成了“微生物群-肠-脑轴”[15]。GABA是神经系统中的主要抑制性神经递质,由宿主∕微生物通过氨基酸谷氨酸的转化产生;同时肠道中的一些益生菌,如大肠杆菌属、乳酸杆菌属,在体外和体内也能够产生GABA[16]。由此可见,GABA能系统与CD的发生发展关系紧密,具有重要的生理功能。
2、GAT-2在GABA能系统中的作用
GABA能系统主要包括GABA、GABA受体、GATs和GABA转氨酶。越来越多的研究表明,神经系统控制宿主的免疫反应,免疫细胞也具有GABA能系统[17]。GATs通过介导GABA从细胞外转移到细胞内间隙终止GABA信号。GATs有4种亚单位:GAT-1(SLC6A1)、GAT-2(SLC6A13)、GAT-3(SLC6A11)和BGT-1(SLC6A12)。GAT-2是一种高选择性的Na+和Cl-离子依赖的转运蛋白,在除神经系统外的外周器官广泛表达,广泛分布于外周组织,如肠道细胞肝脏、肾脏及视网膜外周免疫细胞等。Ren等[18]研究发现GAT-2对辅助性T细胞17(Th17)的分化有调控作用,Th17细胞表现出更高的GAT-2丰度,并具有明显的细胞代谢特征。Xia等[19]研究发现:在促炎信号刺激下,巨噬细胞通过GAT-2转运GABA进入胞质内,通过LPS∕IFN-γ途径产生大量促炎细胞因子白细胞介素(IL)-1β。当肠上皮细胞(IEC)受到免疫失调、细菌感染、色氨酸缺乏等因素发生损伤,导致固有层内大量淋巴细胞、巨噬细胞增生反应,促进肿瘤坏死因子(TNF)-α、IL-1β、IL-17、IL-6等促炎性细胞因子水平增加,从而导致机体内促炎性细胞因子与抗炎性细胞因子的失衡,使得肠黏膜受到损伤而发生CD[20]。由此推测,GAT-2可能通过调节淋巴细胞、巨噬细胞等炎症细胞产生促炎因子参与CD的发生发展。
3、GAT-2在CD中的表达及意义
通过本次临床研究我们发现,GAT-2在CD患者肠镜标本中的阳性表达率显著增加(P<0.05),在健康人群中,GAT-2仅少量表达于腺上皮细胞的胞浆中;在CD患者肠镜组织中,GAT-2不仅明显表达于腺上皮细胞的胞浆中,而且较多表达于间质炎症细胞胞浆中,胞浆呈黄色或棕黄色颗粒状;不同临床分期CD患者之间,GAT-2的阳性表达率差异有统计学意义(P<0.05),GAT-2表达评分与CDAI评分呈正相关,当CD疾病严重程度增加时,GAT-2表达的强度与阳性率也随之增加;血清CRP水平升高、ESR水平升高、有肛周病变的CD患者GAT-2表达阳性率显著高于血清CRP正常、ESR正常、无肛周病变的CD患者,差异均有统计学意义(均P<0.05),提示血清CRP水平升高、ESR水平升高、有肛周病变可能是CD疾病进展的危险因素。
综上所述,GAT-2在CD患者肠镜组织中呈高表达,而在正常人群肠镜组织中呈低表达;且GAT-2表达的强度、阳性率与CD患者的炎症严重程度密切相关,炎症越重GAT-2表达强度与阳性率越高。因此,GAT-2可作为CD肠镜病理诊断的免疫抗体标志物,为临床病理确诊提供有效的客观指标,具有一定的临床意义。至于GAT-2通过何种机制参与到CD的免疫应答过程之中,则有待于接下来进一步研究探讨。
利益冲突所有作者均声明不存在利益冲突

