实验室病毒检测能力验证与粪便样本中小鼠诺如病毒的检测*
付 瑞 王莎莎 王 吉 李晓波 王淑菁 岳秉飞
(中国食品药品检定研究院 实验动物资源研究所/国家啮齿类实验动物资源库,北京 102629)
能力验证(proficiency testing)是利用实验室间比对,按照预先制定的准则来确定实验室检测能力的质量评价活动,是中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)对合格评定机构能力进行评价的主要方式之一[1]。为提高实验动物质量检测实验室的业务水平,更好的发挥检测工作在保证实验动物质量方面的作用,本实验室自2013年每年都会申请参加国际实验动物科学协会(the International Council for Laboratory Animal Science,ICLAS)建立的实验动物检测实验室能力验证计划(ICLAS-PEP),2018年申报的病毒病原检测项目包含4份小鼠病毒盲样。
在检测工作中,样品检测前处理工作严重影响检测结果。随着实验动物检测标准的更新,待检样品种类越来越多,不适当的处理会造成检测结果的假阴性。一些复杂的实验样本,如:全血、粪便等,不能按照传统的方法进行处理,因此,建立样品处理的标准操作规程对保证实验结果的一致性和可信度有着非常重要的意义。然而目前关于检测样品处理的研究较少,本研究初步探索了粪便样本中诺如病毒检测的检测前处理方法,以期获得最佳检测策略。
1 材料和方法
1.1 实验材料
4份待测病毒盲样49-1、49-4、49-8、49-9均保存在2 mL样本管中,其中49-1为0.5 mL含RNA病毒的小鼠盲肠内容物,49-4为0.5 mL含RNA病毒的小鼠粪便、49-8为含RNA病毒的小鼠小肠组织匀浆,49-9为小鼠肝匀浆。以上样品均由ICLAS提供。诺如病毒阴性的小鼠盲肠内容物由本实验室采集保存,小鼠脑脊髓炎病毒(Theiler’s mouse encephalomyelitis virus,TMEV)cDNA、出血热病毒(hemorrhagic fever virus,HV)cDNA、呼肠孤病毒Ⅲ型(reovirus type 3,Reo3)cDNA、小鼠肝炎病毒(mouse hepatitis virus,MHV)cDNA、诺如病毒(murine norovirus,MNV)培养液及cDNA由本实验室保存。PCR引物由生工生物工程(上海)股份有限公司合成,荧光定量PCR引物和探针由英潍捷基(上海)贸易有限公司合成。
1.2 实验试剂和仪器
病毒核酸DNA/RNA提取试剂盒(TaKaRa,北京六合通经贸有限公司)、病毒RNA提取试剂盒【QIAGEN,凯杰企业管理(上海)有限公司】、反转录试剂盒【Thermo,英潍捷基(上海)贸易有限公司】、探针法荧光定量PCR反应试剂盒【ABI,艾济遗传(北京)科技有限公司】、染料法荧光定量PCR试剂盒、PCR反应及电泳相关试剂(TaKaRa,北京六合通经贸有限公司)、7500Fast荧光定量PCR仪(ABI公司)。
1.3 实验方法
1.3.1病毒核酸提取及反转录:在49-4的小鼠粪便样本中加入0.5 mL无菌PBS混匀,分别吸取49-1、49-4、49-8、49-9盲样0.2 mL,并提取DNA/RNA混合物后转录cDNA备用。
1.3.2引物的合成:由于提供的3份盲样为肠道RNA病毒,故合成有可能在肠道出现的病毒,如脑脊髓炎病毒、小鼠轮状病毒(mouse rotavirus,MRV)、Reo3、LCMV、HV、MHV、MNV的检测引物,检测3份RNA病毒的盲样;49-9为小鼠肝匀浆,使用MHV以及小鼠乳酸脱氢酶增高症病毒(lactate dehydrogenase hypertrophic virus,LDV)引物进行筛查。引物序列如表1所示。其中TMEV[2]、LCMV[3]、HV[4]、MHV[5]、MNV[6-7]为文献中记录的方法,MRV、Reo3、LDV为实验室设计未发表的引物。TMEV、Reo3、MHV为探针法荧光定量PCR方法;HV为染料法荧光定量PCR方法;MNV既有荧光定量PCR方法,也有PCR方法;LCMV为巢式PCR方法;MRV、LDV为PCR方法。

表1 盲样检测使用的引物序列Table 1 Primers used in blind samples detection
1.3.3盲样核酸的病毒筛查:TMEV、Reo3、MHV荧光定量PCR检测使用的反应体系为:2×Master Mix 10 μL,10 μmol/L的上下游引物各0.5 μL,10 μmol/L的探针0.25 μL,模板2 μL,无RNA酶水3.75 μL。反应条件为:50 ℃ 孵育2 min;95 ℃ 预变性10 min,95 ℃ 15 s,60 ℃ 1 min,40 个循环,在每个循环的第二步反应收集荧光信号。
HV检测使用染料法荧光定量PCR试剂盒说明书配制反应体系,反应条件设置为95 ℃ 预变性30 s;95 ℃ 15 s,56 ℃ 15 s, 60 ℃ 30 s,40 个循环, 在每个循环的第三步反应收集荧光信号,最后进行溶解曲线分析。
MNV检测用Q-PCR方法,使用染料法荧光定量PCR试剂盒说明书配制反应体系,反应条件为:95 ℃ 预变性30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环, 在每个循环的第三步反应收集荧光信号,最后进行溶解曲线分析。
LCMV检测为巢式PCR方法,第一轮反应以引物LCMV-1638F和LCMV-1010C进行扩增,退火温度为55 ℃,第二轮反应以LCMV-1010C和LCMV-1696F为引物进行扩增,退火温度为55 ℃。MRV、LDV、MNV进行PCR方法检测时,退火温度均为55 ℃。PCR产物进行琼脂糖凝胶电泳,阳性产物由英潍捷基(上海)贸易有限公司进行测序鉴定。
使用上述方法对盲样49-1、49-4、49-8、49-9进行检测,同时每种方法设立以水为模板的阴性对照。LCMV、HV、TMEV、Reo3、MNV、MHV等检测方法使用相应的病毒核酸作为阳性对照对方法进行确认。
1.3.449-4样本的再次鉴定:将剩余的49-4盲样样本进行10倍稀释后,使用病毒RNA提取试剂盒提取RNA后反转录获得cDNA 49-4B。使用引物MNVPF和MNVPR进行PCR反应,产物进行琼脂糖凝胶电泳,阳性结果由英潍捷基(上海)贸易有限公司进行测序鉴定。
1.3.5不同试剂盒提取核酸的对比:将MNV阴性的小鼠盲肠内容物样本用无菌PBS分别进行4、8、16、32倍体积稀释后振荡混匀,将MNV病毒培养液使用无菌PBS进行10倍稀释,制备成100~10-4的病毒稀释液,将每个稀释梯度的盲肠样本和病毒稀释液进行1∶1混合后分别使用RNA/DNA提取试剂盒和病毒RNA提取试剂盒提取RNA后反转录为cDNA后-80 ℃保存备用。同时将PBS与100~10-4的病毒稀释液进行1∶1混合后作为对照样品,使用两种试剂盒提取RNA后反转录为cDNA后-80 ℃保存备用。使用MNV Q-PCR检测方法检测cDNA中MNV的核酸浓度。
1.3.6不同稀释度的盲肠内容物使用病毒核酸DNA/RNA提取试剂盒检测:将使用无菌PBS进行4倍稀释的小鼠盲肠内容物样本与100稀释的MNV病毒原液1∶1混合后,再使用PBS进行1∶4、1∶8倍比稀释分别得到A1∶16稀释样本和A1∶32稀释样本,使用RNA/DNA病毒核酸提取试剂盒提取RNA后反转录为cDNA后-80 ℃保存备用。使用MNV Q-PCR检测方法检测cDNA中MNV的核酸浓度。
2 结果
2.1 49-1的检测
使用TMEV Q-PCR方法对49-1、49-4、49-8、49-9样本进行检测时,检测出49-1有S型扩增曲线,49-4、49-8、49-9无扩增曲线(图1),CT值为18.23,故盲样49-1为TMEV阳性样本。

注:1:49-1;2:49-4;3:49-8;4:49-9;5:阴性对照;6:阳性对照Note:1:49-1;2:49-4;3:49-8;4:49-9;5:Negative control;6:Positive control图1 TMEV检测结果Fig.1 Detection result of TMEV
2.2 49-8的检测
使用MRV PCR方法检测49-4、49-8、49-9时,49-8呈现397 bp的特异性条带(图2)。将PCR产物进行测序后在NCBI上比对,与发现于美国的MRV ETD株的同源性为99%,故49-8为MRV阳性样本。
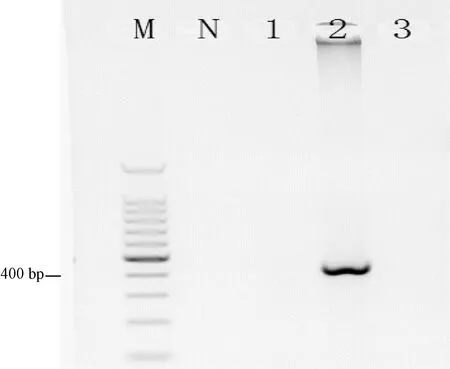
注:M:100 bp DNA Ladder;1:49-4;2:49-8;3:49-9;N:阴性对照Note:M:100 bp DNA Ladder;1:49-4;2:49-8;3:49-9;N:Negative control图2 MRV检测结果Fig.2 Detection result of MRV
2.3 49-9的检测
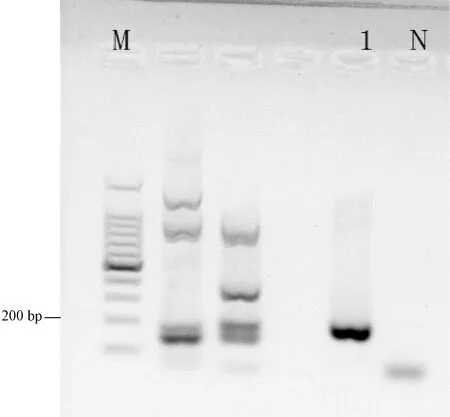
使用MHV、LDV检测方法检测49-9,LDV PCR产物呈现出223 bp的特异性条带(图3)。将PCR产物进行测序后在NCBI上比对,与LDVORF1a基因的同源性为96%,故49-8为LDV阳性样本。
注:M:100 bp DNA Ladder;1:49-9;N:阴性对照Note:M:100 bp DNA Ladder;1:49-9;N:Negative control图3 LDV检测结果Fig.3 Detection result of LDV
2.4 49-4的检测
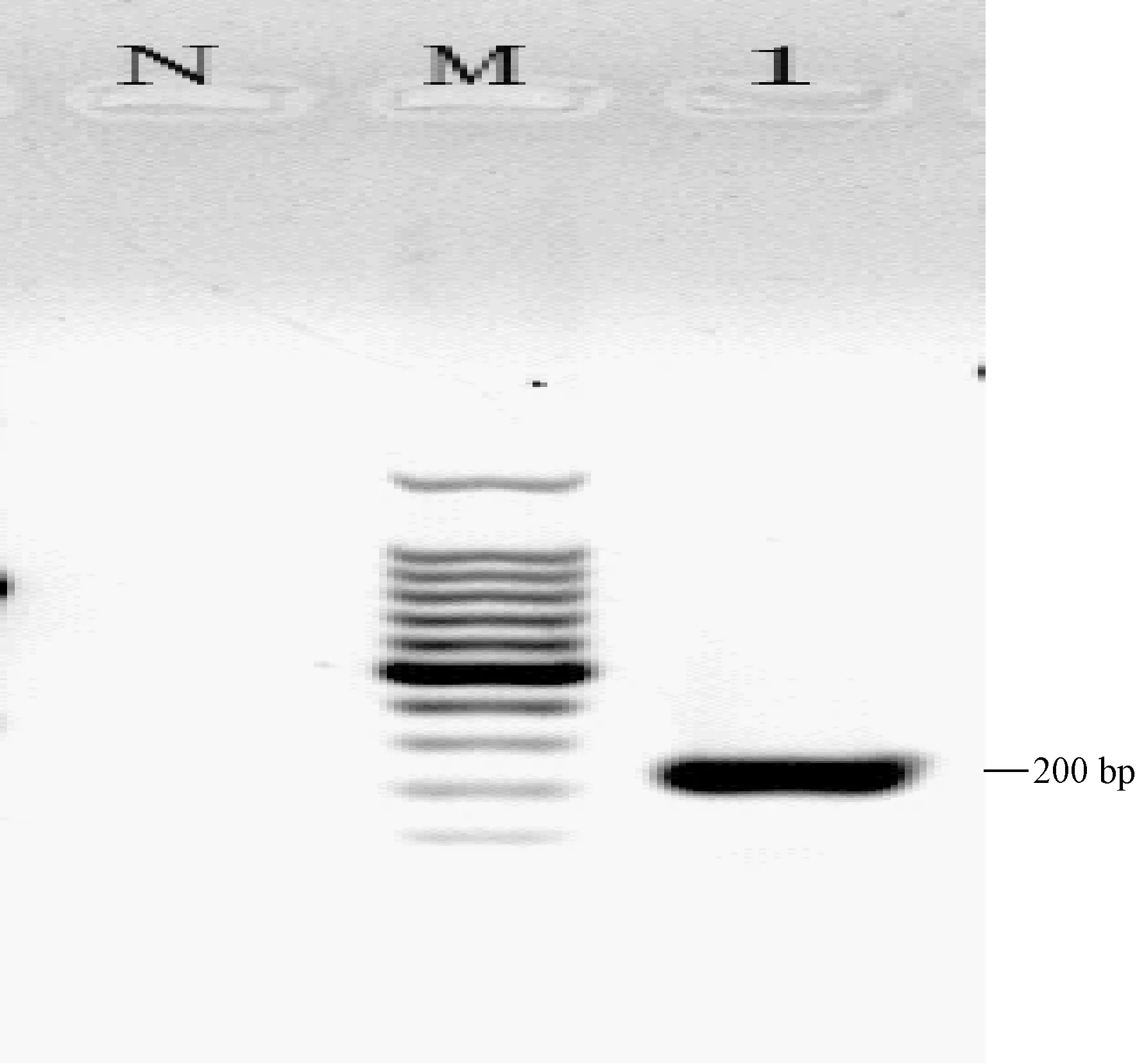
使用TMEV、Reo3、HV、MNV、MHV、LCMV等方法检测49-4,均未出现阳性扩增曲线,使用MNV PCR方法检测49-4,PCR产物出现较多非特异性扩增条带,阳性条带不明显。使用MNV PCR方法检测1.3.4中得到的49-4B,PCR产物出现特异187 bp的特异性条带(图4),PCR产物测序后与美国的MNV GV株的同源性为98.62%,故49-4为MNV阳性样本。
M:100 bp DNA Ladder;1:49-4B;N:阴性对照M:100 bp DNA Ladder;1:49-4B;N:Negative control图4 MNV检测49-4B结果Fig.4 Detection result of MNV for sample 49-4B
2.5 不同试剂盒提取核酸的检测结果
将10倍梯度稀释的病毒培养液和倍比稀释的小鼠盲肠样本1∶1混合后,分别使用两种试剂盒RNA提取后进行MNV Q-PCR检测,检测结果如图5、6所示。比较发现病毒DNA/RNA提取试剂盒提取粪便样本中的MNV RNA时,对后续的Q-PCR检测结果影响较大。

注:横坐标为混合的污染样本中病毒的稀释倍数,纵坐标为荧光定量PCR检测的拷贝数Note:The abscissa is the dilution ratio of virus in the mixed contaminated samples, and the ordinate is the copy number detected by fluorescence qPCR图5 使用病毒DNA/RNA试剂盒提取RNA后进行MNV检测Fig.5 Performed MNV detection with virus DNA/RNA extract kit
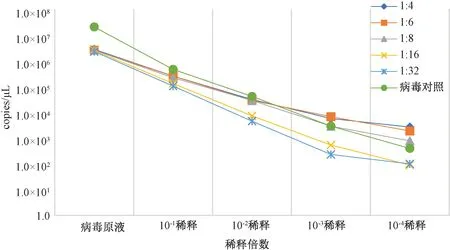
注:横坐标为混合的污染样本中病毒的稀释倍数,纵坐标为荧光定量PCR检测的拷贝数Note:The abscissa is the dilution ratio of virus in the mixed contaminated samples, and the ordinate is the copy number detected by fluorescence qPCR图6 病毒RNA提取试剂盒提取RNA后进行MNV检测Fig.6 Performed MNV detection with virus RNA extract kit
病毒原液的MNV浓度为3.13×106copies/μL,使用病毒DNA/RNA提取试剂盒提取时在病毒10-2倍稀释即病毒核酸浓度为3.13×104copies/μL时,盲肠样本进行1∶4、1∶6、1∶16、1∶32倍体积比稀释时都能获得较好的结果,当盲肠样本进行不高于16倍的体积稀释时,对样本中的高浓度病毒样本的检测会出现较大偏差,盲肠样本进行32倍的体积稀释后,对MNV的核酸检测结果影响较小。统计分析病毒原液对照和盲肠样本1∶32倍稀释后的检测结果,无显著差异(P>0.05)。
使用病毒RNA提取试剂盒对后续的Q-PCR检测结果影响较小。盲肠内容物样本在稀释度为1∶8时病毒核酸检测的偏差最小。统计分析病毒原液对照和盲肠样本1∶8稀释后的检测结果,无显著差异(P>0.05)。
2.6 不同稀释度的盲肠内容物使用RNA/DNA提取试剂盒检测结果
将1∶4稀释的盲肠内容物样本与不同梯度稀释的MNV病毒液1∶1混匀后再使用无菌PBS进行4倍和8倍稀释,使用病毒DNA/RNA试剂盒提取RNA,反转录后使用MNV Q-PCR检测,结果如图7所示。盲肠内容物样本中的病毒核酸经16倍稀释及32倍稀释后进行核酸提取,检测得到的结果与病毒对照的检测结果相差不大,统计分析数据无显著差异(P>0.05)。

注:横坐标为混合的污染样本中病毒的稀释倍数,纵坐标为荧光定量PCR检测的拷贝数Note:The abscissa is the dilution ratio of virus in the mixed contaminated samples, and the ordinate is the copy number detected by fluorescence qPCR图7 MNV污染的盲肠内容物样本倍比稀释后检测结果Fig.7 Detection result of multiple dilution of MNV contaminated cecum content samples
3 讨论
鉴于ICLAS提供的盲样主要是检测病毒抗原,PCR检测方法作为病毒抗原检测首选方法具有灵敏度高、特异性强等优点。而荧光定量PCR方法较传统PCR方法来说进一步提高了灵敏度,染料法荧光定量PCR和探针法荧光定量PCR各有其优缺点。探针法荧光定量PCR具有灵敏度高、特异性强的优点,然而MNV、出血热病毒等病毒核酸的单核苷酸多态性较高,探针法荧光定量PCR方法的建立和应用就存在局限性。染料法荧光定量PCR具有灵敏度的优点,且相对于探针法来说,仅使用两对引物进行检测,有利于MNV、出血热病毒等单核苷酸多态性较高病毒的检出。ICLAS主要委托国际上的动物病毒检测机构制备盲样,病毒来源多样,病毒单核苷酸多态性较高的病毒最好使用PCR或者染料法荧光定量PCR法的通用引物进行检测。
由于ICLAS提供盲样时,并未对盲样的检测范围有规定,且盲样量有限,因此分析盲样样品种类,有针对性的进行病毒筛查十分有必要。比如盲样49-8来源于小鼠小肠组织,则首先筛查MRV。MRV属于呼肠病毒科,轮状病毒属,病毒经口腔感染3日龄小鼠后3 h病毒可在胃、小肠和大肠中检出,24 h肝、肺、脾、和血液中也可检出病毒,30 h大脑、膀胱和尿液中也有病毒存在。LCMV可出现在感染动物的所有器官,但一般使用脑、肝组织进行病毒分离,HV一般在感染动物的脑、肺、肾等组织中分离病毒,Reo3、TMEV、MNV主要在小鼠粪便中检测病毒。经过鉴定,收到的4份盲样,49-1为TMEV,49-4为MNV,49-8为MRV,49-9为LDV。
在对盲样49-4的检测过程中发现使用病毒DNA/RNA提取试剂盒提取核酸对后续的MNV检测有影响。Q-PCR的扩增曲线异常、PCR产物电泳条带非特异扩增明显且测序得不到阳性结果。本实验使用MNV阴性小鼠盲肠内容物和MNV病毒培养物进行模拟实验,结果显示病毒DNA/RNA提取试剂盒提取核酸对低于1∶16倍稀释的的盲肠内容物中高浓度MNV检测有影响,其Q-PCR扩增曲线为非S曲线的异常曲线,而盲肠内容物进行1∶32稀释后对各种浓度的MNV检测均无影响。参考文献中感染MNV小鼠的小鼠粪便中MNV的拷贝数一般在105~106copies,故实验总结出粪便样本中MNV检测时最好选取病毒RNA提取试剂盒,或者样本使用PBS进行体积比1∶16倍稀释后使用病毒DNA/RNA提取试剂盒进行核酸提取。
本实验仅使用两种试剂盒作为代表进行了盲肠内容物样本的MNV核酸提取实验,两种试剂盒都是离心柱法,结合其实验结果,可能是高浓度的盲肠样本中的物质经过不同的离心柱膜纯化后的成分不同,进而影响了实验结果。田胜男等[8]在比较Trizol法和QIAamp Viral RNA Mini Kit法提取不同样品中的MNV RNA时,使用Trizol法提取的小肠组织RNA进行PCR实验不能得到特异的扩增条带。是否是肠液中的某些成分对Trizol法和DNA/RNA离心柱法提取RNA时有影响还需要进一步的实验进行研究。一些研究显示,肠液中的某些黏液有可能对病毒提供保护作用,这也可能导致肠液浓度大时对病毒RNA的提取效率[9]。本实验仅分别使用了一种试剂盒,是否有可能是病毒DNA/RNA提取试剂盒相对于病毒RNA提取试剂盒不同的原理造成了RNA提取的不同结果,还需要进一步的实验研究。
经过此次国际比对能力验证,对收到的4份病毒病原盲样上报了实验结果后获得100%满意的结果,对实验室病毒检测能力进行了自我评估,说明病毒检测鉴定能力可靠,检测人员水平合格。MNV盲肠内容物污染模拟实验确定了实验室检测MNV的最佳策略,提高了实验人员对样品检测前的处理工作对实验结果影响的认识,说明参加ICLAS-PEP计划对提高和保障实验室检测水平有重要意义。

