大黄素对大鼠非酒精性脂肪肝及肝组织11β-羟基类固醇脱氢酶1表达的影响*
孙红爽 李鹏霖 刘永双 乜春城 种宝贵
(哈励逊国际和平医院药学部,衡水 053000)
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是代谢综合征的主要临床表现之一,其发病机制尚不完全明确,但“二次打击”理论已被普遍认同,胰岛素抵抗、氧化应激、炎性反应和脂质代谢紊乱在其发病过程中发挥了重要作用[2]。大黄素(emodin)是中药材大黄的主要有效单体组分,可从大黄、虎杖、决明子、何首乌和芦荟等中药材中有效提取。大黄素具有多种药理作用,主要包括抗炎、抗氧化、调节血脂、保护肝细胞、抗肿瘤等[3]。研究发现,大黄素可以改善高脂饲料喂养大鼠非酒精性脂肪肝及脂质代谢紊乱[4]。本次研究通过高热量饲料喂养建立NAFLD大鼠模型,观察大黄素对高热量饲料喂养所致大鼠NAFLD的治疗作用并探讨其作用机制,为NAFLD的药物治疗和发病机制研究提供理论基础。
1 材料和方法
1.1 实验动物
清洁级雄性Wistar大鼠40只,体质量200~220 g,购自河南实验动物中心,实验动物生产许可证编号SCXK(豫)2017-0001,饲养于中国药科大学药理教研室【SYXK(苏)2018-0018】;适应性喂养1周后开始实验。本研究经哈励逊国际和平医院伦理委员会审核批准(2018-3-015)。
1.2 试剂与仪器
大黄素(郑州荔诺生物科技有限公司,批号:160724,纯度98%),全自动生化分析仪(日立公司,7600-020),两步法RT-PCR试剂盒(TaKaRa公司);11β-HSD1抗体(Santa Cruz公司);实时定量PCR仪(MJ Research 公司);Western blot仪(Bio-Rad公司)。
1.3 动物分组与给药
40只大鼠随机分为:对照组、模型组、大黄素低剂量组(E1组)、大黄素高剂量组(E2组),每组10只。对照组给予普通饲料,其他3组给予自制高热量饲料(配方:22%猪油+8%糖+2%胆固醇+2%食盐+66%基础饲料),饮用自来水。第9周开始,E1组、E2组每天分别灌胃给以大黄素30 mg/kg和60 mg/kg(用0.5%羧甲基纤维素钠溶液提前配制,浓度10 mg/mL),对照组和模型组灌胃给以相同体积的0.5%羧甲基纤维素钠溶液,每天给药1次,连续6周。
1.4 指标检测
1.4.1一般观察:每周记录大鼠体质量、进食量,观察动物皮毛光泽度、粪便及活动情况。
1.4.2肝指数的测定:大鼠麻醉后颈动脉插管取血,血样1 370 r/min离心10 min,分离血清,于-20 ℃保存待测。打开腹腔,取完整肝组织,反复漂洗后称重,并计算肝指数(hepatic index, HI):HI(mg/g)=肝脏重量(g)/体质量(g)×1 000。
1.4.3血液指标测定:采用全自动生化分析仪检测血清中的血糖、总胆固醇(totalcholesterol,TC)、三酰甘油(triglycerides,TG)、高密度脂蛋白(high density lipoprotein, HDL)、游离脂肪酸(free fatty acid, FFA) 及丙氨酸转氨酶(alaninne aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)。采用DFM-96型16管放射γ免疫计数器检测血清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)和胰岛素。并计算胰岛素抵抗指数(HOMA-IR):HOMA-IR=(空腹胰岛素×空腹血糖)/22.5。
1.4.4肝组织生化指标测定:取新鲜肝组织200 mg肝组织,制成10%的肝组织匀浆,1 370 r/min离心15 min,取上清液,-20 ℃冰箱保存。用于测定肝组织TC、TG、FFA及TNF-α含量,检测方法同血液指标测定。

1.4.6肝组织11β- HSD1蛋白表达:取适量肝组织,提取组织蛋白进行Western blot检测。14.7%分离胶、5%浓缩胶,60V电泳后转膜2 h,室温封闭2 h,以兔抗小鼠11β-HSD1多克隆抗体为一抗(1∶200 稀释)4 ℃过夜,以羊抗兔IgG-HRP抗体为二抗(1∶800稀释)室温作用2 h,ECL检测。实验所得条带,在Bandscan分析软件中测得各自的总灰度值,进行定量分析,并用自身β-actin灰度值校正。
1.4.7肝组织病理学检查:取适量新鲜肝脏,甲醛溶液固定,乙醇梯度脱水,切片,苏木精-伊红染色法(HE)染色,光学显微镜下观察。参考非酒精性脂肪性肝炎(NASH)临床研究评分系统[5],评价肝组织病变情况,即:脂肪变性(0~3分)、小叶炎症(0~3分)、汇管区炎症(0~1分)、肝细胞气球样变(0~2分)和肝组织纤维化(0~4分),评分标准见表1。

表1 NASH评分标准Table 1 NASH clinical research network scoring system
1.5 统计学分析
2 结果
2.1 一般情况
对照组食欲良好,体质量稳定增长,大便呈颗粒状、黄而质硬,皮毛整洁,行动敏捷。模型组食欲减退,肥胖,大便呈颗粒状、黑而质硬,毛色发黄且蓬乱,行动迟缓。与模型组比较,E1组体质量较模型组下降,大便质软,皮毛微黄;E2组体质量下降更为明显,大便质稀、不成形,皮毛微黄,行动较敏捷。
2.2 肝指数
各组大鼠肝指数检测结果见图1。与对照组比较,模型组及E1组肝指数显著增大(P<0.01或P<0.05);与模型组比较,E1组及E2组肝指数均有下将趋势,但只有E2组有显著差异(P<0.05)。
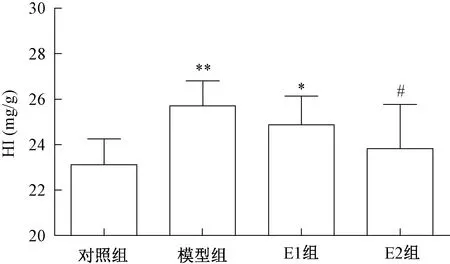
注:*P<0.05,**P<0.01,与对照组比较;#P<0.05,与模型组比较Note:*P<0.05,**P<0.01, compared with control group;#P<0.05, compared with model group图1 各组大鼠肝指数Fig.1 Hepatic index (HI) in wistar rats
2.3 血液生化指标
肝功能、血糖、血脂、胰岛素及TNF-α检测结果见表2。与对照组比较,模型组大鼠AST、ALT、血糖、血脂、胰岛素及炎性因子TNF-α水平均显著升高(P<0.01);与模型组比较,E1组和E2组以上各项指标均有好转趋势,且E2组变化更为显著(P<0.01或P<0.05)。说明模型组动物出现血糖、血脂紊乱,肝功能异常及炎性反应,而大黄素治疗可有效改善以上病变,且高剂量组效果更明显。同时HOMA-IR与胰岛素耐量试验结果很好吻合。
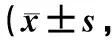
表2 各组大鼠血液生化指标结果Table 2 The serum parameters of wistar rats n=10)
2.4 肝指数及肝脏生化指标
肝指数、肝组织脂质沉积及TNF-α含量检测结果见表3。与对照组比较,模型组大鼠肝指数显著增大,出现明显的肝脂质沉积,且肝TNF-α含量明显升高(P<0.01);与模型组比较,E1组和E2组以上各项指标均有下降趋势,且以E2组下降更为显著(P<0.01或P<0.05)。
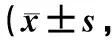
表3 各组大鼠肝生化指标结果Table 3 The hepatic tissue biochemical parameters of wistar rats n=10)
2.5 肝组织11β-HSD1基因及蛋白表达
与对照组比较,模型组和E1组肝组织11β-HSD1 mRNA及蛋白表达明显升高 (P<0.01);与模型组比较,E1组和E2组肝组织11β-HSD1 mRNA及蛋白表达均显著降低(P<0.05,P<0.01),且E2组变化更为显著,结果见图2。

注:A:肝组织11β-HSD1基因表达结果;B:肝组织11β-HSD1蛋白表达结果;与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note: A: The expression of 11β-HSD1 mRNA in liver; B: Western blot analysis of 11β-HSD1 in liver; Compared with control group,**P<0.01;Compared with model group,#P<0.05,##P<0.01图2 各组肝组织11β-HSD1基因及蛋白表达结果Fig.2 The expression of 11β-HSD1 mRNA and protein in liver of wistar rats
2.6 肝组织切片
肝组织切片显示:对照组大鼠肝细胞结构完整,肝小叶轮廓清晰,所有动物均未显示脂肪变性及炎性反应;模型组大鼠脂肪变性明显,可见汇管区炎性反应,并伴有轻度或中度肝细胞气球样变,部分发现肝组织纤维化;E1组大鼠脂肪变性程度减轻,部分发现汇管区炎性反应及轻度肝细胞气球样变,个别肝组织纤维化;E2组大鼠肝小叶结构清楚,个别出现轻度脂肪变性、汇管区炎性反应及肝细胞气球样变,未见肝组织纤维化。典型肝组织切片见图3。
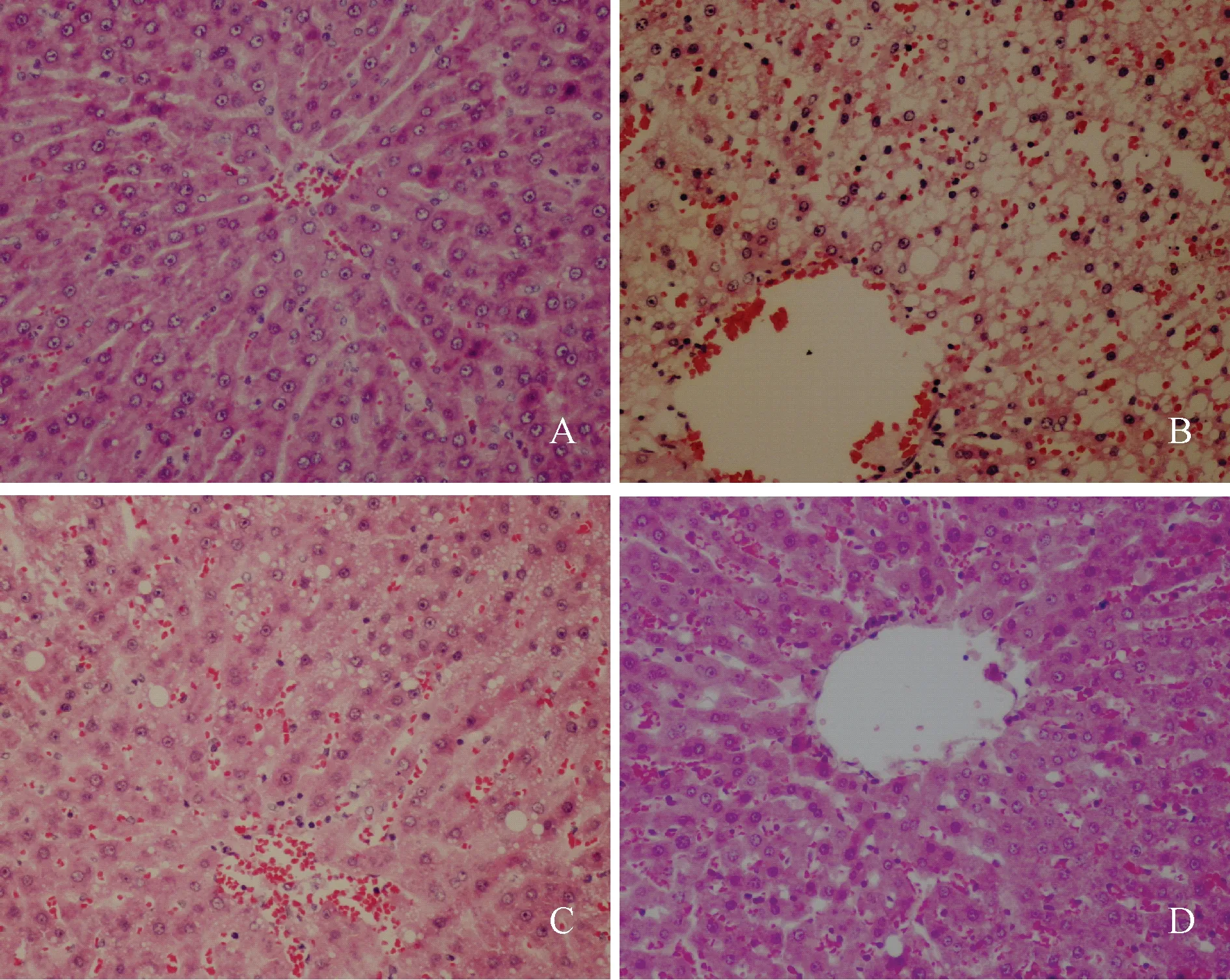
注:A:对照组;B:模型组;C:E1组;D:E2组Note: A: the control group; B: the model group; C: the E1 group; D: the E2 group图3 大鼠肝病理切片Fig.3 Representative histopathological ndings in the liver of wistar rats (HE, ×200)
3 讨论
NAFLD是代谢综合征疾病谱中的重要一员,其发病机制尚未完全阐明,但现已证实其发病过程与胰岛素抵抗密切相关。截至目前,并没有针对NAFLD的特效治疗药物,多采用改善饮食结构、运动等行为方式改变,结合降脂药物、胰岛素增敏剂、抗氧化剂、保肝药物等对症治疗[6-7]。
大黄是我国传统中药材,具有泻热通便、凉血解毒、逐瘀通经的功效。大黄素是中药大黄的主要活性成分,属游离型蒽醌类衍生物,具有泻下、抗感染、抗菌、抗病毒、降脂、降压和抗肿瘤等作用[8-9]。近年来,大黄素用于治疗糖尿病、脂肪肝的报道日益增多,研究显示其在改善糖脂代谢、胰岛素抵抗状态、肝脏脂质沉积等方面具有显著作用[10],有学者认为这可能与其抑制炎性反应有关[11]。本课题前期研究发现,大黄素可以明显改善胰岛素抵抗大鼠的糖脂代谢水平和胰岛素敏感性,抑制11β-HSDl基因及蛋白表达可能是其作用机制之一[12]。
11β-HSD1是一种低亲和力、NADPH依赖的微粒体酶,在体内可以催化无活性的 17-羟-11脱氢皮质酮转化成具活性的皮质醇,从而调节体内糖皮质激素水平来发挥生理效应[13]。11β-HSDl与代谢综合征、2型糖尿病密切相关,11β-HSDl基因敲除可改善胰岛素抵抗,11β-HSDl抑制剂可有类似效果。目前已知的天然 11β-HSD1 抑制剂主要包括:胆汁酸、孕激素的代谢产物、黄酮/羟基黄酮、生胃酮、大黄素、姜黄素以及越南割舌树提取物cochinchinoid K等[14]。另外,许多研究者通过改变已知11β-HSD1 抑制剂的结构,人工合成了许多11β-HSD1 抑制剂,如BVT2733、INCB013739、MK0916、PF-915275等[15]。11β-HSD1 作为一个新的靶点已经成为近年来创新药物研究的热点。有文献报道,大黄素可以通过选择性的抑制11β-HSD1活性,降低空腹血糖水平,增加糖耐量,增加胰岛素敏感性,有效改善胰岛素抵抗状态[16-17],这与本研究前期研究一致。
本次研究结果显示,大黄素治疗能够显著改善高热量饲料喂养所致大鼠NAFLD,表现为:降低肝指数,改善肝功能,降低血脂及肝脂质沉积,减少炎性因子的释放。肝组织切片观察结果与指标检测结果吻合,大黄素治疗组肝脂肪变性、肝细胞气球样变、汇管区炎性反应、纤维化等NAFLD病理改变均有不同程度的改善。并且,大黄素高剂量组较大黄素低剂量组治疗效果更为明显,说明大黄素对NAFLD的治疗作用呈剂量依赖性。同时,大黄素可有效抑制胰岛素抵抗及肝组织内的11β-HSD1基因和蛋白表达量。推测,大黄素通过抑制体内11β-HSD1活性,改善胰岛素抵抗状态,进而发挥对NAFLD的治疗作用。

