乳双歧杆菌V9对小鼠免疫功能的影响及机制研究*
马立艳 孙 伟
(首都医科大学附属北京友谊医院 临床检验中心,北京 100050)
肠道微生物群对于维持其内环境的平衡和免疫起着重要作用。其免疫功能的失衡常由肠道内正常微生物群遭到破坏而引发[1-3]。益生菌可优化肠道菌群构成、产生抗炎因子、抑制有害菌群生长、增强肠道黏膜免疫,从而预防和治疗一些消化道疾病[4-5]。
肠道正常菌群中的乳酸杆菌属(Lactobacillus)细菌是益生菌的重要成员,对维持肠道微生态平衡,增强肠道的免疫功能尤为重要[6]。研究表明,乳酸菌对免疫功能的调控是多方面的,如通过增强单核吞噬细胞活性可以增强非特异性免疫应答,通过刺激T淋巴细胞和B淋巴细胞的增殖、加强体液免疫功能等增强特异性免疫应答,还可以提高机体自然杀伤细胞的活性等。由于不同乳酸菌细胞壁结构不同,其进入机体后,对肠道免疫细胞产生的作用不同[7-9],故其对机体产生的免疫调节作用也不同。研究表明,乳双歧杆菌BL-99增强机体免疫的机制与促进免疫球蛋白A的分泌,刺激肠黏膜淋巴细胞的增殖,增强巨噬细胞及自然杀伤细胞功能有关[10]。有研究发现乳双歧杆菌M8增强大鼠免疫功能的机制与刺激T淋巴细胞转化、增殖、提高淋巴细胞比例和诱导细胞因子分泌有关[11]。
乳双歧杆菌V9(BifidobacteriumlactisV9)是分离自内蒙古草原上健康儿童肠道中的双歧杆菌乳亚种,对人工胃液、肠液以及胆盐有良好的耐受性[12]。本研究旨在通过检测和评估乳双歧杆菌V9对小鼠免疫器官指数、单核-巨噬细胞吞噬能力、细胞免疫、体液免疫功能,以及对NK细胞活力等的影响,进一步明确乳双歧杆菌V9的体内作用机制,为其开发利用提供实验依据。
1 材料和方法
1.1 材料
刀豆蛋白A(ConA)、Hank′s溶液、0.4%锥虫兰溶液(北京索莱宝科技有限公司);RPMI1640培养基、胎牛血清(Gibco公司);MTT试剂、LDH检测试剂盒(Abcam公司);印度墨汁、YAC-1细胞、20%鸡红细胞(上海源叶生物科技有限公司);1% NP40、0.2 mol/L的Tris-HCl缓冲液(pH = 8.2)(碧云天生物科技有限公司);乳双歧杆菌V9菌粉(2×1011/g)(金华银河生物科技有限公司)。称取冷冻干燥保存的乳双歧杆菌V9菌粉,用双蒸水溶解后备用[13-15]。
1.2 实验动物及给药
SPF级C57BL/6J雄性小鼠320只,体质量18~22 g,来源于北京斯贝福生物技术有限公司【SCXK(京)2019-0010】。动物饲养于北京康华投资有限公司啮齿类动物SPF级屏障环境【SYXK(京)2020-0001】,室温(23±2)℃,相对湿度:40%~70%,12 h/12 h明暗交替,自主饮食和饮水。本研究所有动物实验操作严格遵守动物伦理和动物福利的要求,按照美国国立卫生研究院制定的《实验动物管理和使用指南》和北京市实验动物管理条例的相关规定进行实验,本实验由北京神瑞生物技术有限公司伦理委员会审查,伦理审批号:SRSWLL-2021091802。
根据《保健食品检验与评价技术规范》(2003版)中免疫力评价方面的规定,对乳双歧杆菌V9进行评价[16]。将小鼠随机分为8个免疫组,分别进行动物脏器指数测定、小鼠脾淋巴细胞转化实验、小鼠迟发型变态反应检测、小鼠碳廓清实验、巨噬细胞对鸡红细胞的吞噬实验、血清溶血素测定、抗体生成细胞实验、NK细胞活力检测。每个免疫组设4个实验组,每个实验组10只。阴性对照组灌胃给予双蒸水,其他3组分别灌胃给予低、中、高剂量的乳双歧杆菌V9菌粉(0.5、1.0、3.0 mg/kg),每日1次,持续30 d。每日观察记录小鼠状态,每周称重。
1.3 小鼠脏器指数(organ index,OI)的计算
分别灌胃给予不同剂量的乳双歧杆菌V9 30 d后,将小鼠脱臼处死,无菌操作台上取出脾脏、胸腺,分别进行称重,并计算各鼠的脏器指数:OI=胸腺或脾重量(mg)/体质量(g)。
1.4 ConA诱导的小鼠脾淋巴细胞转化实验
无菌取脾,磨碎后过滤,将细胞浓度调整至3×106个/mL。将细胞加至24孔板中,1.0 mL/孔,实验组加75 μL ConA/孔(终浓度为7.5 μg/mL),对照组加75 μL无菌水/孔,设3~5个复孔,继续培养72 h。实验结束前4 h弃上清,每孔吸去上清0.7 mL,同时加入等体积RPMI1640培养基(不含血清),加入MTT至终浓度为0.5 mg/mL。4 h后,弃上清,加酸性异丙醇1.0 mL/孔,混均置室温20 min。分别吸取200 μL各孔样品至新的96孔板中,570 nm处测定各孔的A值[17]。
1.5 小鼠迟发型变态反应(DTH)实验(耳肿胀法)
小鼠腹部脱毛后,取50 μL 1%二硝基氟苯(DNFB)溶液,均匀涂抹在小鼠脱毛后的腹部皮肤。5 d后,取20 μL 1% DNFB溶液涂抹于各组小鼠的右耳上。24 h后,采用打孔器取相同大小的左右耳片进行称重。以左耳为对照,用两耳片的重量之差表示DTH的程度[18]。
1.6 小鼠碳廓清实验
将稀释后印度墨汁尾静脉注入小鼠,0.1 mL/10 g。于注入墨汁第2、10 min经内眦静脉丛各取血20 μL,分别加到2 mL 0.1%Na2CO3溶液中。以Na2CO3溶液为空白对照,721分光光度计在600 nm处测定各孔的A值。按文献方法计算各组小鼠的吞噬指数α来衡量其碳廓清能力[18]。
1.7 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)
用1 mL的20%鸡红细胞悬液免疫小鼠。30 min后处死小鼠,腹腔注射0.9%氯化钠溶液,2 mL/只,吸取腹腔液,滴于载玻片,按照文献方法分别计算吞噬指数和吞噬百分率[13]。
1.8 血清溶血素测定
收集绵羊红细胞,用0.9%氯化钠溶液配成体积比为2%的细胞混悬液,腹腔注射至小鼠体内。4 d后,摘除眼球采血,收集血清。取300倍稀释后的血清1.0 mL,依次加入10%SRBC 0.5 mL、补体1.0 mL,反应20 min后,离心取上清1.0 mL,加都氏试剂3.0 mL。以10%SRBC 0.25 mL加都氏试剂4.0 mL混匀后作空白对照。540 nm处测定各管A值。
1.9 抗体生成细胞检测
同1.6方法免疫小鼠,4 d后处死小鼠,无菌操作台上取出脾脏,研磨后过滤,制成5 ×106个/mL的脾细胞悬液。溶血空斑实验检测抗体生成细胞数(空斑数/106脾细胞数)。
1.10 NK细胞活力测定
收集YAC-1细胞,将细胞浓度调整至4×105个/mL。无菌取脾,制成单细胞悬液,调整细胞浓度为2×107个/mL。以效应细胞∶靶细胞=50∶1的比例将这两种细胞加入U型96孔培养板中,以加靶细胞+培养液各100 μL的孔作为靶细胞自然释放孔,以加靶细胞+1%NP40各100 μL的孔作为靶细胞最大释放孔,按照文献方法测定各孔A值[8],并计算NK细胞活性(%)。
1.11 统计学分析
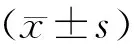
2 结果
2.1 对小鼠脏器指数的影响
给药期间,各给药组和对照组小鼠的生活状态良好,未观察到腹泻等现象。各组小鼠均未出现中毒或死亡现象。各组小鼠的初始体质量和终末体质量均无显著性差异(P>0.05)(表1)。各组小鼠的免疫脏器指数检测结果由表1可知,连续灌胃给予0.5、1.0、3.0 mg/kg 3个剂量的乳双歧杆菌V9 30 d后,各组小鼠的脾指数(脾/体质量比值)、胸腺指数(胸腺/体质量比值)与空白对照组相比均未发现显著性差异(P> 0.05)。
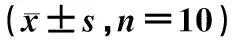
表1 不同剂量乳双歧杆菌V9给药组及对照组小鼠的脏器指数Table 1 Bifidobacterium lactis V9 on mice organs ratios to body
2.2 对小鼠细胞免疫功能的影响
2.2.1对ConA诱导的小鼠脾淋巴细胞转化的影响:不同剂量乳双歧杆菌V9对ConA诱导的脾淋巴细胞增殖作用结果见表2。由表2可知,与对照组相比,3个剂量组的A差值均有所增高,表明脾淋巴细胞转化增强,且差异具有统计学意义(P<0.05,P<0.01)。
2.2.2小鼠迟发型变态反应:由表2可知,与空白对照组相比,3个剂量组的乳双歧杆菌V9给药组小鼠的耳廓肿胀度差异均不显著(P>0.05)。
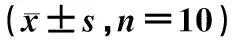
表2 不同剂量乳双歧杆菌V9给药组、对照组小鼠的淋巴细胞增殖转化及耳廓肿胀度的影响Table 2 Effects of Bifidobacterium lactis V9 on ConA-induced mouse splenic lymphocyte transformation ability and delayed hypersensitivity induced by
2.3 对小鼠单核-巨噬细胞功能的影响
2.3.1小鼠碳廓清功能:不同剂量乳双歧杆菌V9对小鼠碳廓清能力的影响结果见表3。由表3可知,与空白对照组相比,中、高剂量组小鼠的吞噬指数α与对照组相比差异显著(P<0.05)。
2.3.2巨噬细胞对鸡红细胞的吞噬能力的影响:由表3可知,给予小鼠0.5、1.0、3.0 mg/kg乳双歧杆菌V9 30 d后,中、高乳双歧杆菌V9组的吞噬率和吞噬指数均显著高于对照组(P<0.05)。
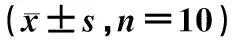
表3 不同剂量乳双歧杆菌V9给药组及对照组小鼠巨噬细胞吞噬功能Table 3 Bifidobacterium lactis V9 on the function of monocyte macrophage of the
2.4 对小鼠体液免疫功能的影响
2.4.1小鼠半数溶血值(HC50):表4为不同剂量乳双歧杆菌V9对小鼠半数溶血值的影响。由表4可知,中、高剂量的乳双歧杆菌V9组的HC50值与对照组相比差异显著(P<0.05)。
2.4.2对溶血空斑数的影响:由表4可知,3个不同剂量的乳双歧杆菌V9组的空斑数与对照组相比差异不显著(P>0.05)。
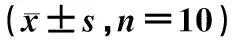
表4 不同剂量乳双歧杆菌V9给药组及对照组小鼠HC50与空斑数Table 4 Bifidobacterium lactis V9 on HC50 and number
2.5 对小鼠NK细胞活力的影响
表5为不同剂量乳双歧杆菌V9对小鼠NK细胞活性的影响结果。由表5可知,高剂量组小鼠NK细胞活性显著高于对照组(P<0.05)。
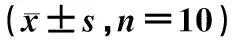
表5 不同剂量乳双歧杆菌V9给药组及对照组NK细胞活性Table 5 Bifidobacterium lactis V9 on NK
3 讨论
乳酸菌作为体内的正常菌群,具有调节肠道菌群构成、增强肠道黏膜免疫、抗氧化、抗癌等功效,越来越引起医药学、保健品、微生态学等领域的关注[19]。乳酸菌是目前研究最多且应用最为广泛的益生菌之一。不同乳酸菌株的免疫调节功能常因菌株类型而异。健康儿童肠道中分离出来的乳双歧杆菌V9,是益生菌的一种,为动物双歧杆菌乳亚种,除了具备良好的耐酸性,还能耐受人工胃液、肠液以及胆盐[20]。本研究通过测定小鼠脏器/体质量比、脾淋巴细胞转化增殖能力、巨噬细胞吞噬能力、DNFB诱导小鼠DTH强弱、溶血空斑数目、HC50值、NK细胞活性等各指标以综合评估乳双歧杆菌V9对小鼠免疫功能的影响。
免疫系统功能的强弱通常用免疫系统的脏器系数来判定,其中胸腺指数和脾指数作为间接反映机体的免疫水平的指标[21]。本研究结果显示,乳双歧杆菌V9低、中、高剂量组的小鼠脾指数、胸腺指数与对照组结果相近,明确了乳双歧杆菌V9的安全可行。ConA可选择性刺激T细胞的增殖,细胞免疫功能可用其转化率来体现。而本研究结果表明,随着乳双歧杆菌V9剂量的增高增殖转移能力逐渐上升,提示转化率明显增高。此外还证实了高剂量组的乳双歧杆菌V9均可显著提高小鼠碳廓清能力及巨噬细胞对鸡红细胞的吞噬能力,表示给予一定高剂量的乳双歧杆菌V9可通过提高吞噬功能以提高免疫廓清能力,从而增加机体非特异性免疫力。SRBC细胞发生溶血反应产生溶血素的能力常通过测定HC50值来评价。本研究结果显示,中、高剂量乳双歧杆菌V9均能显著提高小鼠HC50值。不同于T细胞和B细胞,NK细胞可非特异性杀伤肿瘤细胞及感染病毒的细胞,而主要机制与抗肿瘤、抗病毒和免疫调节关系密切[22]。而在本研究结果中,乳双歧杆菌V9高剂量下,通过增强NK细胞活性提高NK细胞杀伤力,以增强机体抵御外邪的能力。
本研究证实了乳双歧杆菌V9的安全可靠性,并通过调节小鼠免疫系统能提高其免疫力。尚需通过扩大实验样本量来进一步研究免疫机制,从而深入探究乳双歧杆菌V9对免疫系统的作用方式。
综上所述,乳双歧杆菌V9达到一定剂量时主要通过提高细胞自身免疫力、增强单核-巨噬细胞功能、体液免疫功能,以及加强NK细胞活力,调节小鼠的免疫系统防御能力。本研究结果为益生菌乳双歧杆菌V9增强免疫力的功能提供了基础数据支持,同时也为其进一步的开发和利用奠定了基础。

