人源化CSF-1R基因敲入小鼠模型的构建*
刘甦苏 吴 勇 谷文达 曹 愿 翟世杰 赵皓阳 范昌发
(中国食品药品检定研究院 实验动物资源研究所,北京 102629)
CRISPR-Cas9基因编辑技术是目前使用最为广泛的编辑技术,该系统由sgRNA和Cas9蛋白组成,sgRNA与Cas9结合并引导Cas9到达DNA靶点,Cas9作为核酸内切酶对靶序列进行切割,形成DNA双链断裂,实现特定基因的敲除或插入[1]。与锌指核酸酶(zincfinger nucleases,ZFNs)[2]、ES细胞打靶[3]和转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs)[4]等基因编辑工具相比,CRISPR-Cas9技术更加高效且快速,可以精确地控制细胞内基因的表达水平[5]。
巨噬细胞集落刺激因子受体(colony stimulating factor-1 receptor,CSF-1R)属于受体酪氨酸激酶家族,及其配体CSF-1 (colony stimulating factor-1)的过表达广泛存在于各类实体肿瘤中,并在肿瘤恶性增殖、转移和微环境调控等方面发挥着重要的作用。CSF-1R信号传导控制着巨噬细胞的分化和存活,且对肿瘤中相关巨噬细胞的促进和免疫抑制起着关键的作用。研究表明,阻断CSF-1/CSF-1R通路可显著降低巨噬细胞在肿瘤部位的浸润,并减缓原发性肿瘤生长、减少肿瘤转移。因此,CSF-1R成为了迄今巨噬细胞研究最成熟的靶点之一,大批针对该靶点的抗体药物及小分子抑制剂处于研发阶段[6-10]。
人鼠CSF-1R基因同源性存在差异,能识别人CSF-1R受体分子的药物或者抗体不一定能识别鼠CSF-1R,因而给评价针对此靶点的抗体和药物带来困难。为满足CSF-1R靶点人源化小鼠模型在药企及研究的需要,本文尝试利用CRISPR-Cas9基因编辑系统,构建人源化CSF-1R基因敲入小鼠,并对其表达特性、模型资源冷冻保存进行初步探索,为这类肿瘤免疫药物的临床前筛选与评估提供有效的工具[11-12]。
1 材料和方法
1.1 材料
1.1.1实验动物:C57BL/6Jnifdc、BALB/cCrSlcNifdc小鼠,18~22 g,雌性各20只,均来自中国食品药品检定研究院实验动物研究所,动物生产许可证号SCXK(京)2017-0005。繁育环境为SPF级,动物实验的使用许可证号SYXK(京)2017-0013,在清洁级环境中进行,饲喂SPF级小鼠颗粒饲料,饮用灭菌自来水。
本实验所有研究均按照中国食品药品检定研究院实验动物福利伦理委员会批准的动物方案进行,伦理审批号:中检动(福)第2021(B)002 号。
1.1.2主要仪器及试剂:限制性内切酶、T4DNA 连接酶、Taq酶、Trizol试剂、RT-qPCR 试剂盒、SYBR Premix Ex TaqⅡ荧光定量PCR试剂盒(大连宝生物公司);琼脂糖及其他生化试剂为进口分装、DMEM高糖培养基、L-谷氨酞胺、非必需氨基酸、青链霉素溶液、PBS缓冲液(Gibco公司);疏基乙醇、EDTA、二甲亚枫(Sigma公司);胎牛血清 (ES细胞认证) (HyClone公司)。R18S3精子冻存液、HTF培养液(日本熊本大学动物资源研发中心)。
Roche 480Ⅱ荧光定量PCR仪(Roche公司);Nano Drop超微量分光光度(Thermo公司);微量移液器(Eppendorf公司);引物由生工基因公司合成;TE缓冲液、TAE缓冲液自行配置;其他常见生化试剂乙醇、异戊醇、苯、氯仿均购自北京化学工业集团有限公司。
1.2 方法
1.2.1模型的构建:根据NCBI中提供的基因序列参考可知,小鼠CSF-1R基因(NCBI参考序列:NM001037859.2)位于小鼠18号染色体上,有22个外显子,其中ATG起始密码子位于外显子2,TGA终止密码子位于外显子22(转录本:Csf1r-201 ENSMUST00000025523.12)。人源CSF-1R基因(NCBI参考序列:NM 005211.3)位于人类5号染色体上,有22个外显子,其中ATG起始密码子位于外显子2,TGA终止密码子位于第22外显子(转录本:CSF1R-201 ENSMUST0000286301.7)。在构建该模型时,在小鼠CSF-1R外显子3的第20个氨基酸丙氨酸下游主要插入二段基因原件,一是人源CSF-1R-CDS部分的3到11外显子,二是鼠源CSF-1R-CDS的11外显子到TGA终止密码子,并在CCT-gr-1和CCT-gr-1的同源序列中引入GCC-A20和CCT-2的同源突变,具体构建策略见图1。
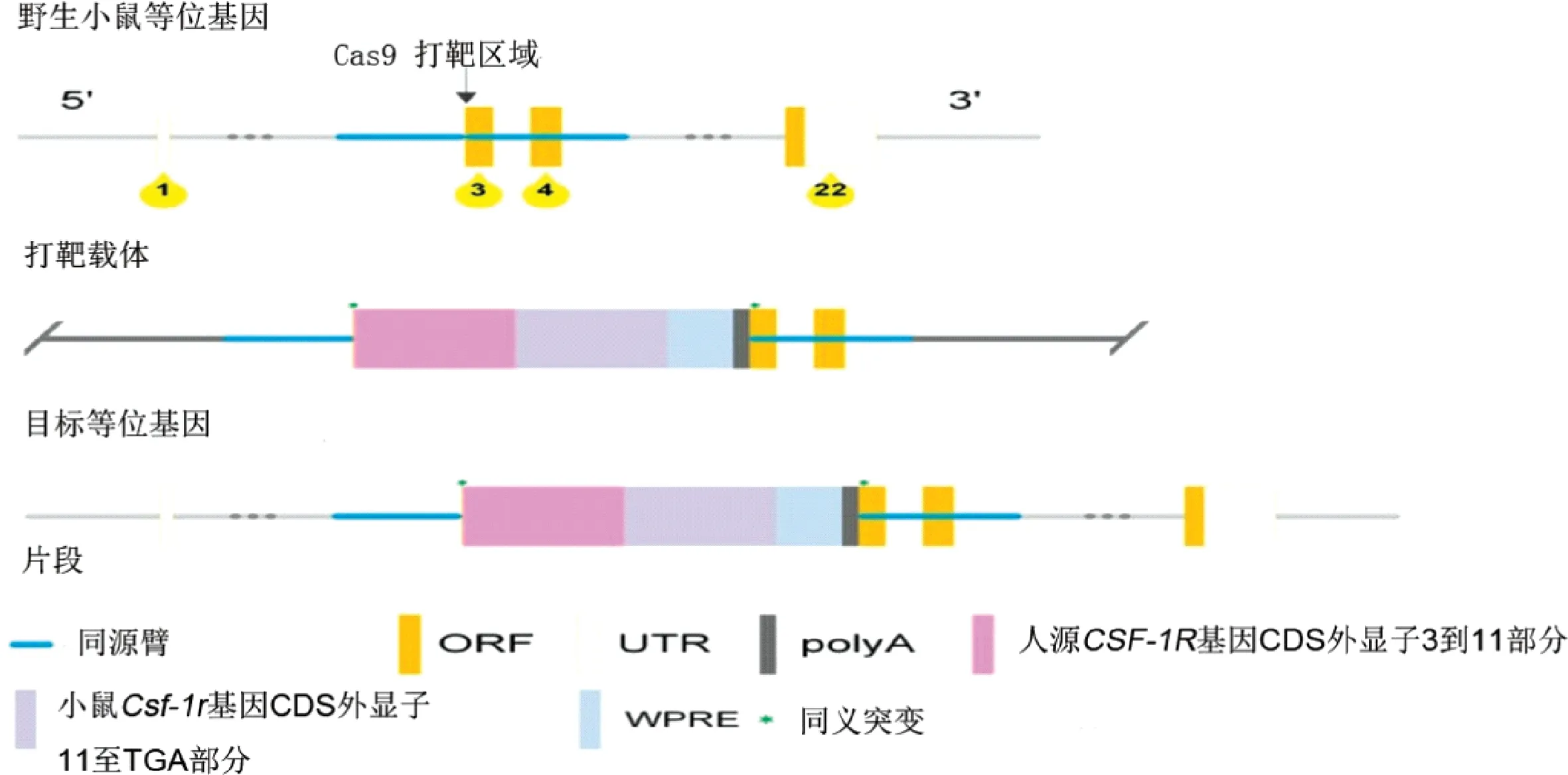
图1 模型构建设计策略Fig.1 Design strategy of model construction
1.2.2采用CRISPR-Cas9技术设计模型SgRNA表达载体:通过http://crispr.mit.edu/在线网站设计,确认sgRNA靶序列(5′-GCCACTAGGCTCGATGAC AGGGG-3′),将sgRNA上下游引物退火后引物与PCS载体,室温连接。使用高保真Tag DNA聚合酶从BAC克隆中扩增出含有同源臂(homologous arm)的小鼠基因组片段,并与重组位点和选择标记一起依次组装成同源打靶载体。
1.2.3胞质注射及胚胎移植:将制备好的SgRNA与Cas9 mRNA分别用无RNA酶水稀释至25 ng/μL和50 ng/μL,并于13 000 r/min离心20 min,吸取上清。用口吸管吸取液体从注射针后端注入尖端,进行显微注射导入到受精卵的细胞质中,并移植到与结扎雄鼠合笼的见栓假孕母鼠输卵管膨大部,缝合后将移植母鼠饲养于IVC环境中,产生靶向F0子代。
1.2.4阳性小鼠基因型PCR、测序分析及Southern杂交鉴定:逐只提取鼠尾基因组DNA,取100 ng DNA通过PCR检测基因型。引物设计针对转入基因的编码序列,引物设计3对,PCR 条件为:95 ℃ 5 min变性;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35 个循环。将PCR产物送诺赛基因公司进行测序,测序引物为F2及R2(设计策略见图2A、具体序列见表2)。Southern杂交的预期片段大小:5′探针-Aflll:3.45 kb-WT,7.44 kb-MT;3′探针-Scal:8.28 kb-WT,2.27 kb-MT。
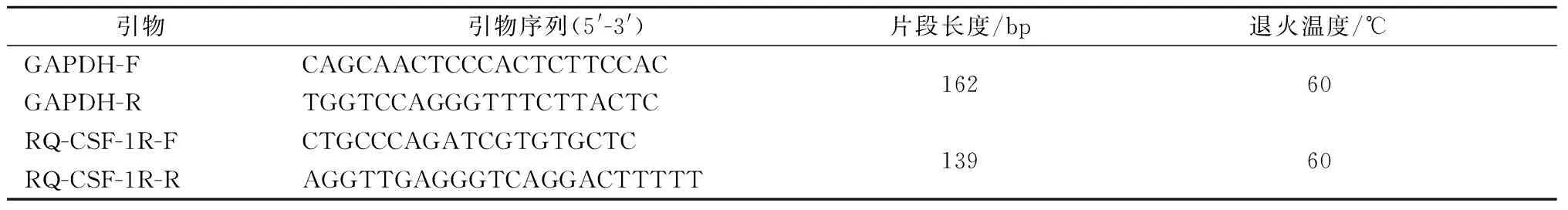
表2 荧光定量RT-PCR引物序列及退火温度Table 2 Primer sequence and TM of qRT-PCR

注:ORF:开放阅读框,UTR:非翻译区,PolyA:多聚腺苷酸,WPRE:调控元件Note: ORF:Open Reading Frame, UTR: Untranslated Region, PolyA:Polyadenylic acid,WPRE: Control element图2 阳性小鼠基因型鉴定及Southern杂交设计策略Fig.2 Genotype and Southern hybridization design strategy of positive mice
1.2.5小鼠模型繁殖建系:用PCR和序列分析法鉴定插入基因阳性的F0代首建鼠,随后将其与野生型小鼠进行种系传代获得F1代小鼠,将获得的F1杂合子小鼠进行两两交配,用于小鼠模型繁殖建系。
1.2.6荧光定量RT-PCR(RT-qPCR)检测基因表达水平:检测不同组织转基因RNA及蛋白表达水平:处置动物时解剖取心脏、肝、脾、肺、肾、脑,采用荧光定量RT-PCR及Western blot测定RNA水平及蛋白水平表达量。选用GAPDH内参基因,设计RT-qPCR 引物,CSF-1R基因特异上游引物为RQ-CSF-1R-F,下游引物为RQ-CSF-1R-R,目的片段长139 bp,序列及退火温度(表1)。进行反应时,测定cDNA 溶度,稀释终溶度为50 ng /μL,反应条件:95 ℃ 30 s 预变性,随后95 ℃ 5 s,60 ℃ 30 s,40个循环。

表1 CSF-1R阳性小鼠PCR、测序分析及Southern杂交鉴定引物信息表Table 1 Primer information of PCR, sequencing analysis and Southern hybridization in CSF-1R positive mice
1.2.7模型精子冷冻资源保存:按照Nakagata方法冷冻精子和复苏[13]。颈椎脱臼处死雄鼠,取出附睾尾,放入R18S3精子冻存液液滴的培养皿37 ℃恒温板上平衡3 min后,取精子悬浮液装0.25 mL麦管沉入液氮中,随后解冻复苏并通过体外受精验证模型保存效率。
2 结果
2.1 sgRNA打靶载体验证
根据设计sgRNA序列退火成双链后,在T4连接酶参与下连接到质粒上,通过限制性内切酶ApaLl、Ahdl/Drdl、Fspl验证打靶载体序列。实验结果见图1:具体的片段大小分别为ApaLl:5 000、3 100、2 100、1 200 bp;Ahdl/Drd:7 600、1 500、1 100、800 bp;Fspl:3 900、3 400、2 400、1 200 bp。
2.2 F0代小鼠的获得及繁殖建系
基因型鉴定结果显示,编号7号鼠为CSF-1R基因成功敲入的F0代小鼠。进一步将构建成功的F0代小鼠与野生型小鼠交配,获得1雄3雌的F1代阳性仔鼠,编号为34、37、38、39,鉴定结果见图4A和图4B,杂合子电泳结果可在约600 bp的位置清晰可见两条电泳条带,而野生型仅有一条;通过基因型鉴定后,选出一只阳性F1代小鼠编号为34,对其PCR产物进行序列比对,比对结果见图4C;Southern杂交的结果见图4D,序列比对结果显示插入了人源相关片段,Southern杂交预期片断大小也符合预期。
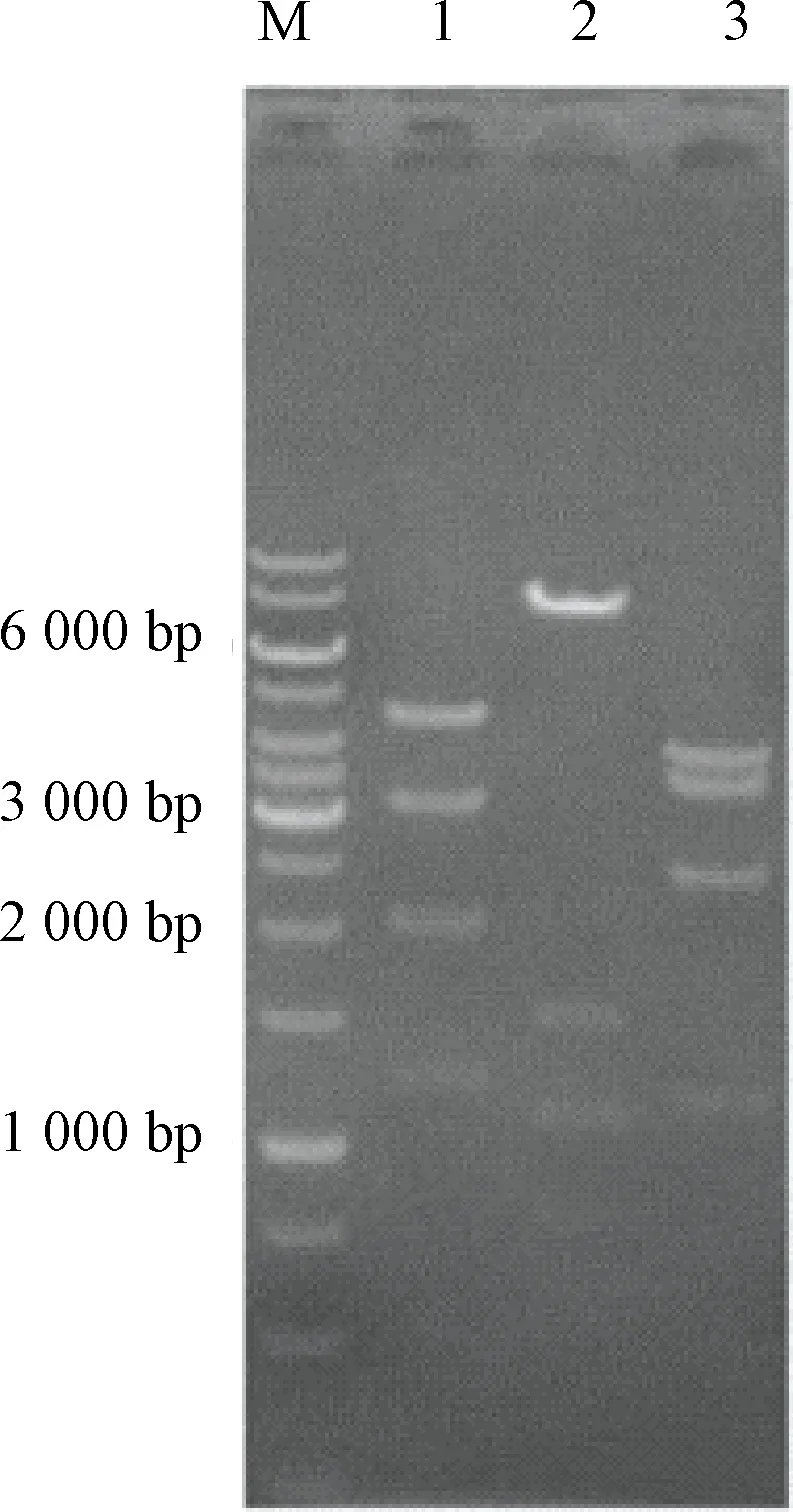
注:图中1是ApaLl酶,目标条带:5 000、3 100、2 100、1 200 bp;2是Ahdl/Drdl酶,目标条带:7 600、1 500、1 100、800 bp,3是Fspl酶,目标条带:3 900、3 400、2 400、1 200 bpNote: 1 is ApaLl enzyme, target band: 5 000、3 100、2 100、1 200 bp; 2 is Ahdl/Drdl enzyme, target band: 7 600、1 500、1 100、800 bp; 3 is Fspl enzyme, target band: 3 900、3 400、2 400、1 200 bp图3 打靶载体限制性内切酶验证结果Fig.3 Results of targeting vector restriction enzyme

注:A,B:F1代阳性小鼠PCR结果图;C:34号阳性鼠PCR产物序列比对图;D:34号阳性鼠Southern杂交片段图;WT.野生型小鼠Note: A, B: PCR results of F1 positive mice; C: Sequence comparison diagram of PCR products of No.34 positive mouse; D: Southern hybridization fragment of positive mouse No.34;WT.Wild-type mouse图4 CSF-1R基因敲入小鼠的鉴定结果Fig.4 Identification results of CSF-1R gene knock in mice
2.3 转入基因转录表达水平
根据转入基因CSF-1R的外显子区域和内参基因GAPDH序列设计引物,并通过梯度PCR优化退火温度,以扩增出单一条带为最佳退火温度。将同一样品同时扩增转基因和内参基因,当内参基因能顺利扩增出来,阴性对照无扩增情况,记录扩增结果。采用SYBR Green荧光嵌合法检测,建立RT-qPCR方法。首先分析了内参基因和转基因的溶解曲线,以检测本反应体系的特异性。二基因的溶解曲线主峰单一,表明特异性较好,扩增条件可靠。
分别选取8周龄杂合小鼠3只,解剖其主要目的脏器,结果表明转入基因能在小鼠模型心脏、肝、脾、肺、肾、脑主要脏器中表达,符合建立模型的初衷(图5)。
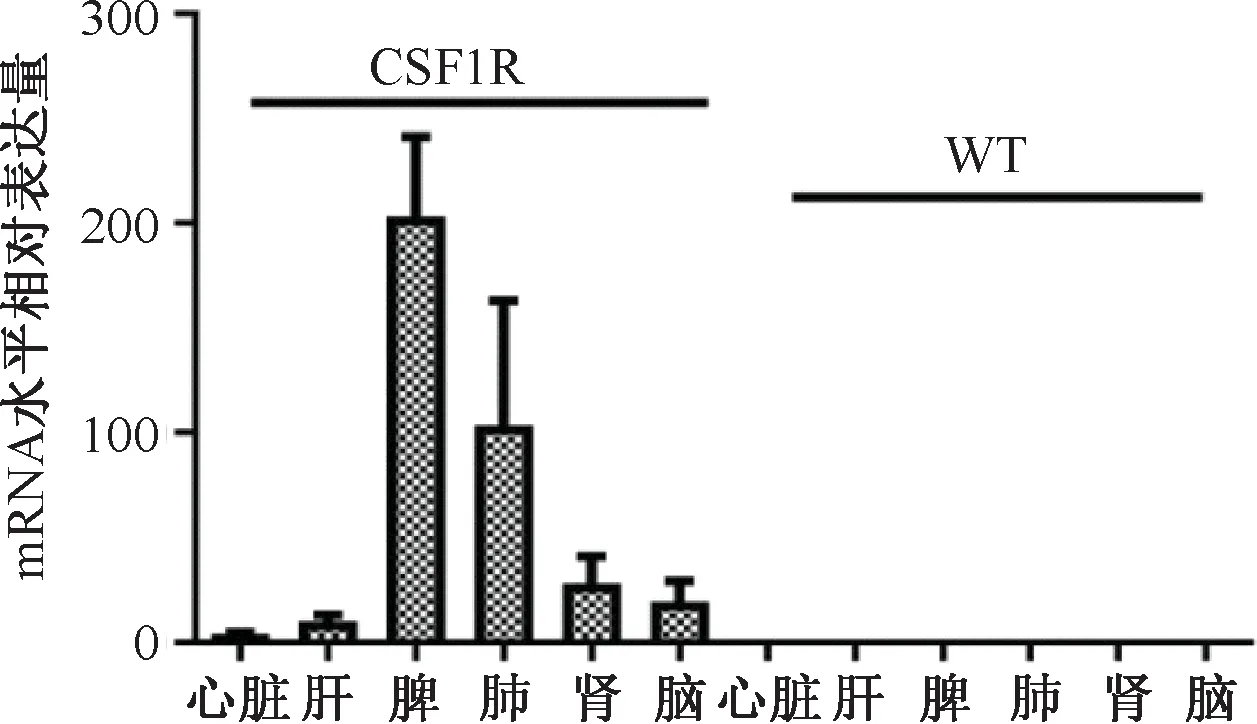
注:CSF1R:CSF-1R基因敲入小鼠;WT:野生型小鼠Note:CSF1R:CSF-1R knock in mouse; WT:Wild-type mouse图5 荧光定量RT-qPCR溶解曲线及各组织转录水平表达结果Fig.5 RT-qPCR dissolution curve and expression results of transcription level in various tissues
2.4 模型精子复苏体外受精结果
将冷冻精子麦管获能培养后进行复苏。并将复苏后精子与卵丘细胞复合体进行体外培养,挑选正常的2-细胞期胚胎数并计算受精率,3次的受精率分别54.93%、67.13%、81.15%,平均受精率67.74%。随后分别移植到13只假孕鼠输卵管中,产仔率分别13.33%、16.67%、18.18%、总计出生42只幼鼠,经过PCR检测得到12只阳性小鼠,具体结果见表3。
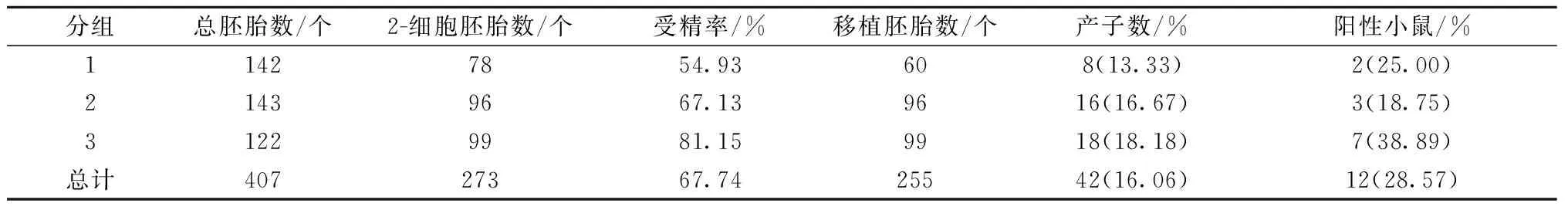
表3 精子复苏体外受精实验Table 3 Experiment of sperm resuscitation in vitro fertilization
3 讨论
近年来,癌症免疫疗法成为研究热点,以免疫检查点人源化小鼠、免疫系统人源化小鼠为基础的免疫治疗性药物开发在抗肿瘤领域取得显著进展,基于免疫治疗的新药开发成为当前肿瘤研究热点[14]。CSF1与CSF-1R信号通路与肿瘤的发生发展密切相关,因此,该靶点也是抗癌药物布局的重要方向[15-16]。目前,很多药企都开展了针对人源CSF-1R的在研药物。
人源化小鼠模型是临床前药物研究必不可少的有力工具。传统制作小鼠模型的方法是在小鼠胚胎干细胞中引入突变,然后将干细胞注射到胚囊中形成嵌合体小鼠,再经过一代才能获得纯合突变的小鼠[3],技术要求较高,操作流程长。CRISPR-Cas9系统可以更加高效且精确的实现对模式生物的基因编辑,构建特定重要基因的模型[17]。本研究利用CRISPR-Cas9技术在C57BL/6小鼠中敲入了人源CSF-1R基因,打靶载体设计时用将人源CSF-1R基因的3到11插入了小鼠的第3外显子后,成功建立了人源化CSF-1R小鼠模型。该小鼠模型能稳定传代,生长发育正常。为了保存遗传资源,本研究利用冻精技术冻存精子,保证了后期模型推广应用。
本研究选取1只7号首建雄鼠用于其后的建系繁育,获得1雄3雌的F1代小鼠。在获得阳性杂合F1鼠的基础上继续进行F2代纯合子小鼠的繁殖,希望能够获得双链插入的小鼠模型。多次繁殖交配后一共出生35只小鼠,鉴定得到22只杂合子,但无纯合子出生,怀疑纯合子致死。另外,取3.5 d囊胚进行验证,一共7枚囊胚,鉴定到4个纯合。查阅文献后也证实了这一想法[18],数据显示CSF-1R基因敲除纯合子表现出骨骼、感官和生殖异常与在破骨细胞、巨噬细胞和脑小胶质细胞中的严重缺陷有关。这一部分实验数据提示下一步可以尝试构建组织特异性的条件性基因双链插入小鼠模型,用于基于人源化模型的特异性开放式药物筛选。

