血清IL-1β、vWF、HMGB1与新生儿持续性肺动脉高压病情及预后的关系
杨海娟,段劲松,张梦华,许泽辉,梁中信,陈霞
新生儿持续性肺动脉高压(persistent pulmonary hypertension of newborn,PPHN)是以全身性持续性低氧血症为主要特征的新生儿常见重症,可引起右心肥大、扩张,最终导致右心衰竭甚至死亡[1-2]。因此,及时评估PPHN病情和预后对改善患儿预后至关重要。研究表明,炎性反应和肺内皮功能障碍参与PPHN发生发展[3-4]。白介素-1β(interleukin-1β,IL-1β)是一种促炎细胞因子,参与多种自身免疫性炎性反应活动[5]。实验发现,肺动脉高压(pulmonary hypertension,PAH)大鼠肺组织中IL-1β表达上调[6]。血管性血友病因子(von Willebrand factor,vWF)是一种能敏感反映内皮损伤的标志物,既往研究表明,高浓度vWF与PPHN肺动脉压力增加有关[7]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种高度保守的染色体结合蛋白,能结合多条信号通路诱导炎性细胞聚集[8]。目前,关于IL-1β、vWF、HMGB1与PPHN病情和预后的关系尚不明确,本研究通过检测PPHN患儿血清IL-1β、vWF、HMGB1水平,探讨三者与PPHN病情和预后的关系,以期为临床诊治PPHN提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2016年12月—2021年11月廊坊市人民医院儿一科收治PPHN患儿121例为PPHN组,其中男72例,女49例,胎龄36~42(38.38±1.08)周;体质量2.1~4.2(2.92±0.47)kg;产妇分娩方式:剖宫产75例,顺产46例。另选取同期健康新生儿44例为健康对照组,男26例,女18例,胎龄38~42(38.72±0.47)周;体质量2.6~4.4(2.97±0.32)kg;产妇分娩方式:剖宫产24例,顺产20例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(2018120),受试儿家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①PPHN符合2015年美国心脏学会和美国胸科学会儿科肺动脉高压指南中的诊断标准[9];②出生至28 d。(2)排除标准:①先天性心脏疾病、先天性高铁血红蛋白血症、严重左心发育不良等先天性疾病或发育不全;②中枢性呼吸暂停;③脑出血、肺出血倾向;④临床资料不完整;⑤合并严重肝肾功能损害;⑥合并造血、免疫系统疾病;⑦产妇孕前自身免疫性疾病、严重感染和非甾体类抗炎药物治疗史。
1.3 观测指标与方法
1.3.1 临床资料收集:收集PPHN患儿性别、胎龄、出生体质量、分娩方式、宫内窘迫、胎膜早破、羊水污染、呼吸窘迫综合征、胎粪吸入综合征发生情况、高频振荡通气使用情况、机械通气时间、一氧化氮(NO)吸入治疗相关指标(包括NO吸入时间、起始剂量、最高剂量)、氧合指数(动脉血氧分压/吸入氧浓度,采用丹麦雷杜米特ABL90 FLEX动脉血气分析仪检测)。
1.3.2 血清IL-1β、vWF、HMGB1水平检测:采集新生儿出生时脐静脉血3 ml,离心留取血清,采用酶联免疫吸附法检测IL-1β、vWF、HMGB1水平,试剂盒购自上海拓光生物科技有限公司。
1.3.3 PPHN病情程度评估:患儿采用彩色多普勒超声诊断仪(美国GE公司,型号 Voluson S6)行经胸超声心动图检查,三尖瓣反流法测定肺动脉收缩压(systolic pulmonary artery pressure,SPAP),全自动电子血压计(日本欧姆龙株式会社,HEM-7124)测定肱动脉收缩压(systolic blood pressure,SBP),计算SPAP/SBP比值。根据文献[10]将PPHN程度分为轻度(SPAP/SBP<0.5,n=37)、中度(SPAP/SBP≥0.5~<1.0,n=41)、重度(SPAP/SBP≥1.0,n=43)。
1.3.4 PPHN患儿预后评价:参考指南接受机械通气+NO吸入治疗,预后良好定义为治疗后氧合指数较基础值增加超过20 mmHg,或病情好转/治愈出院,反之为症状无改善,或放弃/死亡为预后不良[1],根据治疗结局分为预后不良亚组33例和预后良好亚组88例。
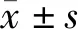
2 结 果
2.1 不同预后PPHN患儿临床资料比较 预后不良亚组宫内窘迫比例、机械通气时间、NO吸入时间、SPAP/SBP、IL-1β、vWF、HMGB1水平高于预后良好亚组,高频振荡通气比例、氧合指数低于预后良好亚组(P<0.05);2亚组患儿性别、胎龄、出生体质量、分娩方式、胎膜早破、羊水污染、呼吸窘迫综合征、胎粪吸入综合征、NO起始剂量、NO最高剂量等资料比较差异无统计学意义(P>0.05),见表1。
2.2 2组血清IL-1β、vWF、HMGB1水平比较 PPHN组血清IL-1β、vWF、HMGB1水平均高于健康对照组(P<0.01),见表2。
2.3 不同病情严重程度PPHN患儿血清IL-1β、vWF、HMGB1水平比较 轻度、中度、重度患儿血清IL-1β、vWF、HMGB1水平依次升高,差异均有统计学意义(P均<0.01),见表3。
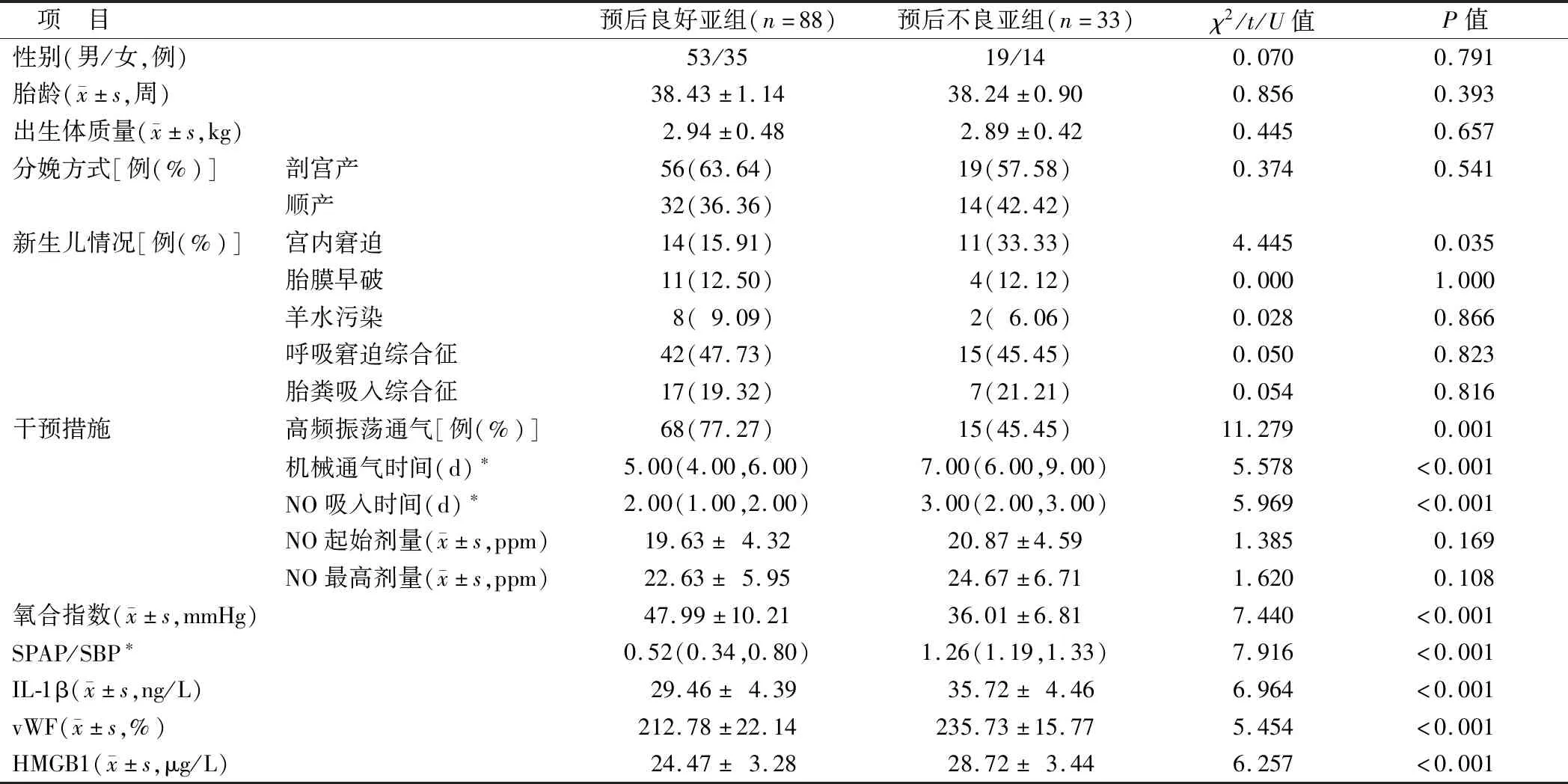
表1 不同预后PPHN患儿临床资料比较Tab.1 Comparison of clinical data of children with PPHN with different prognosis
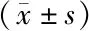
表2 健康对照组与PPHN组血清IL-1β、vWF、HMGB1水平比较Tab.2 Comparison of serum IL-1β, vWF, HMGB1 levels between healthy control group and PPHN group
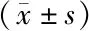
表3 不同病情严重程度PPHN患儿血清IL-1β、vWF、HMGB1水平比较Tab.3 Comparison of serum levels of IL-1β, vWF and HMGB1 in children with PPHN of different disease severity
2.4 血清IL-1β、vWF、HMGB1水平与SPAP/SBP的相关性 121例PPHN患儿SPAP/SBP为0.68(0.37,1.20),Spearman相关性分析显示,PPHN患儿血清IL-1β、vWF、HMGB1水平与SPAP/SBP均呈正相关(rs=0.644、0.673、0.616,P均<0.001)。
2.5 PPHN患儿预后不良的多因素Logistic回归分析 以PPHN患儿预后(不良=1,良好=0)为因变量,以宫内窘迫(有=1,无=0)、高频振荡通气(是=1,否=0)、机械通气时间、NO吸入时间、氧合指数、SPAP/SBP、IL-1β、vWF、HMGB1为自变量,多因素Logistic回归分析显示,应用高频振荡通气、氧合指数高为PPHN患儿预后不良的独立保护因素,机械通气时间长、NO吸入时间长、SPAP/SBP高、IL-1β高、vWF高、HMGB1高为其独立危险因素(P<0.05),见表4。
2.6 血清IL-1β、vWF、HMGB1水平对PPHN患儿预后不良的预测价值 ROC曲线分析显示,血清IL-1β、vWF、HMGB1水平及三项联合预测PPHN患儿预后不良的AUC分别为0.764、0.763、0.782、0.907,三项联合预测价值大于各指标单独预测(Z/P=3.938/<0.001、3.535/<0.001、3.093/0.002),见表5、图1。
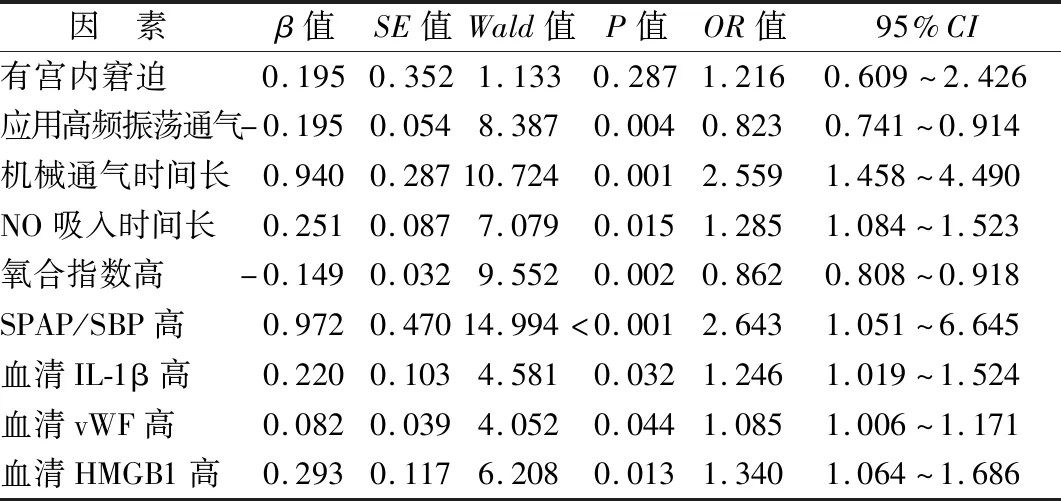
表4 PPHN患儿预后不良的多因素Logistic回归分析Tab.4 Multivariate logistic regression analysis of poor prognosis in children with PPHN
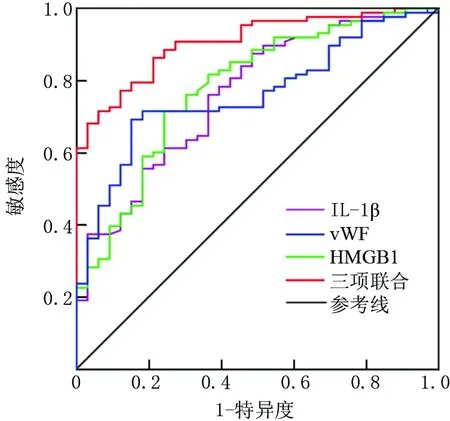
图1 血清IL-1β、vWF、HMGB1水平预测PPHN患儿预后不良的ROC曲线Fig.1 Serum IL-1β, vWF, HMGB1 levels predict poor prognosis in children with PPHN ROC curve
3 讨 论
PPHN是指出生后肺血管阻力持续性增高引起胎儿型循环向成人型循环过渡障碍,而导致的心房和/或动脉导管水平血液的右向左分流,临床出现严重低氧血症等症状,尽管近年来随着NO吸入治疗的发展,PPHN患儿生存率得以提升,但PPHN仍然是新生儿重症监护室最为凶险的疾病之一[11]。深入研究PPHN相关的生物标志物不仅有利于指导临床进行个体化治疗,促进预后改善,还有助于开发治疗和预防疗法。
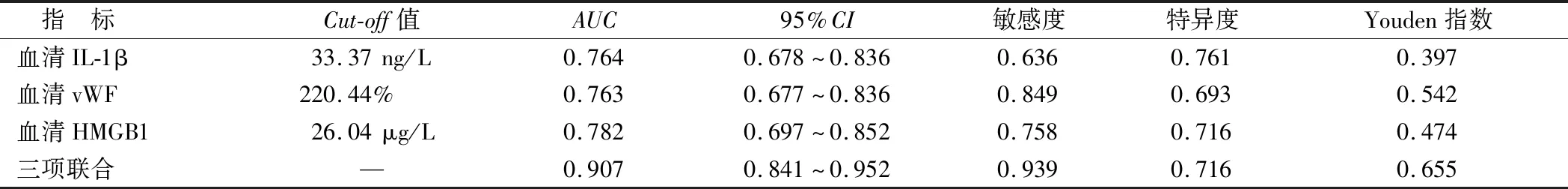
表5 血清IL-1β、vWF、HMGB1水平对PPHN患儿预后不良的预测价值Tab.5 The predictive value of serum IL-1β, vWF and HMGB1 levels in poor prognosis of children with PPHN
低氧所致的PAH是一类由肺间质或实质长期破坏、缺氧而继发的肺血管床损害,其病理生理学机制涉及高凝状态、血管内皮和平滑肌功能障碍、低氧相关肺血管收缩/重塑等多个环节[2]。研究发现,广泛的炎性细胞因子调节异常可引起并加重肺血管平滑肌细胞异常收缩和增殖重塑,说明炎性反应与PAH密切相关[12]。临床实践中也发现,PAH往往继发于系统性硬化症、系统性红斑狼疮等系统性炎性疾病[13-14]。IL-1是T淋巴细胞、B淋巴细胞、自然杀伤细胞、中性粒细胞、巨噬细胞等几乎所有有核细胞分泌的一种炎性细胞因子,IL-1β是IL-1家族最典型的多功能性细胞因子,主要由活化的单核巨噬细胞产生,能通过下游机制协调免疫反应,参与多种自身免疫性炎性反应[4]。研究表明,炎性小体在PAH中被激活,其介导的炎性反应在PAH过程中至关重要,能通过控制不受调节的IL-1β释放多种炎性因子,参与PAH过程[15]。动物实验也发现,IL-1β在PAH大鼠肺组织中高表达,抑制IL-1β表达能减轻PAH发生发展[16]。本研究结果显示,PPHN患儿血清IL-1β水平升高,并随着PPHN病情加重而升高,说明血清IL-1β水平升高与PPHN病情密切相关,考虑是IL-1β作为早期炎性因子能与其他炎性介质构成复杂的炎性反应网络,刺激血管平滑肌细胞异常收缩和增殖重塑,促进PAH发生发展[17]。本研究结果还显示,血清IL-1β水平升高是PPHN患儿预后不良的独立危险因素,分析是血清IL-1β水平越高反映PPHN患儿肺血管重塑越严重,进一步增加肺血管阻力导致致命的呼吸和循环衰竭风险,因此预后更差。
肺内皮功能障碍在PAH发病机制中发挥重要作用,尽管目前尚不完全明确PAH中内皮病理表型的动态调节情况,但目前研究证实,炎性反应、氧化应激等各种原因所致的肺血管内皮细胞损伤能通过与其他细胞串扰导致闭塞性肺血管重塑,进而参与PAH发生发展[18-19]。vWF以多聚体形式储存于内皮细胞和血小板中,在炎性反应、氧化应激等引起损伤时从内皮细胞和血小板中释放,并通过介导血小板黏附和聚集参与凝血过程,因此vWF被认为是反映内皮功能障碍和凝血的标志[20]。实验发现,vWF在PAH大鼠肺组织中高表达,vWF低表达与PAH大鼠病情改善有关[21]。最近一项关于PPHN患儿vWF动态变化的研究也发现,vWF水平与PPHN患儿肺动脉压力程度相关[7]。然而关于vWF水平与PPHN患儿病情和预后的关系尚无研究报道。本研究结果显示,PPHN患儿血清vWF水平升高且与PPHN病情密切相关,分析是PPHN患儿因缺氧导致内皮细胞损伤引起vWF大量释放,通过促进血小板黏附和聚集增加血液黏稠度,进而增加肺血管阻力,导致肺动脉压力进一步升高[22-23]。本研究结果还显示,血清vWF水平升高是PPHN患儿预后不良的独立危险因素,分析与血清vWF水平越高反映PPHN患儿肺动脉压力越高,预后越差有关。
HMGB1几乎在所有真核细胞的细胞核中存在,由死亡细胞被动释放到胞外,胞外HMGB1能结合Toll样受体4和晚期糖基化终产物受体产生核因子-κB,形成炎性反应通路,加剧组织炎性损伤,同时作为炎性反应网络的核心成分,HMGB1 还可以调节其他炎性细胞因子的分泌,是公认的晚期炎性介质[8]。实验通过缺氧诱导大鼠PPHN发现,HMGB1在模型构建成功后大量表达,并直接参与肺血管内皮细胞损伤,促进肺血管重塑[24]。另一项实验发现,下调HMGB1表达能显著减轻PAH大鼠肺动脉内皮细胞损伤和氧化应激[25]。临床研究也发现,PPHN患儿血清HMGB1水平升高,并与PPHN患儿血气指标和心功能降低密切相关[26]。本研究结果显示,PPHN患儿血清HMGB1水平升高,与既往研究报道一致[26]。进一步分析发现,PPHN患儿血清HMGB1水平随着病情加重而升高,说明血清HMGB1水平升高与PPHN病情密切相关,分析是HMGB1作为晚期炎性介质在炎性反应中处于中心地位,HMGB1表达上调能激活更多炎性细胞因子表达,促进肺血管细胞损伤和肺血管重塑,增加肺血管阻力[27]。本研究结果还显示,血清HMGB1水平升高是PPHN患儿预后不良的独立危险因素,考虑与血清HMGB1水平越高PPHN患儿肺动脉压力越高有关。同时随着HMGB1表达上调,HMGB1还能通过激活Caspase级联反应,诱导肺血管细胞凋亡,进一步加重肺血管闭塞,导致预后不良[25,28]。本研究结果还显示,高频振荡通气、氧合指数、机械通气时间、NO吸入时间、SPAP/SBP也能独立影响PPHN患儿预后,分析如下:高频振荡通气是一种新型的通气治疗方式,能显著改善肺通气、肺换气和氧合功能,有研究认为,高频振荡通气+NO吸入治疗可能是PPHN患儿更好的治疗选择[29-30]。氧合指数直接反映了PPHN患儿低氧程度,氧合指数越低说明PPHN患儿低血氧症越严重,因此预后越差。机械通气时间和NO吸入时间越长间接反映PPHN患儿病情越危重,需要更长时间的机械通气和NO吸入,因此预后更差。SPAP/SBP是评估PPHN肺动脉高压严重程度的指标,SPAP/SBP越高PPHN患儿病情越危重,预后越差[31]。本研究ROC曲线分析显示,血清IL-1β、vWF、HMGB1水平单独与联合预测PPHN患儿预后不良的AUC分别为0.764、0.763、0.782、0.907,三项联合预测的AUC大于各指标单独预测,说明血清IL-1β、vWF、HMGB1水平均可作为PPHN患儿预后不良的辅助预测指标,且联合检测能提升PPHN患儿预后不良的预测价值,更好指导临床制定个体化治疗方案。
综上所述,PPHN患儿血清IL-1β、vWF、HMGB1水平升高,与PPHN病情严重程度和预后密切相关,可能成为PPHN患儿病情和预后评估的生物标志物。但本研究样本量较少,还需多中心大样本研究进一步证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
杨海娟、张梦华:设计研究方案,实施研究过程,论文撰写;段劲松:实施研究过程,资料搜集整理;许泽辉、梁中信、陈霞:提出研究思路,分析试验数据,论文审核

