连续血液净化对脓毒症患儿血清肌钙蛋白、纤维蛋白原及炎性因子表达的影响
汤文,许慧,黄成姣,李勇,肖书娜,石步云,夏治
脓毒症是由感染引起的全身炎性反应综合征,发病率高,是严重创伤、烧伤、感染等患儿的常见并发症,儿童因机体抵抗力较弱,严重者可造成器官功能障碍,甚至死亡,故临床上需予以充分重视,及时采取有效措施进行治疗[1]。但目前,单纯抗感染治疗并不能有效逆转脓毒症病理进程,应考虑结合其他治疗方式以增强疗效。连续血液净化(continuous blood purification,CBP)是持续清除循环中毒素、中大分子物质的技术,其中连续性静脉—静脉血液滤过(continuous veno-venous hemofiltration,CVVH)模式具有对循环干扰小且对炎性介质清除率较高等优点,已广泛用于治疗脓毒症,可对患者病情起到一定改善作用[2-4]。由于血清肌钙蛋白(troponin,Tn)、纤维蛋白原(fibrinogen,Fib)分别作为心肌标志物及凝血标志物,其水平变化与脓毒症患者病情严重程度及预后密切相关[5-6]。而CBP能明显降低感染所致急性肾衰竭患者的血清白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子水平[7]。因此,现观察CBP对脓毒症患儿血清Tn、Fib及炎性因子表达的影响,以期为脓毒症患儿的治疗提供一定科学依据,报道如下。
1 资料与方法
1.1 临床资料 选取2014年8月—2019年8月湖北省妇幼保健院儿童重症医学科诊治脓毒症患儿260例,以随机数字表法分为观察组和对照组各130例。观察组男81例,女49例,年龄(5.27±1.62)岁;尿量(709.39±47.95)ml/d;体质量(15.42±2.62)kg;原发病:严重创伤感染49例,肺部感染45例,胃肠道感染36例。对照组男79例,女51例,年龄(5.42±1.65)岁;尿量(712.08±63.08)ml/d;体质量(15.37±2.49)kg;原发病:严重创伤感染51例,肺部感染40例,胃肠道感染39例。2组临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院道德伦理委员会批准通过(2014-0509),符合《世界医学协会赫尔辛基宣言》,患儿家属对本研究知情同意并签订知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合国际严重脓毒症诊治指南[8]中相关诊断标准,出现体温升高、心率异常、炎性指标过高、淋巴细胞减少、器官功能障碍指标异常、血肌酐异常、急性少尿、意识障碍等,且小儿危重病例评分≤80分;②院外未接受自主治疗。(2)排除标准:①具有长期免疫抑制剂服药史患儿;②具有凝血功能障碍、血液系统疾病及出血性疾病等严重循环系统疾病、肝功能不全及恶性肿瘤患儿;③合并慢性肾功能障碍、遗传代谢疾病患儿;④合并自身免疫性疾病患儿。
1.3 治疗方法 对照组患儿给予常规治疗:机械通气、抗感染、营养支持,并积极治疗原发病,调节水电解质平衡。观察组患儿在对照组治疗基础上给予CBP治疗:采用CVVH模式进行,根据患儿年龄选择7~11 F双腔留置引流管(型号 GDK-612,Gambro Gamcath公司),血流量200~220 ml/min,普通肝素抗凝,根据凝血功能监测结果进行动态调整,24 h更换1次滤器(型号 M60,Gambro prisma公司),每天8~24 h。治疗期间,严密监测患儿心率、呼吸、血压等生命体征指标及出凝血情况;其中滤器中ACT需维持为80~220 s,根据凝血功能指标变化及有无出血倾向调整肝素剂量。首剂肝素剂量为20~50 IU/kg,维持量为 5~20 IU·kg-1·h-1。均连续治疗3 d。
1.4 观察指标及方法
1.4.1 心肌标志物检测:所有患儿均于治疗前、治疗3 d后采集空腹静脉血5 ml,离心(转速为3 000 r/min)15 min后留取上层血清,-80℃冰箱储存备用。采用免疫分析仪(型号 ARCHITECTi2000SR,美国雅培公司)检测血清心肌肌钙蛋白I(cardiac troponin-I,cTnI)、cTnT水平,cTnI、cTnT试剂盒均购自上海羽哚生物科技有限公司。
1.4.2 凝血指标检测:采用全自动血凝仪(型号 C2000-A,上海寰熙医疗器械有限公司)测定Fib、激活全血凝固时间(activated clotting time,ACT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT),试剂盒购自上海羽哚生物科技有限公司。
1.4.3 炎性指标检测:上述血清采用免疫比浊法测定血清C-反应蛋白(C-reactive protein,CRP)水平,试剂盒购自上海沪震实业有限公司;酶联免疫吸附(ELISA)法检测血清IL-6、TNF-α水平,IL-6、TNF-α试剂盒均购自上海远慕生物科技有限公司。
1.4.4 免疫指标检测:采用流式细胞分析仪(型号 EPICS X,美国Beckman公司)检测CD3+、CD4+、CD8+T淋巴细胞亚群百分比。
1.4.5 肾功能指标检测:采用酶法测定肌酐(SCr)、尿素氮(BUN)水平,采用干化学法检测钾离子(K+)水平,试剂盒均购自上海羽哚生物科技有限公司。
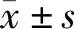
2 结 果
2.1 2组治疗前后血清cTnI、cTnT及Fib表达水平比较 治疗前,2组cTnI、cTnT及Fib水平比较,差异均无统计学意义(P>0.05);治疗3 d后,2组cTnI、cTnT及Fib水平均较治疗前降低,且观察组显著低于对照组(P均<0.01),见表1。
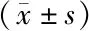
表1 对照组与观察组治疗前后cTnI、cTnT、Fib表达水平比较Tab.1 Comparison of the expression levels of cTnI, cTnT and Fib between the control group and the observation group before and after treatment
2.2 2组治疗前后ACT、APTT、PT水平比较 治疗前后,2组ACT、APTT、PT比较,差异均无统计学意义(P>0.05),见表2。
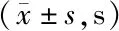
表2 对照组与观察组治疗前后ACT、APTT、PT水平比较Tab.2 Comparison of ACT, APTT, PT levels between control group and observation group before and after treatment
2.3 2组治疗前后血清炎性因子比较 治疗前,2组血清IL-6、TNF-α及CRP水平比较,差异无统计学意义(P>0.05);治疗3 d后,2组IL-6、TNF-α及CRP水平均降低,且观察组低于对照组(P<0.01),见表3。
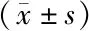
表3 对照组与观察组治疗前后血清炎性因子水平比较Tab.3 Comparison of serum inflammatory factor levels between control group and observation group before and after treatment
2.4 2组治疗前后细胞免疫功能比较 治疗前,2组CD3+、CD4+、CD8+T细胞亚群百分比比较,差异无统计学意义(P>0.05);治疗3 d后,2组上述指标均升高,且观察组高于对照组(P<0.01),见表4。

表4 对照组与观察组治疗前后细胞免疫功能比较Tab.4 Comparison of cellular immune function between control group and observation group before and after treatment
2.5 2组治疗前后肾功能指标比较 治疗前,2组血清BUN、SCr及K+水平比较,差异无统计学意义(P>0.05);治疗3 d后,2组血清BUN、SCr及K+水平均降低,且观察组低于对照组(P<0.01),见表5。
3 讨 论
脓毒症发病机制与炎性反应、免疫功能及凝血功能紊乱等有关,脓毒症患者体内出现过度炎性反应,凝血级联反应进而被激活,且同时存在不同程度的免疫功能紊乱,T细胞亚群表现为免疫抑制状态。因此,调节炎性因子、促进免疫平衡成为治疗关键[9-10]。CBP能够维持血流动力学稳定,恢复内皮细胞功能,进而改善器官功能,已逐渐应用于脓毒症的治疗[11-12]。
CRP能够反映体内的炎性反应状态,用于脓毒症的诊断敏感度高。IL-6是典型的促炎因子,在CRP诱导下大量产生,形成炎性级联反应。IL-6、TNF-α又可调节CRP合成,在脓毒症发生发展中承担重要角色[13]。本研究结果显示,CBP治疗能显著降低脓毒症患儿IL-6、TNF-α及CRP水平,与朱长亮等[14]研究结果相似,提示CBP能够快速降低血液中炎性介质的浓度,进而控制血液中的炎性反应。原因可能为:CBP治疗可通过较强的吸附作用和对流作用清除大分子物质,更有利于降低炎性因子的浓度。机体发生炎性反应,则会影响患儿的细胞免疫功能,CD3+为全血成熟T淋巴细胞,CD4+能够调节机体免疫功能,CD8+可杀伤相应靶细胞[15]。本研究结果显示,治疗后观察组患儿T细胞亚群CD3+、CD4+、CD8+百分比显著高于对照组,提示CBP治疗可清除血液中大量的炎性介质,在一定程度上提高脓毒症患儿的免疫功能,促进细胞免疫功能的恢复,与刘柯等[16]研究结果相似。此外,本研究发现,治疗后观察组BUN、SCr、K+水平均显著低于对照组,表明CBP对BUN、SCr、K+等小分子也有较好的清除效果,可改善患儿的血生化指标,与陈琨等[17]研究结果一致。
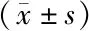
表5 对照组与观察组治疗前后BUN、SCr及K+比较Tab.5 Comparison of BUN, SCr and K+ in control group and observation group before and after treatment
血清Tn是肌肉组织收缩的调节蛋白,cTn是心肌肌肉收缩的调节蛋白,脓毒症累及心肌损伤早期,cTnI、cTnT释放入血,是诊断心肌损伤的生物学指标,可作为预测脓毒症患者心肌功能障碍的标志物[18]。陈维[19]和张寒钰等[20]研究表明,血清中cTn水平升高可反映心肌受损。本研究结果显示,CBP治疗能够显著降低脓毒症患儿cTnI、cTnT水平,提示与常规治疗相比,CBP治疗能够明显改善患儿的心肌损伤。Fib是一种由肝脏合成的蛋白质,具有凝血功能,被认为是疾病状态的标志物,其形成和降解可导致微循环血栓形成,进一步加重组织器官损伤,Fib水平升高是机体高凝状态的标志[21]。曹广科等[22]研究表明,CBP联合血必净治疗可以显著改善脓毒症患者的凝血功能。本研究结果显示,与常规治疗方案相比,CBP治疗能够显著降低脓毒症患儿Fib水平,提示CBP能够在一定程度上减轻和抑制脓毒症患儿的高凝状态,有效恢复凝血功能,进而改善患儿机体的凝血功能。此外,本研究发现,CBP患儿肝素治疗后ACT均维持在有效的抗凝范围内,且APTT、PT并没有明显延长,均顺利完成CBP治疗。
综上所述,CBP治疗能够显著降低脓毒症患儿血清cTnI、cTnT、Fib水平,降低炎性反应因子,改善凝血和细胞免疫功能,具有较好的临床应用价值。本研究存在一定局限性,如样本量少,且在患儿治疗过程中未对肾功能指标和尿量进行实时监测,仅比较了治疗前后患儿肾功能指标变化,将在以后研究中补充。
利益冲突:所有作者声明无利益冲突
作者贡献声明
汤文:提出研究方向,设计研究方案,撰写论文;许慧:设计研究方案、试验流程;黄成姣、肖书娜:进行统计学分析,论文修改;李勇、石步云:实施研究过程,资料收集整理;夏治:进行文献调研和整理,分析试验数据,论文审核

