NFE2L2对宫颈癌细胞系糖酵解关键酶及侵袭迁移的作用
哈提拉·吐尔逊,李金秋,艾力菲热·加帕尔,文智颖,阿仙姑·哈斯木
(1 新疆医科大学基础医学院病理教研室,新疆地方病分子生物学重点实验室,乌鲁木齐 830054;2 新疆医科大学第五临床医学院临床医学院;3 新疆医科大学基础医学院,新疆地方病分子生物学重点实验室;* 通讯作者,E-mail:axiangu75@126.com)
子宫颈癌(cervical cancer,CC)是女性常见的恶性肿瘤之一,来源于子宫颈的上皮组织,近几年宫颈癌的发病率与死亡率仍然较高,危害着女性的生命与健康[1]。肿瘤细胞需要消耗大量原料和能量来达到恶性增殖的特性,从而肿瘤的代谢发生改变。本课题组前期对宫颈癌患者进行代谢组学和差异基因的筛选研究中发现,糖酵解代谢途径相关代谢物和核因子E2相关因子2(nuclear factor erythroid 2-related factor,NFE2L2)与宫颈癌进展表现出显著相关性,但具体调控机制不明。NFE2L2作为重要的保护性转录因子,在正常细胞条件下,响应氧化应激应答,并起调控作用[2],在肿瘤细胞中,异常活跃的NFE2L2通过调控细胞内一系列重要的代谢过程,使肿瘤细胞抗氧化能力增强,促进各类肿瘤的侵袭转移。而恶性肿瘤糖酵解代谢水平的高低与糖酵解限速酶的表达水平及活性高低有关。己糖激酶(hexokinase,HK)、乳酸脱氢酶(lactate dehydroge-nase,LDHA)作为限速酶在糖代谢中发挥重要作用。有研究表明,肿瘤细胞不同程度地利用转录因子微调细胞代谢以满足快速肿瘤细胞增殖的需求[3]。为阐明宫颈癌中糖代谢的变化是如何影响宫颈癌的发展,本实验探讨了NFE2L2与糖酵解关键酶HK-1、LDHA的关系,及其对宫颈癌SiHa细胞和C33a细胞迁移、侵袭的影响。
1 材料与方法
1.1 主要试剂与仪器
试剂:宫颈癌细胞系SiHa、C33a(购于武汉普诺赛生命科技有限公司),DMEN高糖细胞培养液、0.25%胰蛋白酶、胎牛血清FBS(均购于美国Hyclone公司),青霉素链霉素双抗(购于北京博奥森生物技术有限公司),NFE2L2鼠抗人多克隆抗体(购于美国Abcam公司),LDHA、HK1抗体(购于美国Abcam公司)。
仪器:酶标仪、蛋白转膜仪(均来自上海伯乐生命医学产品有限公司Bio-Rad Laboratories),Transwell小室(美国康宁公司Corning Incorporated)。
1.2 方法
1.2.1 细胞培养、转染、分组 复苏宫颈癌细胞系SiHa、C33a置于培养瓶,放入37 ℃、5% CO2培养箱中培养。3~5 d传代一次。
转染前24 h将SiHa、C33a细胞按2×104个/孔细胞数种植于6孔板中。次日加适量的病毒悬液,同时制备NFE2L2基因过表达转染SiHa细胞作为SiHa高表达组,空载慢病毒转染的SiHa作为对照组。NFE2L2 siRNA转染C33a细胞作为C33a低表达组,空载慢病毒转染的C33a作为对照组。经过Western blot验证转染效果后进行后续HK-1、LDHA蛋白表达量的检测,Transwell进行细胞迁移、侵袭能力的检测。
1.2.2 Western blot法检测NFE2L2、HK-1、LDHA的表达 取对数生长期细胞,加入RIPA细胞裂解液100 μl,及1 μl PMSF充分混匀,冰上裂解30 min,离心(12 000 r/min),20 min。按照BCA蛋白定量试剂盒提取宫颈癌细胞总蛋白。每孔上样SiHa、C33a细胞蛋白15 μl进行电泳,100 V 45 min,再至PVDF膜,用含5%脱脂奶粉的封闭膜2 h,一抗摇床孵育过夜(NFE2L2的抗体稀释比为1∶1 000,HK-1的抗体稀释比为1∶500,LDHA的抗体稀释比为1∶500)。次日滴加二抗孵育1 h后AP显色。用化学发光仪检测、拍照,计算蛋白的密度值及表达丰度。
1.2.3 Transwell检测NFE2L2迁移、侵袭的能力 Matrigel基质胶置于4 ℃过夜融化,将Matrigel基质胶与高糖细胞培养液按比例(1∶8)混匀配置,侵袭实验小室铺胶、迁移实验不铺胶。待细胞培养至对数生长期时,胰酶消化宫颈癌细胞,用无血清及双抗的培养基悬浮细胞,将细胞浓度调整为5×104/ml。上室加入200 μl细胞悬液,下室加600 μl含10%血清的培养基,37 ℃培育24 h。次日4%多聚甲醛固定30 min、0.1%结晶紫染色30 min,显微镜下随机挑取5个视野计算穿过膜的细胞数,统计结果。
1.3 统计学处理
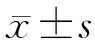
2 结果
2.1 NFE2L2在宫颈癌细胞系SiHa、C33a的蛋白表达
Western blot检测结果显示,在宫颈癌细胞系SiHa、C33a细胞中NFE2L2蛋白表达量分别为0.29 ±0.07和0.63 ±0.05。与SiHa细胞相比,NFE2L2蛋白表达量在C33a细胞相对高(见图1),因此NFE2L2过表达慢病毒用于转染SiHa细胞,而低表达NFE2L2慢病毒转染C33a细胞。
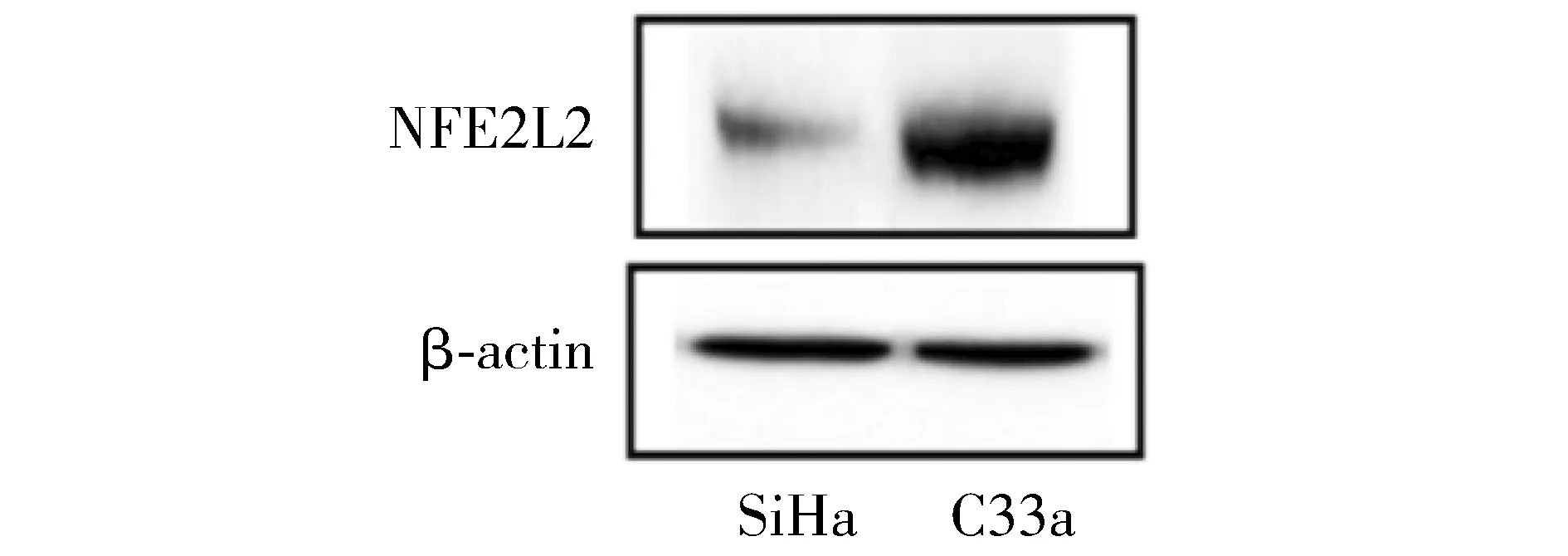
图1 Western blot检测SiHa、C33a中NFE2L2的本底表达Figure 1 Expression of NFE2L2 in SiHa and C33a cells by Western blot
2.2 Western blot检测NFE2L2高表达SiHa中NFE2L2、LDHA、HK-1的蛋白表达
Western blot检测结果显示,宫颈癌SiHa细胞转染NFE2L2高表达慢病毒后,NFE2L2高表达组中NFE2L2、HK-1和LDHA蛋白的表达量高于对照组,差异均有统计学意义(P<0.05,见图2)。
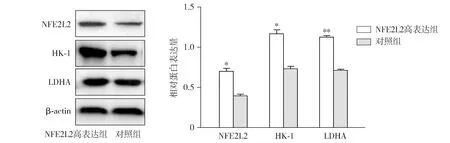
与对照组相比,* P <0.05,* * P <0.01
2.3 Western blot检测NFE2L2低表达C33a中NFE2L2、LDHA、HK-1的蛋白表达
宫颈癌C33a细胞转染NFE2L2低表达慢病毒后,Western blot检测结果显示,NFE2L2低表达组中NFE2L2、HK-1和LDHA的蛋白表达量低于对照组,差异均有统计学意义(P<0.05,见图3)。

与对照组相比,* P <0.05
2.4 NFE2L2促进宫颈癌细胞迁移能力
Transwell实验结果显示,在迁移实验中,与对照组相比,NFE2L2高表达组SiHa细胞迁移数目增加(P<0.05);与对照组相比,NFE2L2低表达组C33a细胞迁移数目减少(P<0.05,见图4)。
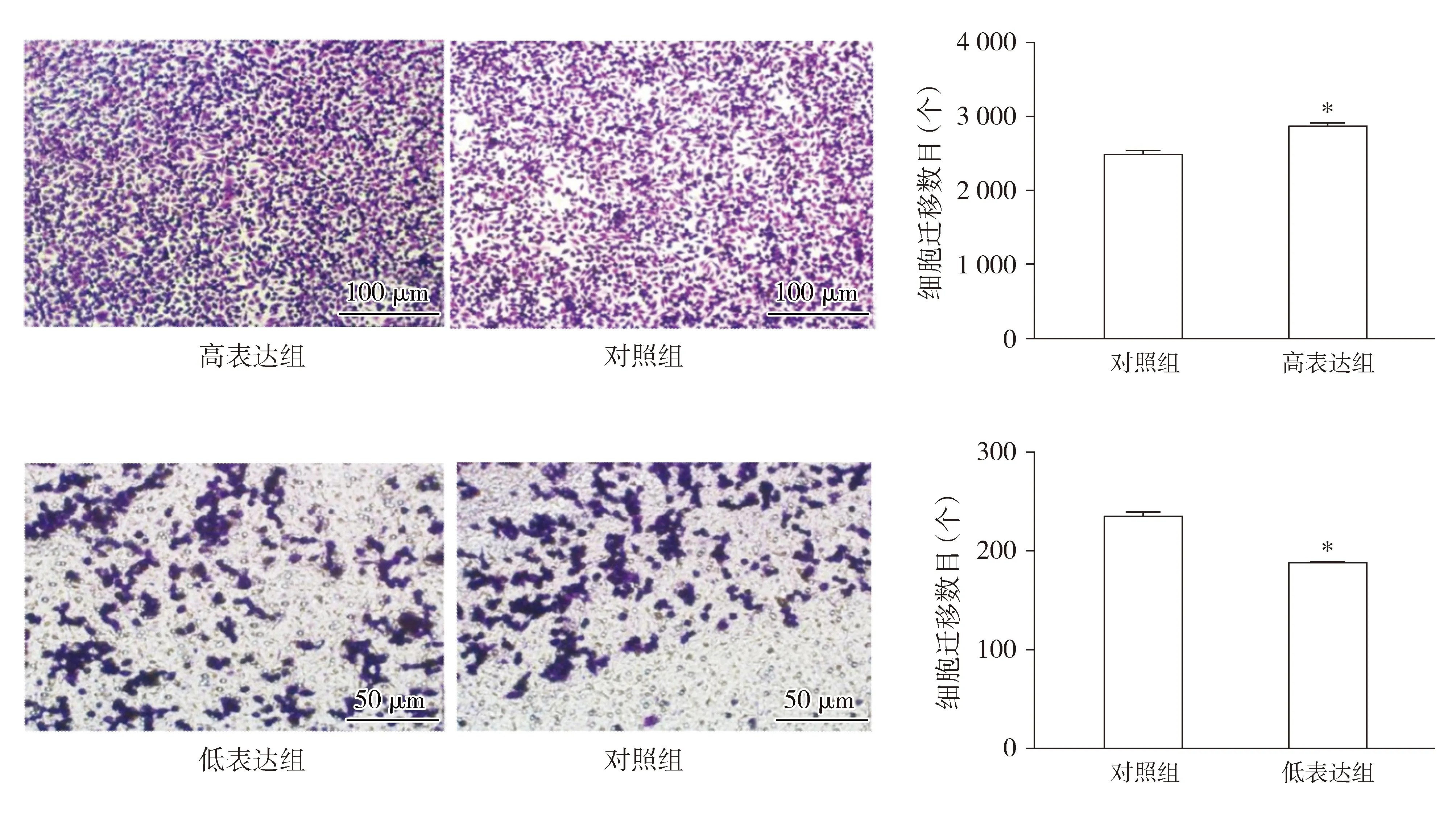
与对照组相比,* P <0.05
2.5 NFE2L2促进宫颈癌细胞侵袭能力
在侵袭实验中,与对照组相比,NFE2L2高表达组SiHa细胞侵袭数目增加,差异均有统计学意义(P<0.05)。与对照组相比,NFE2L2低表达组C33a细胞侵袭数目减少,差异均有统计学意义(P<0.05,见图5)。
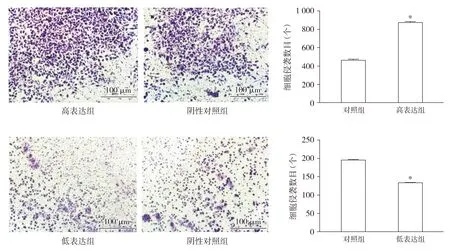
与对照组相比,* P <0.05
3 讨论
宫颈癌作为女性第四大恶性肿瘤严重危害女性身心健康。NFE2L2[4]是1994年被发现的CNC亮氨酸拉链转录激活因子(CNC basic leucine zipper,CNC-bZIP)家族的成员之一。研究表明,NFE2L2在多种肿瘤中呈现高表达,NFE2L2可以通过调控多种信号途径参与肿瘤的转移、侵袭、凋亡等行为。Jin等[5]研究发现NFE2L2上调可激活Notch1信号转导途径促进肝癌细胞的侵袭并导致患者预后不良。Pan等[6]研究发现在脑胶质瘤细胞中NFE2L2的上调导致MMP9表达和活性的增加,即NFE2L2通过增加MMP2的表达和活性增强肿瘤的侵袭性。在肝癌中NFE2L2通过增加MMP2的表达和活性增强肿瘤的侵袭性。本研究显示NFE2L2在宫颈癌中高表达,与文献一致[7]。本研究通过细胞转染技术,对人宫颈癌SiHa细胞、C33a细胞株分别转染NFE2L2高表达和NFE2L2低表达慢病毒,Transwell检测结果发现,上调NFE2L2后宫颈癌SiHa细胞株侵袭和迁移能力明显提高;而下调NFE2L2后宫颈癌C33a细胞株迁移和侵袭能力明显下降,与上述文献一致。提示NFE2L2参与宫颈癌的侵袭、迁移。结合上述NFE2L2在不同肿瘤中的研究推测其也可能通过上调MMPs的表达降解细胞外基质使宫颈癌细胞更具侵袭性,而特异性地抑制NFE2L2可以降低宫颈癌细胞的侵袭性。
通常恶性肿瘤需要消耗大量的原料和能量来为增殖提供条件,这是肿瘤的基本特征,为了调整能量短缺状态,肿瘤细胞会通过代谢模式来做特定改变。肿瘤细胞代谢模式与正常细胞不同,当正常细胞缺氧时会采用糖酵解通路来为自身提供能量。而大多数肿瘤细胞即使在有氧条件下也会采用产能效率较低的糖酵解途径为自身供能,这一现象被称为Warburg效应[8]。而这个过程是由癌基因激活、抑癌基因失活直接调节主导下发生重编程,主要是通过直接作用于代谢酶或通过一些胞内信号传导,从而影响细胞代谢[9]。目的是可以获得必要的能量供应,更为重要的是通过生物大分子合成实现肿瘤细胞的快速增殖[10]。同时,肿瘤细胞代谢再编排还可以为肿瘤细胞的侵袭转移、逃避免疫和抑制细胞凋亡提供相应的微环境。
在既往研究中,我们通过对宫颈癌患者代谢组学研究筛选出了特异的血浆代谢物,发现患者糖酵解、脂肪酸、氨基酸和核苷酸代谢紊乱,可间接地反映肿瘤组织能量代谢失调,肿瘤细胞基因表达及代谢调控异常[11]。因此只有了解宫颈癌基因表达调控网络与肿瘤代谢重编排,才能对宫颈癌的机制及发病特点有更全面的了解。研究表明NFE2L2在各种癌症中调节其肿瘤代谢。葡萄糖代谢的第一步是己糖激酶(HK)催化,在己糖激酶异构体中,己糖激酶1(HK1)和己糖激酶2(HK2)是线粒体相关的、高亲和力的己糖激酶,它们结合氧化磷酸化和糖酵解[12]。Norifumi等[13]研究发现在过表达NFE2L2的细胞HK mRNA表达量较高,且NFE2L2与葡萄糖代谢有关。在宫颈癌糖代谢的一些文献中,LDHA对肿瘤微环境及肿瘤的进展、转移都有重要的影响[14]。LDHA活性的增加也会同时增加乳酸的生成,使乳酸在细胞外环境中的增多,致使细胞外基质的重新排列,从而促进肿瘤细胞的侵袭性[15]。本次实验Western blot结果发现,随着NFE2L2水平的增加,细胞内糖酵解关键酶HK-1、LDHA也相应增加,与文献一致,提示NFE2L2可能通过促进糖酵解来影响宫颈癌的发生发展。
以上结果提示NFE2L2参与宫颈癌细胞内糖酵解的过程,并对宫颈癌细胞SiHa、C33a细胞的侵袭迁移有一定影响,那么我们是否可以通过抑制NFE2L2水平来降低宫颈癌细胞的糖酵解进程,从而达到抑制肿瘤的生长。对于NFE2L2在宫颈癌细胞中的具体作用机制,以及其在宫颈癌预后方面的作用,尚需进一步的研究。临床研究和实践证明,肿瘤是否发生了侵袭转移是临床治疗的关键,因此开展NFE2L2调控与宫颈癌细胞糖酵解的关系研究,明确异常Warburg效应对宫颈癌细胞迁移和侵袭过程的影响,对揭示宫颈癌发病的分子机制非常必要。

