TNNT1在骨肉瘤中的表达及其对HOS细胞增殖和迁移的影响
赵敏超,郭 栋,杨于冰,张成义,李嘉熙,李家良,李 杰,李浩鹏,常素娥
(西安交通大学第二附属医院骨二科,西安 710004;* 通讯作者,E-mail:suechang@xjtu.edu.cn;# 通讯作者,E-mail:lhp-3993@163.com)
骨肉瘤(osteosarcoma,OS)是儿童和青少年最常见的恶性骨肿瘤[1]。目前OS的临床治疗方案包括广泛手术切除和放化疗等[2]。OS有很高的局部浸润和早期转移倾向,最常转移至肺[3]。大约68%的局限性OS患者存活5年或更长时间,但不幸的是,20%~30%为转移或复发病例[4]。目前OS的致病因素尚不清楚。探讨骨肉瘤发生、发展的分子机制,对于骨肉瘤的诊断、治疗和预后有着重要意义。
探索在OS中起作用的基因将有助于确定转移的发病机制并实现新的靶向治疗方向。一些癌基因和抑癌基因在骨肉瘤组织和细胞中异常表达,从而对细胞的增殖、黏附、侵袭、凋亡和转移等功能产生影响[5]。深入研究基因在骨肉瘤的分子机制有助于了解骨肉瘤的发病机制,为骨肉瘤患者的诊治提供靶向治疗方法[6]。肌钙蛋白T1(troponin T1,TNNT1)编码的蛋白是肌钙蛋白的一个亚基,是位于肌节丝上的一种调节复合体,TNNT1可能参与肌动蛋白和肌球蛋白的相互作用,从而调节细胞的迁移和侵袭[7,8]。有研究显示,横纹肌肉瘤的恶性生物学行为可能与TNNT1的表达有关[9]。但TNNT1在骨肉瘤中的作用尚不明确,本研究基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和高通量基因表达数据库(Gene Expression Omnibus,GEO)发现TNNT1在骨肉瘤细胞中异常表达,并进一步探讨了TNNT1对骨肉瘤细胞HOS增殖和迁移的影响。
1 材料与方法
1.1 细胞株及主要试剂
人骨肉瘤细胞株HOS购自中国科学院上海细胞研究所。干扰RNA(si-TNNT1)以及阴性对照物(siR negative control,siR NC)购于广州锐博生物科技有限公司。TRIzol试剂与LipofectamineTM2000购自美国Invitrogen公司,胎牛血清、100 U/ml青霉素和100 μg/ml链霉素、MEM培养基购自美国Hyclone公司;反转录PCR试剂盒及SYBR Green试剂购于苏州近岸蛋白质科技股份有限公司;0.25%胰酶购于武汉赛维尔生物科技有限公司;CCK-8试剂盒购自南京晶恩生物科技有限公司;Transwell小室及不同规格培养皿购于美国Corning公司;Diff-quick试剂盒购自美国IMEB公司。
1.2 目标基因筛选及微阵列数据分析
使用关键词“Osteosarcoma”搜索GEO DataSet数据库(http://www.ncbi.nlm.nih.gov/geo/),下载GSE36001的基因表达谱[10]。GSE36001数据集整合了来自EuroBoNeT小组的19个人类骨肉瘤细胞系的全基因组遗传和表观遗传图谱。进一步对数据进行校准、标准化和对数转换。利用R中的limma软件包分析样本的微阵列测序数据,选取校正后P<0.05和对数倍数变化(fold change,FC)>1的DEGs用于后续分析。
利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库整合OS样本临床数据(生存状态及生存时间)和样本中TNNT1的表达量。根据TNNT1的表达高低分为两组,绘制生存曲线。
1.3 细胞培养和基因转染
常规复苏人骨肉瘤HOS细胞,分别置于含10%胎牛血清、1%青霉素、链霉素双抗的MEM培养基中,37 ℃,5%CO2培养。当细胞密度长至80%,用含EDTA的0.25%胰酶消化传代。根据后续不同实验要求分别接种于24孔板及96孔板,待培养细胞密度达到80%左右时进行转染,参照LipofectamineTM2000转染试剂说明书,分别用MEM培养基稀释si-TNNT1和siR-NC,同时使用MEM稀释LipofectamineTM2000后各自孵育5 min,将两组轻柔混匀配制转染混合物后于室温静置20 min,将转染混合物加入培养板内,转染期间,根据不同培养板要求添加无血清MEM培养基。转染6 h后更换为含血清的培养基,分为si-TNNT1组和siR-NC组,继续培养用于后续实验。
1.4 实时荧光定量PCR检测TNNT1的表达水平
采用实时荧光定量PCR检测si-TNNT1组和siR-NC组转染后的HOS细胞中TNNT1的表达水平。用TRIzol按照制造商的说明流程从HOS细胞中提取总RNA。使用逆转录试剂盒进行逆转录,反应程序:50 ℃孵育15 min,75 ℃孵育5 min,终止反应。使用SYBR Green试剂盒,按照说明书利用三步法进行目的RNA检测,反应程序如下:95 ℃预变性10 min;接着95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,进行40个循环反应。定量PCR引物如下,TNNT1:正义链5′-TGATCCCGCCAAAGATCCC-3′,反义链5′-TCTTCCGCTGCTCGAAATGTA-3′;GAPDH:正义链5′-GCCAAAAGGGTCATCATCTC-3′,反义链5′-GTAGAGGCAGGGATGATGTTC-3′。
1.5 CCK-8法检测细胞增殖
将HOS细胞以1×104个/孔的密度接种到96孔板,按1.3方法中提到的方法进行转染和分组,每组设置4个复孔,37 ℃、5% CO2培养。使用CCK-8试剂盒检测细胞的增殖力,分别在转染后24,48,72 h,在每孔中加入CCK-8溶液10 μl,37 ℃孵育2 h,立即在酶标仪上测定450 nm波长段各孔光密度OD值,OD值越高则细胞增殖活力越强,统计分析不同分组细胞的增殖活力。
1.6 细胞划痕愈合实验检测细胞迁移
按前述方法在24孔板中培养HOS细胞,待细胞密度长至80%~90%时,使用200 μl吸头在孔板正中垂直划出一条直线,然后用PBS冲洗3次,使悬浮细胞脱落,然后加入无血清的MEM培养液并用显微镜观察划痕并拍照,此时记录为0 h。然后转染细胞6,12,24 h在相同位置观察HOS细胞迁移情况,并在显微镜下观察划痕愈合情况和拍照。划痕愈合率公式为:(0 h划痕宽度-12 h或24 h划痕宽度)/0 h划痕宽度,其中划痕宽度通过Photoshop 2020软件计算得到。
1.7 Transwell法检测细胞迁移
将HOS细胞接种到12孔板,按1.3方法中提到的方法进行转染和分组,转染后24 h,分别收集各组细胞,将细胞密度稀释为1×105个/ml,细胞准备完成后开始进行Transwell小室实验。取调整好浓度的细胞悬液,每个Transwell小室中加入细胞悬液100 μl,在下室中加入700 μl的完全培养基。将Transwell板置于37 ℃、5%CO2的培养箱种继续培养24 h。用湿润的棉签将滤膜上层未穿透的细胞擦掉,PBS清洗2次,用4%多聚甲醛室温固定20 min。用Diff-quick试剂盒对滤膜进行染色,光镜随机观察5个视野中穿过滤膜的HOS细胞数量并计数。
1.8 统计学分析

2 结果
2.1 TNNT1在骨肉瘤中的表达与生存分析
通过GEO数据库对GSE36001数据集进行微阵列分析,将差异表达基因绘制热图,结果显示骨肉瘤细胞系中TNNT1基因的表达高于正常成骨细胞,差异具有统计学意义(P<0.05,见图1)。火山图显示TNNT1在骨肉瘤细胞系中高表达(见图2)。使用TCGA数据库,用R语言绘制骨肉瘤患者和TNNT1相关的生存曲线,结果显示高表达TNNT1的骨肉瘤患者整体生存率明显较差(见图3)。
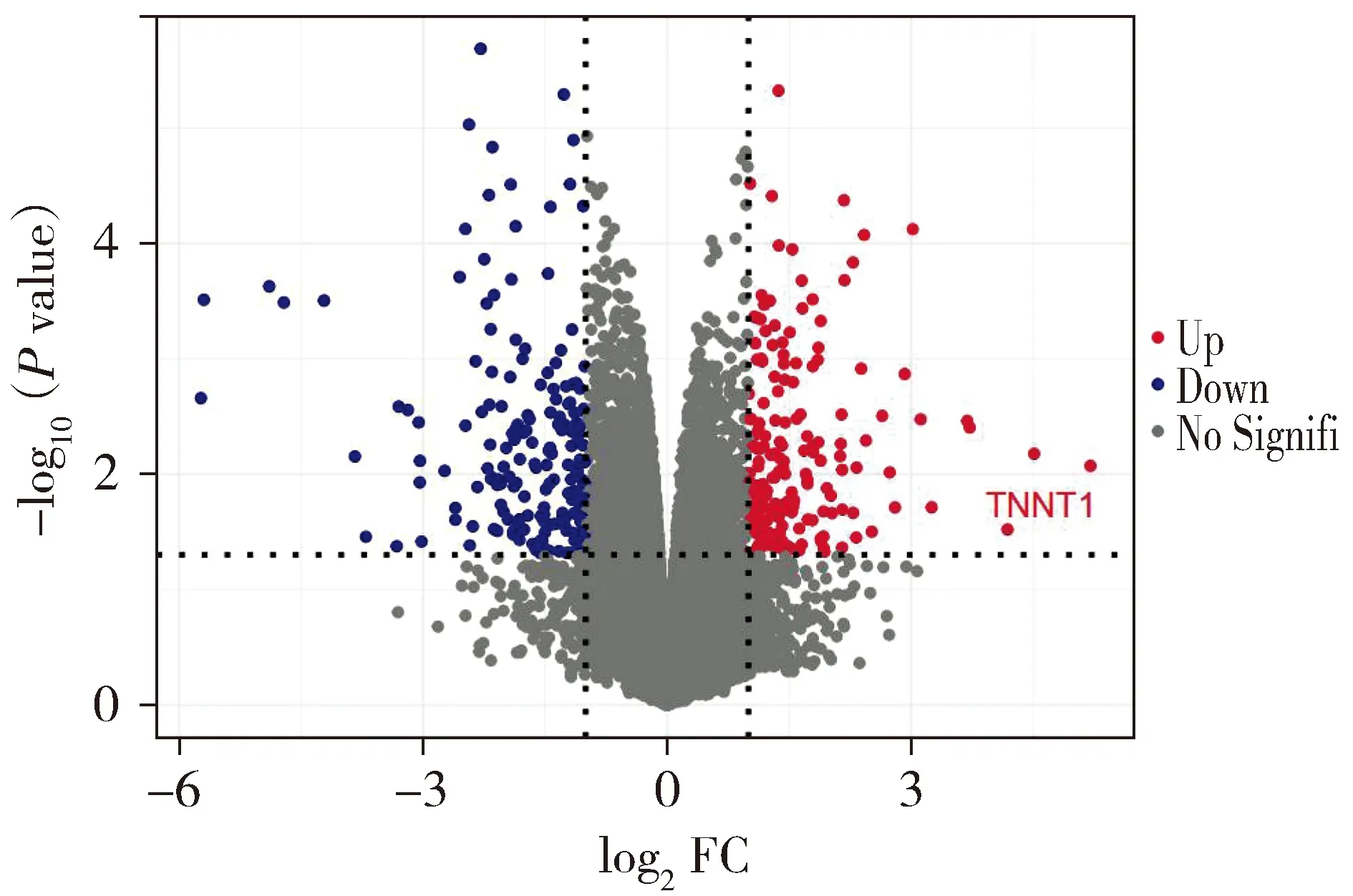
红点表示基于倍数变化大于1的同时P <0.05的上调的差异基因,蓝点表示基于倍数变化小于-1并且P <0.05的下调的差异基因,灰点代表没有显著差异的基因
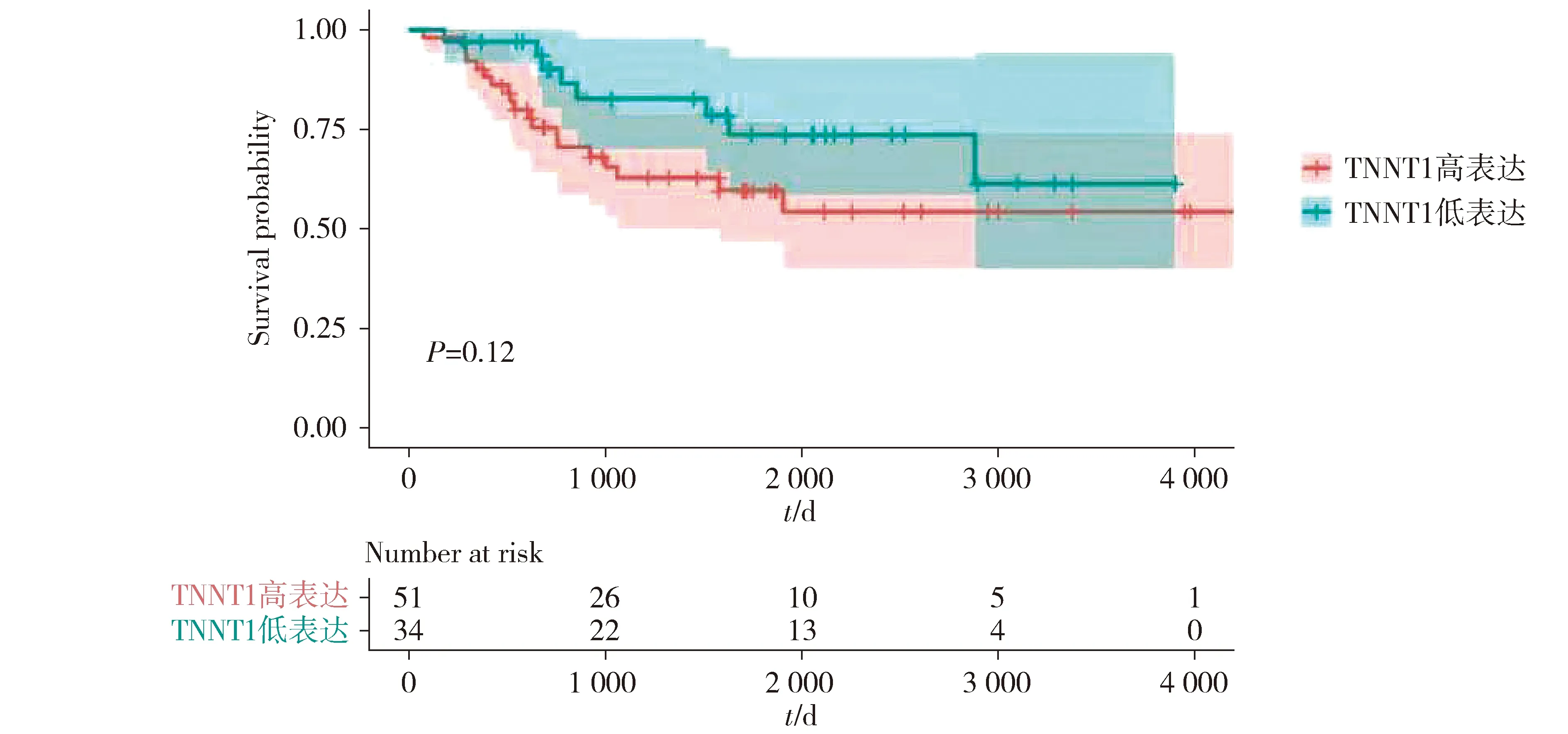
图3 TNNT1基因表达患者的生存分析Figure 3 Survival analysis of patients with different TNNT1 gene expression
2.2 转染si-TNNT1后TNNT1的相对表达量
使用qRT-PCR验证si-RNA干扰效率,与siR-NC组相比,si-TNNT1组中HOS细胞TNNT1表达水平明显降低,差异有统计学意义(P<0.000 1,见图4)。
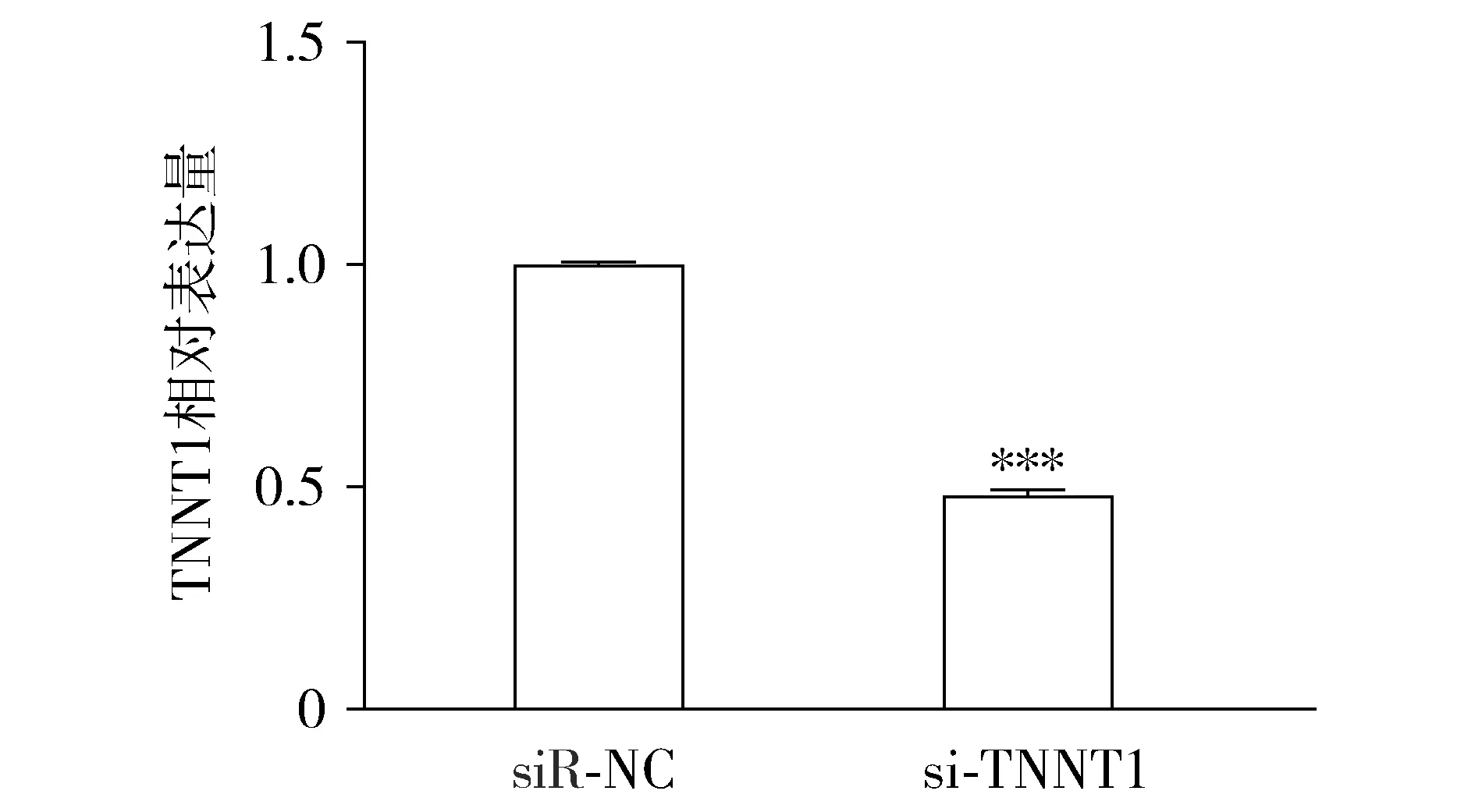
与siR-NC组比较,* * * P <0.000 1
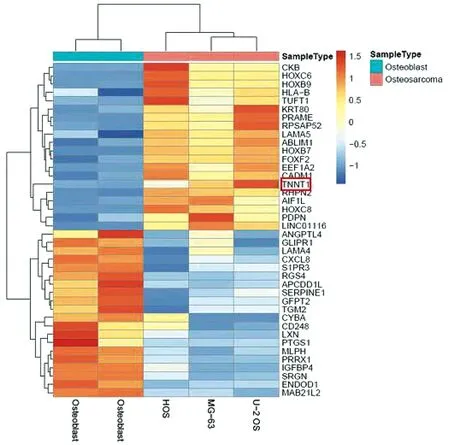
蓝色条表示基因表达下调,红色部分表示基因表达上调
2.3 抑制TNNT1后HOS细胞增殖活力的变化
CCK-8法检测结果显示,在HOS细胞中,相较于对照组,si-TNNT1组在1,2,3 d增殖活力降低,差异具有统计学意义(P<0.05,见图5)。
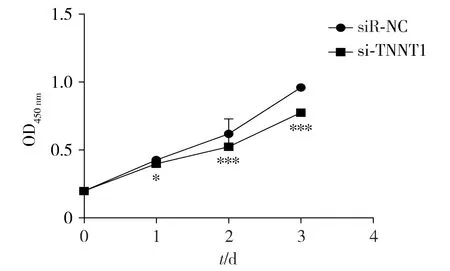
与siR-NC组比较,* P <0.05,* * * P <0.000 1
2.4 抑制TNNT1表达对HOS细胞迁移的影响
划痕愈合实验结果显示,与siR-NC组相比,si-TNNT1组HOS细胞在培养6,12,24 h后愈合率均受到抑制,差异具有统计学意义(P<0.01,见图6);此外,Transwell迁移实验结果显示,与siR-NC组相比,si-TNNT1组HOS细胞穿过小室膜的数量减少,差异具有统计学意义(P<0.01,见图7)。以上结果表明抑制TNNT1可以分别抑制HOS细胞的横向和纵向迁移能力。
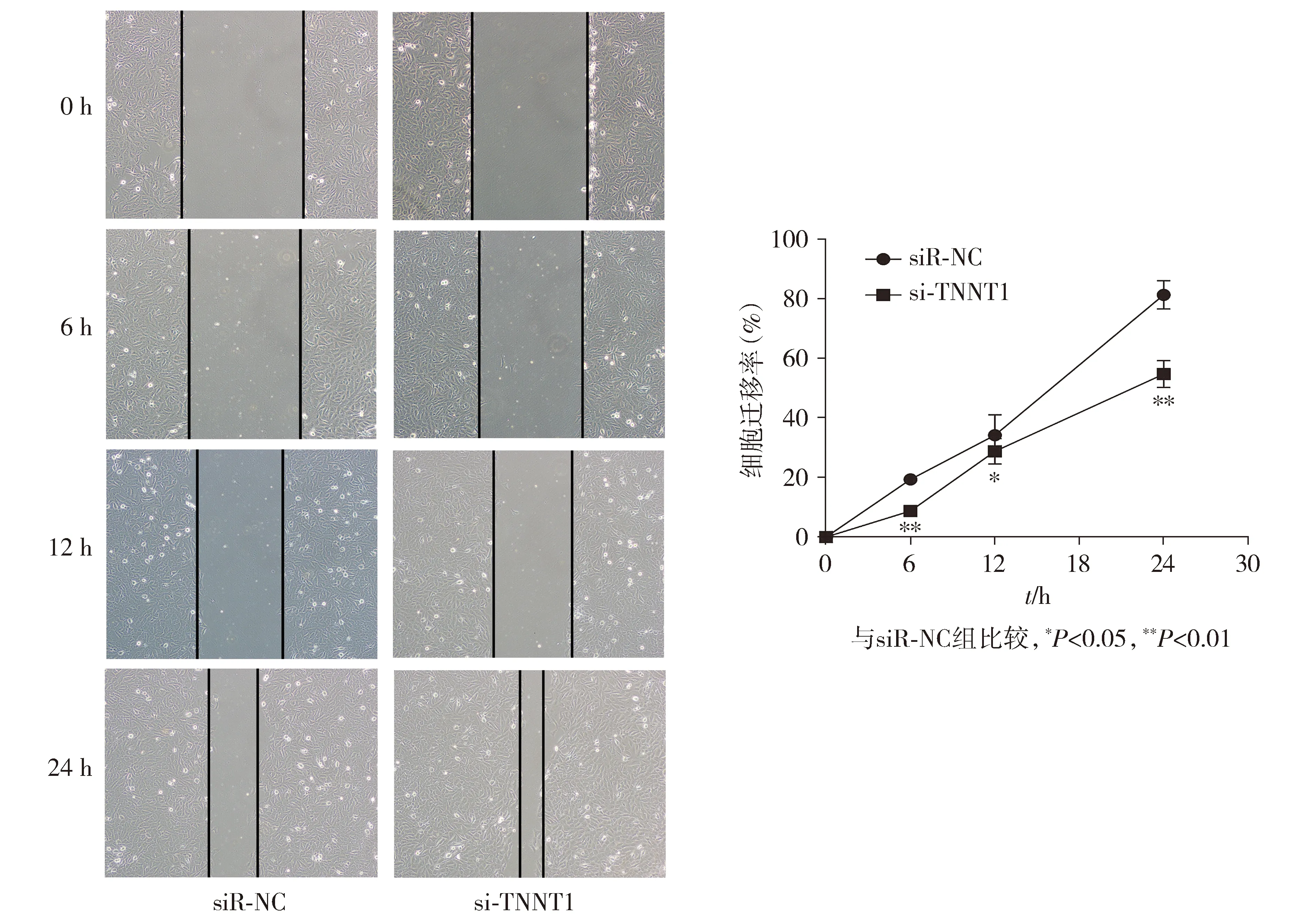
图6 划痕愈合实验检测si-TNNT1对细胞迁移能力 (×200)Figure 6 Effect of si-TNNT1 on cell migration by Wound healing assay (×200)
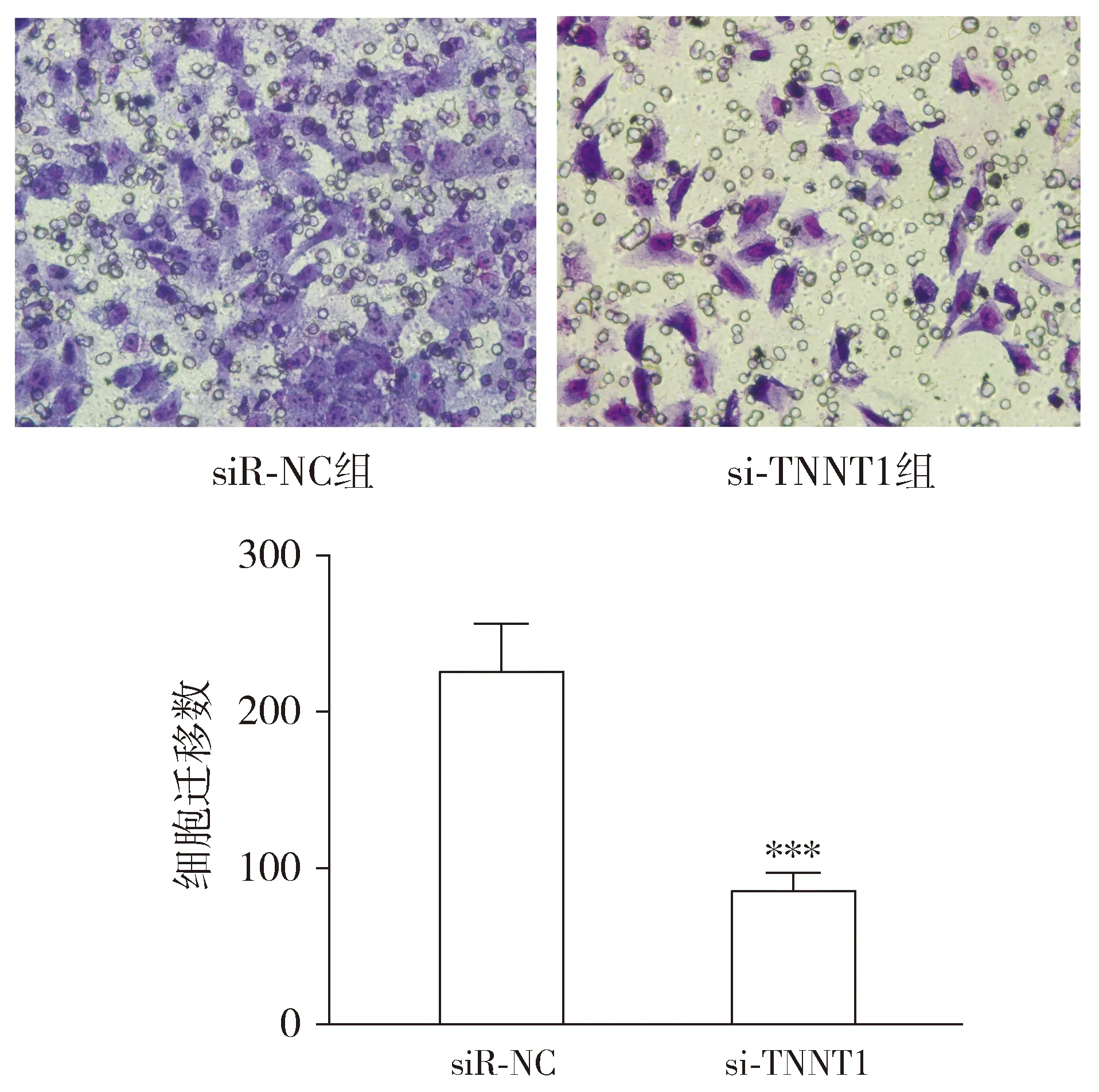
与siR-NC比较,* * * P <0.000 1
3 讨论
骨肉瘤是最常见的原发性恶性骨肿瘤,其主要发生在儿童和青少年,具有很高的局部复发和肺转移的可能性[11]。探索骨肉瘤的发生机制及确定新的靶点,并制定更有效的骨肉瘤治疗策略对于提高骨肉瘤的治疗效果是非常有必要的。
目前应用于临床治疗肿瘤的方法有很多,如抑癌基因治疗、反义基因治疗、自杀基因治疗等[12]。以RNA干扰(RNA interference,RNAi)为基础的治疗方法也正在被广泛研究[13]。RNAi是一种有前途的生物过程,用于治疗许多疾病,如癌症、病毒感染、自身免疫性疾病等[14-16]。肌钙蛋白T(troponin T,TnT)对横纹肌的收缩至关重要。脊椎动物有3种类型特异性同源TnT亚型,即TNNT1、TNNT2和TNNT3[7]。先前的研究报告指出TNNT1基因的突变导致骨骼肌中TnT的丧失,最终导致严重的杆状体肌病,通常表现为肌张力减退、肌肉无力和运动障碍延迟[17]。此外,TNNT1作为肌节丝上的调节复合体的组成成分之一,通过参与肌动蛋白和肌球蛋白的相互作用,可以调节细胞的迁移和侵袭[7,8]。近些年研究显示TNNT1对直肠结肠癌等恶性肿瘤的转移具有调控作用[18-20]。本研究首先通过GEO数据筛选出TNNT1在骨肉瘤细胞中高表达,同时利用TCGA数据库进一步分析显示TNNT1高表达的患者其生存率明显下降,说明TNNT1可能促进骨肉瘤进展。Deng等[21]研究也显示TNNT1可能是尤因肉瘤的潜在预后生物标志物。其他研究显示TNNT1在几种肿瘤组织中上调,同时还可以诱导人多能干细胞实现永生化[22]。而细胞永生化是细胞恶性转化的标志,也是癌细胞的共同特征。为了进一步验证TNNT1对骨肉瘤恶性进展的影响,我们的研究表明敲低TNNT1可以抑制骨肉瘤HOS细胞的迁移。TNNT1基因表达的改变可能对肿瘤发生和抑制有着重要作用。还有研究揭示TNNT1在乳腺癌组织中高表达,同时可以通过调控癌细胞G1/S转换促进增殖,并且提出TNNT1表达与临床分期和T、N、M分级密切相关[23]。本研究证明敲低TNNT1的表达可以抑制骨肉瘤HOS细胞的增殖,与先前的研究一致。此外,在最近一项对临床药物的研究中显示TNNT1可以作为组蛋白去乙酰化酶抑制剂诱导致死的临床生物标志物[24]。
总之,本研究通过生物信息学分析TNNT1高表达的患者生存率较低,同时进一步证明敲低TNNT1的的表达可以抑制骨肉瘤HOS细胞的增殖和迁移,说明其可能是促进骨肉瘤进展的重要因素。我们也将进一步研究TNNT1对骨肉瘤细胞的其他调控作用及上下游机制,为骨肉瘤的治疗靶点提供更多理论基础。

