病毒性心肌炎患者外周血miR-146b表达水平与病情及不良预后风险的相关性
卢东东,唐智奇,杨 帆*,杨 梅
(1 柳州市工人医院心内科,柳州 545000;2 柳州市人民医院功能科;* 通讯作者,E-mail:yangiw9523@163.com)
病毒性心肌炎(viral myocarditis,VM)是由肠道病毒和腺病毒感染引起的,可扰乱自身免疫平衡而导致心肌损伤,其发病率呈上升趋势[1]。据统计,VM死亡率高达20%,持续性病毒性心肌炎患者预后较差,5年生存率约为50%[2]。此外,部分病毒性心肌炎由于病毒性损伤、免疫力、遗传易感性等因素可发展为扩张型心肌病[3]。因此,寻找影响病毒性心肌炎的生物标志物对于缓解患者病情及改善预后具有重要意义。
miRNA参与细胞增殖、分化及凋亡,可以与靶mRNA的3′非编码区互补结合,直接降解靶mRNA,参与机体的正常生理病理过程。虽然目前miRNA的功能尚不清楚,但一些研究表明,miRNA的异常表达或突变与许多心肌病的发生、发展密切相关[4]。故miRNA成为心脏病生物治疗研究领域的一个新焦点。microRNA-146b(miR-146b)参与固有免疫或调节炎性反应。在VM动物模型中,miR-146b在心肌组织中呈高表达[5]。在VM扩张型心肌病患者中miR-146b和miR-155水平可抑制Treg免疫反应,促进Th17免疫反应[6],这些研究说明miR-146b可提供免疫应答方面的生物学信息。由于VM是病毒侵犯心肌所致心肌溶解并诱发心肌自身免疫反应的结果,因此监测miR-146b水平或能为VM的治疗提供依据。基于以上研究,本研究拟探讨外周血miR-146b水平与VM患者病情及预后的相关性。
1 资料与方法
1.1 病例来源及分组
前瞻性选取柳州市工人医院和柳州市人民医院收治的VM患者95例,入选时间2019年12月至2020年12月,根据VM严重程度分为轻症组45例,重症组50例,收集同期健康体检者48例作为对照组,采用反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)测量各组入组时血清miR-146b水平,随访观察12个月,根据预后分为预后不佳组和预后良好组,采用多因素Logistic分析影响因素,并采用限制性立方样条拟合miR-146b与VM患者预后间的关系。
其中心肌炎严重程度分组依据[7]:临床表现为房性、室性早搏,心电图结果显示ST-T改变,心肌肌钙蛋白(cardiac troponin I,cTn I)<0.1 μg/L为轻症组;出现心源性休克、急性左心衰竭、Ⅲ度房室传导阻滞射血分数(ejection fractions,EF)<50%,cTnI>0.2 μg/L为重症组。本研究经柳州市工人医院和柳州市人民医院伦理委员会批准。患者及其家属签署知情同意书。
1.2 临床基线资料
纳入标准:①符合VM诊断标准[8],经X线或心脏彩超证实有心脏扩大;异常心电图改变;②肝肾功能正常;③均为首次确诊。排除标准:①合并其他心肌病;②合并非心源性疾病;③合并恶性肿瘤。收集VM患者性别、年龄、体质量指数等人口社会性特征。
1.3 实验室检查
1.3.1 心脏心肌酶谱指标测定 抽取VM患者入院时肘静脉血3 ml,以1 800 r/min(离心半径15 cm)离心10 min,分离血清。采用全自动生化分析仪(美国雅培;Ci8200型)以连续监测法测定心肌酶谱指标[肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)];测定cTn I水平(电化学方法),以上严格按照仪器或试剂说明书进行。
1.3.2 炎症因子水平测定 抽取VM患者入院时肘静脉血3 ml,以1 800 r/min(离心半径15 cm)离心10 min,分离血清。采用全自动生化分析仪(美国雅培;Ci8200型)以速率散射比浊法测定血清高敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP)水平,以酶联免疫吸附试验法检测血清白细胞介素-18(interleukin-18,IL-18)和血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,以上严格按照仪器或试剂说明书进行。
1.4 血清miR-146b水平测量
采取健康体检者和VM患者入院时空腹静脉血4 ml,常规分离血清。采用提取总RNA(北京天根生化科技公司),将RNA反转录为cDNA,在BioRad型荧光定量PCR仪上行RT-PCR技术检测miR-146b。加入PCR缓冲液(2.5 μl稀释10倍),MgCl2溶液1.5 μl,上、下游引物各0.5 μl后加水配置(总体积为25 μl)。按照反应程序94 ℃变性、55 ℃反应、72 ℃反应各1 min,共35个循环,72 ℃延伸5 min,重复3次以上,以U6作为内参基因在CFX manager软件上采用2-△△Ct方法计算miR-146b相对表达量。
1.5 超声心动图检查
采用飞利浦IE33型多普勒彩色超声仪(4~5 MHZ),受检者仰卧,暴露心前区。依次对长轴切面(两腔心、心尖四腔心与胸骨旁左室长轴),短轴切面(乳头肌水平、主动脉根部、胸骨旁二尖瓣水平、心尖水平)进行扫描。最后,仔细观察受检者的室间隔、左室后壁运动情况、二尖瓣活动以及回声情况。记录EF、每搏输出量(stroke volume,SV)、左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)。
1.6 随访及预后判断
经检查后,所有VM患者均予吸氧、心电监护、抑制心室重构等对症治疗,经治疗后以电话、来院复查形式进行为期12个月的康复随访,并观察预后情况,将出现包括死亡、心脏移植、心力衰竭再入院或心肌炎复发等作为预后不良归为预后不良组,未出现不良事件归为预后良好组。
1.7 质量控制
统一培训并确定统一调查方案,严格执行纳入标准和排除标准,以确保研究资料客观性和准确性,数据基于Epidata软件进行平行双录入,保证数据无误。
1.8 统计学分析

2 结果
2.1 病例组和对照组血清miR-146b水平对比
病例组(轻症组和重症组)和对照组血清miR-146b表达水平差异具有统计学意义(F=6.015,P=0.003),其中重症组血清miR-146b表达水平显著高于轻症组和对照组(t=2.109,P=0.038;t=4.466,P<0.01),轻症组血清miR-146b表达水平显著高于对照组(t=2.057,P=0.043,见图1)。
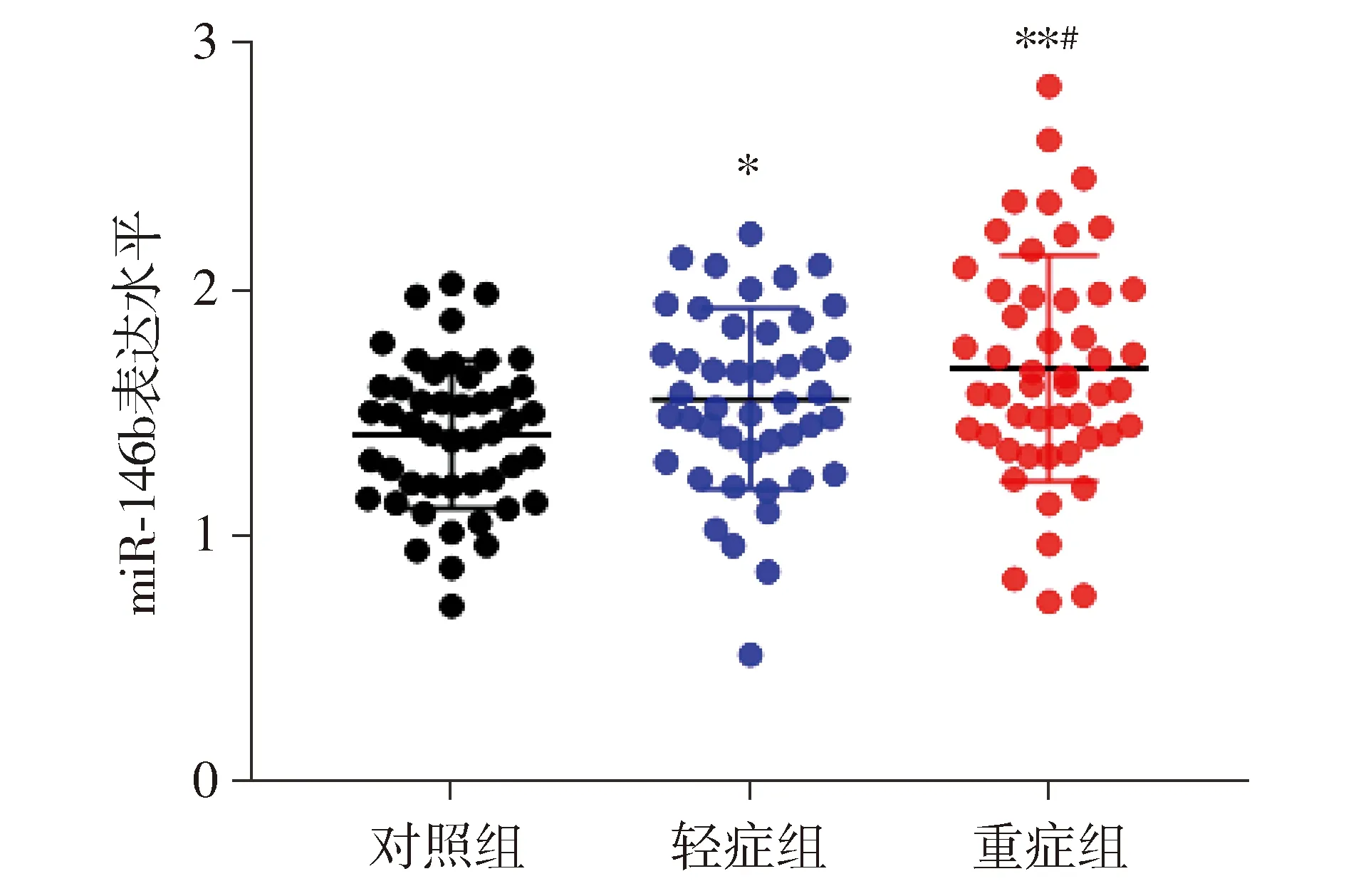
与对照组比较,* P <0.05,* * P <0.01;与轻症组比较,#P <0.05
2.2 VM患者预后
随访观察12个月,病例组2例失访,最终纳入93例VM患者,其中持续性室性心动过速、死亡、心脏移植、心力衰竭再入院等不良事件41例(44.09%)归为预后不良组,其余未出现上述情况的52例(55.91%)为预后良好组。
2.3 预后良好组和预后不良组人口社会学资料对比
两组年龄、性别、体质量指数对比差异无统计学意义(P>0.05,见表1)。
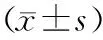
表1 预后良好组和预后不良组人口社会学资料对比
2.4 预后良好组和预后不良组入院时指标对比
2.4.1 炎症反应指标 预后良好组入院时血清TNF-α、IL-18水平较预后不良组低,差异有统计学意义(P<0.05),血清hs-CRP水平对比差异无统计学意义(P>0.05,见表2)。

表2 预后良好组和预后不良组入院时炎症反应指标对比
2.4.2 心肌标志物指标 预后良好组入院时血清cTnI水平较预后不良组低,差异有统计学意义(P<0.05),血清CK、CK-MB、LDH水平两组间比较差异无统计学意义(P>0.05,见表3)。

表3 预后良好组和预后不良组入院时心肌标志物指标对比
2.4.3 超声心动图指标和miR-146b表达量对比 预后良好组血清miR-146b水平较预后不良组低,差异有统计学意义(P<0.05),LVEDD、EF、SV水平对比差异无统计学意义(P>0.05,见表4)。

表4 预后良好组和预后不良组入院时超声心动图指标、miR-146b表达量对比
2.5 VM患者预后影响因素多因素Logistic分析
以预后情况为因变量(预后良好=0,预后不良=1),以入院时血清TNF-α、IL-18、cTnI及miR-146b水平为自变量进行Logistic回归分析,变量筛选采用逐步法(α入=0.05,α出=0.1);多因素Logistic分析显示,血清TNF-α(OR=1.065,95%CI 1.006~1.128)、IL-18(OR=1.593,95%CI 1.217~2.085)、cTnI(OR=2.260,95%CI 1.233~4.144)、miR-146b(OR=5.516,95%CI 1.711~17.788)为VM患者预后不良的危险因素(均P<0.05,见表5)。限制性立方样条显示,入院时血清miR-146b水平与VM患者预后情况呈线性剂量-反应关系(χ2=5.940,P=0.041,见图2),即VM患者预后不良风险与血清miR-146b水平呈缓慢上升型曲线,当血清miR-146b水平增加至1.6及以上时,预后不良风险逐渐增加。

表5 VM患者预后影响因素多因素Logistic分析

图2 血清miR-146b水平与VM患者预后情况间的剂量反应关系Figure 2 The dose-response relationship between serum miR-146b level and prognosis of VM patients
3 讨论
柯萨奇病毒和腺病毒是引起VM的病原体,VM的病理变化为心肌间质组织和血管周围炎性细胞的局灶性浸润、散在浸润或弥漫性浸润[9]。若不及时干预,发展为重症VM可迅速进展,导致死亡。miRNA因具有调控细胞增殖、分化、发育、凋亡等过程而受到重视。既往研究显示,miR-146b与类风湿性关节炎[10]、2型糖尿病[11]等疾病有关。证据表明,在促炎细胞因子诱导下,内皮细胞中miR-146b表达水平上调而加重炎症反应[11]。由于VM是与病毒感染有关的炎症性疾病,监测miR-146b水平或可为VM的治疗提供新的方向。
miRNAs最近被提出是血液循环中的可靠标志物,miRNA参与细胞的许多生物学过程。在临床实践中,miRNA被认为是诊断瓣膜性心脏病、急性心肌梗死等各种心血管疾病的有效生物标志物[12]。miR-146b位于人类染色体10q24.32,聚合酶链式反应检测显示miR-146b水平在间质瘤细胞中呈高表达状态[13]。在内皮细胞中,miR-146与细胞衰老相关,其可增强血管生成活性,作为炎症的负调节剂,抑制促炎NF-κB通路以及MAP激酶通路[14];且Yan等[15]研究显示相较于正常组,VM患儿心肌组织miR-146b水平显著升高,这一结果提示心肌组织中miR-146b水平上调与VM间存在一定关系。本研究也证实VM患者血清miR-146b水平较健康人群高,且重症组血清miR-146b表达水平显著高于轻症组。在VM患者预后方面,Liao等[16]显示miR-146b表达水平的变化可能与VM患者心功能和左室收缩功能变化有关,但并未进一步阐明两者之间的关系。随后研究表明[17],miR-146b在急性病毒性心肌炎患者中可以通过影响NF-kB通路来恢复心功能,但未进一步分析miR-146b水平与心力衰竭再入院、心肌炎复发等不良事件发生风险的关系。另外,在Chouvarine等[18]研究中证实,高水平miR-146b可抑制Th的免疫应答反应,促使大量的IL-10合成分泌,促进Th17的免疫应答及IL-17、IL-21分泌,影响免疫系统动态平衡状态,加重对心肌细胞的损伤,继而提高恶性心律失常发生风险。本研究结果随访观察12个月,对VM患者死亡、心脏移植、心力衰竭再入院或心肌炎复发等预后情况观察发现,血清miR-146b水平是VM患者预后不良的独立危险因素,且限制性立方样条显示,miR-146b水平与VM患者预后情况呈线性剂量-反应关系(χ2=5.940,P=0.041),说明miR-146b与VM患者预后相关,这与miR-146b抑制机体免疫反应有关。
VM的早期诊断对VM患者的预后至关重要,cTnI诊断该疾病的准确性越来越受到关注。cTnI涉及到收缩和舒张功能的调节。心肌细胞所引起的相应损伤受物理、化学和生物因素的影响。有研究认为,心肌细胞由于心肌细胞膜完整性丧失而迅速向血流中释放cTnI,导致血清cTnI异常升高,故cTnI表达水平在心肌细胞损伤后18~24 h达到峰值,正好在疾病进展开始之前[19]。同时由于cTnI分子量小,更容易穿透细胞膜而增加血药浓度,进而提高诊断心肌损伤时的敏感性[20]。另外,抗cTnI在心肌损伤患者中异常表达,在急性心肌梗死患者的血清中检测到了抗cTnI,并发现抗cTnI是左心室重构的独立危险因素[21]。本研究结果显示,血清cTnI与VM患者预后有关。心肌细胞受损时,cTnI能快速释放入血而表现为血清测定值急剧升高,则对心肌细胞造成损伤,进而影响VM患者预后。
已有的研究发现,VM症状的缓解与血清IL-18浓度的降低有关[22]。另一方面,血清TNF-α不仅加重心肌炎症反应,还刺激巨噬细胞释放过多的炎症因子如IL-18,从而可能影响心脏功能[23]。本研究中预后不良者血清IL-18、TNF-α水平均高于预后良好者,且血清IL-18、TNF-α水平为VM患者预后的危险因素。这可能与血清IL-18、TNF-α参与VM炎症反应有关。
综上所述,miR-146b水平与患者VM病情及预后相关,既可作为患者VM病情的生物标志物,同时也是预后预测的标志物。本研究也存在一定不足,样本量的限制及其他客观因素的影响,未进行长期的动态随访,无法观察miR-146b水平随时间动态变化的趋势,今后应扩大样本量,增加动态随访以进一步深入研究。

