辛伐他汀减轻白蛋白结合型紫杉醇致大鼠神经病理性疼痛的作用及其机制
魏 星,马 莉,王 力,王 颖,李维妙,周雅卿,赵永林*
(1 西安交通大学第二附属医院妇产科,西安 710004;2 西安交通大学第二附属医院肿瘤科;* 通讯作者,E-mail:zhaoyonglinlin@163.com)
白蛋白结合型紫杉醇(nab-paclitaxel)是紫杉醇与人血白蛋白经高压震动技术制成的纳米微粒,与普通剂型紫杉醇相比,白蛋白结合型紫杉醇使用前不需要预处理,过敏反应发生率低,骨髓抑制等副作用较轻[1]。白蛋白结合型紫杉醇主要的不良反应是剂量限制性的神经毒性,表现为外周感觉性的痛觉过敏、灼痛、刺痛和麻木等,也称为神经病理性疼痛,目前临床上并没有能有效缓解病理性疼痛的治疗措施。
他汀类药物是3-羟基-3-甲基戊二酸单酰辅酶A还原酶的抑制剂,除降胆固醇、治疗心血管疾病等作用之外,还具有抗炎、抗氧化、神经保护等作用[2]。已发现在动物模型中,他汀类药物能缓解脊神经结扎、坐骨神经压伤和慢性压迫性损伤等导致的疼痛[3,4],但其在紫杉醇导致的神经病理性疼痛中的作用及机制尚不明确。本研究通过建立白蛋白结合型紫杉醇所致的神经病理性疼痛大鼠模型,明确辛伐他汀是否可缓解白蛋白结合型紫杉醇导致的神经病理性疼痛,并探讨其潜在机制。
1 材料与方法
1.1 动物分组
体质量为250~300 g的清洁级雄性SD大鼠54只,购自西安交通大学实验动物中心[许可证号:SCXK(陕西)2006-001]。大鼠饲养室内温度(23 ±1)℃,12 h照明/12 h黑暗。采用随机数表法将大鼠分为紫杉醇组、紫杉醇+辛伐他汀(simvastatin,SVT)组和对照组,每组18只。每组大鼠中6只用于病理学检测,6只用于Western blot检测,6只用于ELISA检测。
1.2 主要试剂与仪器
辛伐他汀(片剂,规格:10 mg,纯度:98%)购自中国上海TCI公司,白蛋白结合型紫杉醇(粉剂,规格:100 mg,纯度:99%)购自石药集团欧意药业有限公司,微管相关蛋白6(microtubule-associated protein 6,MAP-6)抗体购自美国Thermo Scientific公司,caveolin-1、MAP-2、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自美国Cell Signaling Technology公司,离子钙接头蛋白抗体(ionized calcium binding adaptor molecule-1,Iba-1)购自日本Wako公司,Toll样受体4(toll-like receptor 4,TLR4)、MAP-4、β-actin抗体购自英国Abcam公司,免疫组化SP试剂盒、DAB显色盒购自北京中杉金桥公司,RIPA裂解液、蛋白含量检测试剂盒、Western blot相关试剂购自上海碧云天生物技术有限公司,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和IL-6 ELISA试剂盒购自美国R&D Systems公司。IITC电子Von Frey痛觉测量仪购自美国IITC公司。
1.3 动物模型制备
参考文献[5]的方法,用生理盐水将白蛋白结合型紫杉醇溶解,以2.47 mg/kg的剂量给大鼠腹腔注射,共注射4次(第1,3,5,7天),累积剂量为9.9 mg/kg,只接受白蛋白结合型紫杉醇腹腔注射的大鼠为紫杉醇组;紫杉醇+SVT组除了腹腔注射白蛋白结合型紫杉醇外,实验第1~7天腹腔注射辛伐他汀(15 mg/kg)[6],每日1次;对照组腹腔注射同剂量的生理盐水。实验第8天处死大鼠。大鼠出现机械痛敏和热痛敏为神经病理性疼痛模型构建成功,大鼠机械刺激缩足反射阈值及热刺激缩足反射潜伏期降低,提示大鼠出现机械痛敏和热痛敏。
1.4 热刺激缩足反射潜伏期测定
利用热痛刺激仪于实验开始前1 d(day 0)、实验开始后第4天(day 4)和第8天(day 8)测定大鼠的热刺激缩足反射潜伏期(thermal withdrawal latency,TWL)。将大鼠置于透明的玻璃箱中,适应30 min,待其处于安静状态时,采用热刺激器产生的热束刺激大鼠左后足趾面,当大鼠出现特征性舔爪或提爪时为阳性反应,大鼠响应热刺激的潜伏时间(s)即为TWL。每只大鼠进行5次试验,每次试验间隔5 min。
1.5 机械刺激缩足反射阈值测定
利用von Frey细丝检测实验开始前1 d(day 0)、实验开始后第4天(day 4)和第8天(day 8)的机械刺激缩足反射阈值(mechanical withdrawal threshold,MWT)。将大鼠置于底部为铁丝网的塑料笼中,适应30 min后,采用Von Frey细针丝刺激大鼠右后足趾面,每次持续刺激4~6 s,每次刺激最小间隔2 min。以细针丝出现肉眼可见的稍微弯曲为完全受力标准,当大鼠出现快速缩足时为阳性反应,记录此时刺激力度,根据公式计算大鼠的MWT(g),每只大鼠测试5次,取平均值。
1.6 Western blot检测微管相关蛋白MAP-2、MAP-4、MAP-6的表达
大鼠麻醉后开胸灌注4 ℃生理盐水,快速取出L4-6脊髓组织,液氮速冻,-80 ℃保存。取各组大鼠冷冻脊髓组织匀浆,加入适量蛋白裂解液,BCA试剂盒测定蛋白量,根据标准曲线计算待测蛋白浓度。取30 mg蛋白经聚丙烯酰胺凝胶电泳分离,湿转法转膜,脱脂奶粉室温封闭1 h,加入一抗:β-actin(1∶1 000)、MAP-2(1∶1 000)、MAP-4(1∶1 000)、MAP-6(1∶1 000),4 ℃孵育过夜,TBST漂洗3次,加入HRP标记的二抗(1∶5 000)室温孵育2 h,化学发光法显色,拍照,Image J软件定量分析。MAP-2、MAP-4、MAP-6的表达异常提示微管结构紊乱。
1.7 免疫组化法检测GFAP、Iba-1及TLR4在脊髓组织中的表达
大鼠麻醉后,先后经生理盐水、4%多聚甲醛灌注,取出L4-6脊髓组织。常规石蜡包埋,切片、脱蜡、水化,过氧化氢消除内源性过氧化物酶,高压抗原修复,血清室温封闭30 min,加入TLR4抗体(1∶200)、Iba-1抗体(1∶400)、GFAP抗体(1∶200),4 ℃过夜。生物素化二抗37 ℃孵育30 min后,辣根酶标记链霉卵白素37 ℃孵育30 min。DAB显色、苏木素溶液复染,常规脱水、封片。GFAP及Iba-1表达升高提示小胶质细胞及星形胶质细胞异常活化。
光镜下观察,Leica-Q550CW图像分析系统采集图像。每张切片随机选取6个视野(×400),Image-Pro Plus 6.0对切片的染色强度与阳性细胞数进行评估:①染色强度评分:无染色0分,轻度黄染1分,中度黄染2分,重度黄染3分;②阳性细胞数百分比评分:无染色,0分;0<阳性细胞数≤10%为1分,10%<阳性细胞数≤50%为2分,50%<阳性细胞数≤80%为3分,80%<阳性细胞数≤100%为4分。染色强度与阳性细胞数的评分乘积为免疫组化评分,评分最高12分,最低0分。
1.8 免疫荧光检测脊髓组织中caveolin-1的表达
大鼠切片,脱蜡、水化如前,消除内源性过氧化物酶后行抗原修复,封闭30 min,加入caveolin-1抗体(1∶400),4 ℃过夜。滴加FITC标记的荧光二抗(1∶4 000),室温避光孵育2 h,冲洗后甘油缓冲液封片,于荧光显微镜下观察结果并拍照。
1.9 ELISA检测炎性因子TNF-α、IL-6、IL-1β的水平
取-80 ℃保存的各组大鼠脊髓组织上清液,使用自动分光光度计,采用ELISA试剂盒按照说明书步骤检测脊髓组织上清液中TNF-α、IL-1β和IL-6的含量。
1.10 统计学分析

2 结果
2.1 辛伐他汀减轻白蛋白结合型紫杉醇导致的神经病理性疼痛
在开始给药后第4天及第8天,与对照组相比,紫杉醇组MWT、TWL的值均明显降低,差异均有统计学意义(P<0.05);与紫杉醇组相比,紫杉醇+SVT组MWT、TWL的值均升高,差异均有统计学意义(P<0.05,见图1)。
2.2 辛伐他汀降低神经病理性疼痛大鼠脊髓微管相关蛋白的表达
Western blot结果显示:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中微管相关蛋白MAP-2、MAP-4、MAP-6的表达均明显升高,差异均有统计学意义(P<0.05);与紫杉醇组相比,紫杉醇+SVT组MAP-2、MAP-4、MAP-6的表达减少,差异均有统计学意义(P<0.05,见图2)。
2.3 辛伐他汀抑制神经病理性疼痛大鼠脊髓中的胶质细胞活化
免疫组化结果显示:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中GFAP及Iba-1的表达明显升高,差异均有统计学意义(P<0.05)。与紫杉醇组相比,紫杉醇+SVT组GFAP及Iba-1的表达降低,差异均有统计学意义(P<0.05,见图3)。
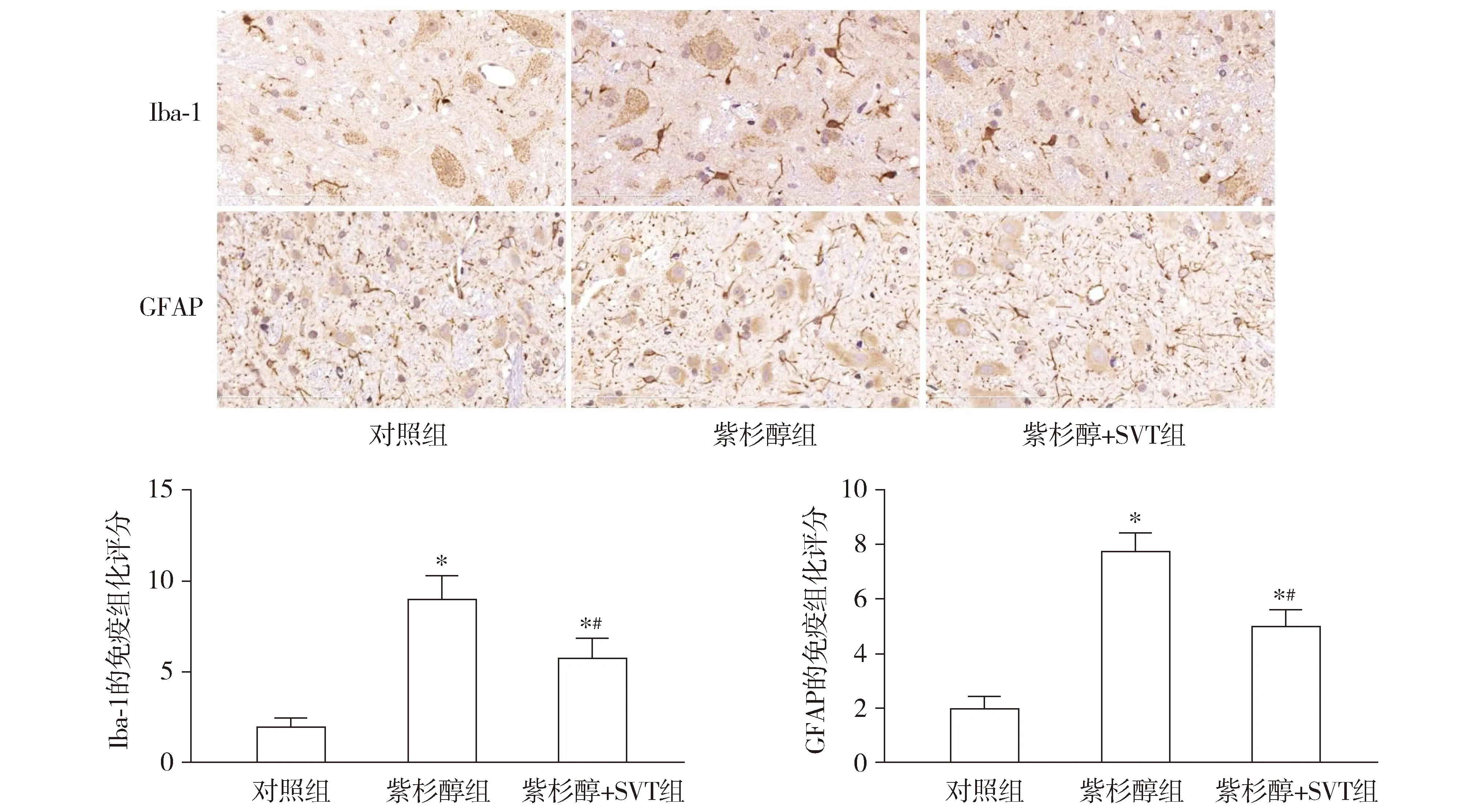
与对照组相比,* P <0.05;与紫杉醇组相比,# P <0.05
2.4 辛伐他汀通过调控caveolin-1及TLR4的表达改善神经病理性疼痛
免疫组化结果显示:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中caveolin-1及TLR4的表达明显升高,差异均有统计学意义(P<0.05)。与紫杉醇组相比,紫杉醇+SVT组caveolin-1及TLR4的表达降低,差异均有统计学意义(P<0.05,见图4)。

与对照组相比,* P <0.05;与紫杉醇组相比,# P <0.05
2.5 辛伐他汀可降低神经病理性疼痛大鼠脊髓组织中的炎性因子水平
ELISA结果显示:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中TNF-α、IL-1β和IL-6的含量明显升高(P<0.05);与紫杉醇组相比,紫杉醇+SVT组TNF-α、IL-1β和IL-6的含量明显降低,差异均有统计学意义(P<0.05,见图5)。
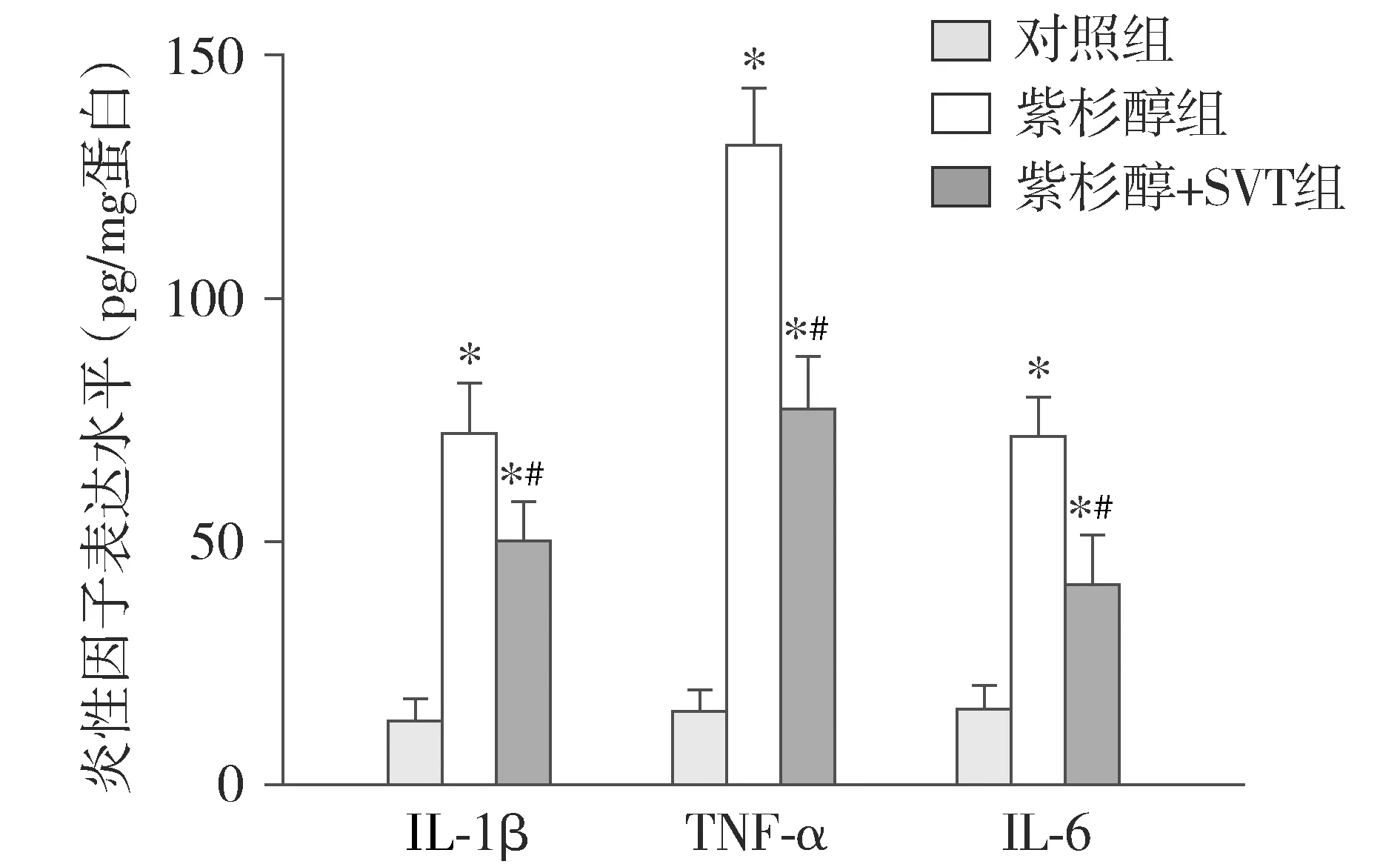
与对照组相比,* P <0.05
3 讨论
与普通剂型紫杉醇相比,白蛋白结合型紫杉醇抗肿瘤的效果更好,同时血液毒性、严重过敏反应等不良反应发生率更低[1]。但是白蛋白结合型紫杉醇周围神经毒性的发生率高于普通剂型紫杉醇,临床上没有能有效缓解神经毒性的措施。辛伐他汀被证实可降低外周神经痛和奥沙利铂引起的痛觉过敏,但是能否缓解白蛋白结合型紫杉醇导致的神经病理性疼痛尚不明确[2]。本研究的实验结果表明辛伐他汀能缓解白蛋白结合型紫杉醇导致的神经病理性疼痛,其保护作用可能与抑制caveolin/TLR4途径、降低下游炎性因子水平、减少微管相关蛋白的表达有关。
本研究中,给予大鼠腹腔注射辛伐他汀后,能减轻白蛋白结合型紫杉醇导致的神经病理性疼痛,表现为大鼠MWT、TWL降低,疼痛相关的行为学得到改善。既往研究也报道辛伐他汀通过多种途径改善神经病理性疼痛。辛伐他汀能通过抑制RhoA/LIMK/cofilin通路活性,减轻大鼠慢性压迫性神经损伤导致的神经性疼痛[3],而鞘内注射辛伐他汀也可以缓解大鼠椎间盘源性疼痛[7]。辛伐他汀也能缓解化疗药物导致的神经性疼痛:低剂量的辛伐他汀能通过抗炎作用减轻长春新碱导致的神经性疼痛[5]。此外,辛伐他汀也可在一定程度上提高糖尿病大鼠的机械痛阈,其机制可能与抑制糖尿病大鼠脊髓背角中RAGE/AKT的激活和JNK的磷酸化有关[8]。
本研究中辛伐他汀缓解神经病理性疼痛可能与其改善脊髓微管蛋白紊乱有关。微管相关蛋白是附着于微管多聚体上,参与微管的组装并增加微管的稳定性的蛋白,MAP-2、MAP-4、MAP-6是主要的微管相关蛋白,可与微管结合并调节微管功能。在本研究中,白蛋白结合型紫杉醇可导致大鼠脊髓MAP-2、MAP-4、MAP-6的表达升高,提示微管相关蛋白的异常表达可能与化疗药导致的神经病理性疼痛有关。而辛伐他汀可降低MAP-2、MAP-4、MAP-6的表达,并缓解紫杉醇导致的神经病理性疼痛。既往研究也提示,基因敲除或调控MAP-4的磷酸化能增强微管稳定性[9]。在脊神经结扎导致的神经痛模型中,MAP-2的表达升高,而通过抑制CDK5/MAP2途径可以减轻脊神经结扎导致的神经痛[10]。而MAP-6与认知等功能有关,但是其在疼痛发生发展中的作用及机制未见报道,仍需进一步研究。
辛伐他汀缓解白蛋白结合型紫杉醇导致的神经病理性疼痛可能与其改善脊髓微管蛋白紊乱有关,但潜在机制尚不明确,既往研究提示辛伐他汀是caveolin-1的激动剂之一,而caveolin-1可以与TLR4相互作用,并下游调控炎性因子TNF-α、IL-1β、IL-6的产生与释放,而炎性因子直接参与了神经病理性疼痛的产生。
Caveolin-1是一种细胞表面的膜内在蛋白,在物质转运、信号传导中起一定作用。Caveolin-1也被证实参与多种疼痛的发生。在慢性术后疼痛的模型中,caveolin-1在背根神经节中持续高表达,增加神经元敏感性并改变刺激信号的传递方式[11]。在糖尿病性周围神经病理性疼痛模型中,caveolin-1的磷酸化水平升高,而给予caveolin-1抑制剂可以缓解实验动物的机械性疼痛和热性痛觉过敏[12]。Caveolin-1的表达则受到辛伐他汀的调控[13]。辛伐他汀能够通过下调caveolin-1的表达来增强雄激素受体拮抗剂的抗癌作用[14]。本研究中,给予大鼠白蛋白结合型紫杉醇后,脊髓的caveolin-1、TLR4的表达也升高,而辛伐他汀能降低caveolin-1及TLR4的表达。此外,caveolin-1可以调控TLR4的表达,在肺微血管内皮细胞中,caveolin-1通过Try14磷酸化与TLR4相互作用,进而激活TLR4信号[15]。此外,泛素连接酶ZNRF1可以促进caveolin-1的泛素化,增强TLR4介导的炎症反应[16]。故辛伐他汀可能通过调控cavolin-1/TLR4的表达缓解紫杉醇导致的神经性病理痛。
TLR4与配体结合后能激活下游信号通路,释放炎性因子TNF-α、IL-1β、IL-6等[16]。而炎性因子水平的升高可直接参与紫杉醇介导的神经病理性疼痛的发生,给予TNF-α抑制剂可以缓解紫杉醇导致的神经病理性疼痛[17,18]。本研究也提示白蛋白结合型紫杉醇可导致炎性因子水平的升高,而辛伐他汀可以降低炎性因子的水平,进而缓解神经病理性疼痛。此外,脊髓中的炎性因子主要由激活的小胶质细胞及星形胶质细胞释放,而炎性因子能进一步激活胶质细胞,导致炎性因子水平进一步升高。
综上,辛伐他汀能缓解白蛋白结合型紫杉醇导致的神经病理性疼痛,其保护作用可能与抑制caveolin/TLR4途径、降低下游炎性因子水平、减少微管相关蛋白的表达有关。

