基于miR-181/NF-κB通路的辛伐他汀对结直肠癌小鼠血液高凝状态的改善研究Δ
张 蕊,常 娜,陈 超,赵 萌,李 博
(1.唐山市人民医院药剂科,河北 唐山 063000; 2.唐山市人民医院放化五科,唐山市肿瘤放射治疗学重点实验室,河北 唐山 063000; 3.遵化市人民医院病理科,河北 遵化064299)
结直肠癌(colorectal cancer,CRC)为常见的消化道肿瘤,手术、化疗和放疗是治疗CRC的主要方法,但是临床发现CRC患者机体可能处于高凝状态,并且手术和化疗均可能诱导高凝状态,这不但会影响预后,还会增加肺栓塞的发生风险[1]。辛伐他汀能够通过抑制3-羟基-3-甲基-戊二酰辅酶A还原酶(HMGCR)而降低胆固醇,被广泛用于治疗高胆固醇血症,且安全性良好。近年来,有研究报道HMGCR与肿瘤细胞增殖密切相关[2]。细胞和体内实验结果显示,辛伐他汀可以抑制CRC细胞的增殖和血管生成能力[3]。但其分子机制仍不清楚。此外,有研究结果发现,辛伐他汀具有缓解高凝状态的作用[4]。但其是否具有缓解CRC高凝状态的作用仍不明确。核因子κB(NF-κB)信号转导通路的激活均会诱导其靶基因的过表达,进而促进血管生成,促进结直肠癌细胞的增殖、侵袭和转移;同时,NF-κB通路与机体凝血过程和高凝状态密切相关[5-6]。微小RNA(miRNA)可以通过靶向信使RNA(mRNA)的3′非翻译区(UTR)诱导mRNA降解,研究结果已证实miR-181在CRC中具有促进肿瘤进展的作用[7];并且,miR-181也可以靶向抑制NF-κB通路[8]。本研究主要探讨辛伐他汀对CRC模型小鼠肿瘤生长、血液高凝状态和血管生成情况的影响,并检测miR-181/NF-κB的变化,初步分析分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞:BALB/C裸鼠购自中国上海斯莱克实验动物中心;人CRC细胞系SW480(CCL-228细胞,美国ATCC公司)。
1.1.2 仪器:MVIS-2035型全自动血液流变分析仪(重庆天海医疗设备有限公司);ABI7900型PCR仪(美国ABI公司);CX31型显微镜[奥林巴斯(中国)有限公司]。
1.1.3 药品与试剂:DMEM培养基购自美国Invitrogen公司;PVDF膜购自美国Bio-Rad公司;ECL显色试剂盒购自美国赛默飞世尔公司;酶联免疫吸附试验试剂盒购自上海碧云天生物技术有限公司;TRIzol试剂盒购自美国Sigma公司;MiScript SYBR-Green PCR和miScript kit试剂盒购自德国QIAGEN GmbH公司;SYBR Premix Ex Taq和PrimeScript-RT试剂盒购自日本Takara公司;细胞周期蛋白 D1(CyclinD1)、Ki67和B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)抗体和相应的二抗购自美国Abcam公司;辛伐他汀(江西大地制药有限责任公司,批准文号:国药准字H20059672)。
1.2 分组和建模
将BALB/C裸鼠分为三组,即对照组、辛伐他汀低剂量组和辛伐他汀高剂量组。将DMEM培养基中处于对数生长期的SW480细胞重新配置成浓度为1×107个/mL的溶液,所有小鼠于左侧前肢皮下注射细胞溶液0.2 mL,给药后第7日可以触摸到有瘤体生成提示建模成功。第8日,辛伐他汀低、高剂量组小鼠分别腹腔注射辛伐他汀50、100 mg/kg,1日1次。第28日,小鼠称重后记录体重,然后于小鼠眼眶静脉取血,颈椎脱臼处死小鼠,取出肿瘤组织。
1.3 检测指标和方法
1.3.1 肿瘤生长情况:观察并记录肿瘤生长情况,第28日统计肿瘤体积。用游标卡尺测量瘤体长径和短径,肿瘤体积= [(长径×短径)/2]3×0.523 6。建模后28 d处死小鼠,收集肿瘤组织称取重量。
1.3.2 蛋白质印迹法检测蛋白水平:肿瘤组织研磨后收集总蛋白并通过BCA试剂盒检测浓度。应用SDS-PAGE(110 V,100 min)分离30 μg的总蛋白。PVDF膜转移,添加对应的抗体(1∶500稀释),孵育过夜。室温(25 ℃)下加入HRP标记的二抗(1∶5 000稀释),4 ℃孵育2 h。采用ECL检测蛋白印迹带。GAPDH作为内参。通过检测灰度分析CyclinD1、Ki67、Bcl-2和Bax蛋白相对表达水平。CyclinD1、Ki67表达水平反映肿瘤细胞增殖水平,Bcl-2、Bax表达水平反映肿瘤细胞凋亡水平。
1.3.3 免疫组织化学染色:采用免疫组化染色检测血管标志蛋白CD34,分析肿瘤组织中的微血管密度[9]。肿瘤组织固定脱水,石蜡包埋,切片(4 μm)。加入3%H2O2,室温静置20 min,加入CD34抗体(1∶400稀释),37 ℃孵育1 h;洗涤后加入山羊抗兔IgG聚合物100 μL于室温下孵育50 min;洗涤后加入DAB显色液,苏木精染色孵育20 s,冲洗后显微镜观察,检测染色部位面积占总视野面积的比例,计算百分比为微血管密度。检测血管内皮生长因子(VEGF)的方法同CD34,通过半定量法确定染色强度,根据染色深浅评分为0~3分,根据染色范围评分为0~4分,两者相乘得到最终免疫组化得分。
1.3.4 定量反转录聚合酶链反应(qRT-PCR)检测miR-181、NF-κB抑制蛋白α(IκBα)和NF-κB mRNA表达:通过TRIzol试剂盒提取肿瘤组织总RNA,利用miScript试剂盒将miR-181合成互补DNA,采用MiScript SYBR-Green PCR试剂盒进行qPCR实验,内参为U6。采用SYBR Premix Ex TaqTM和PrimeScript-RT试剂盒进行反转录(反应条件:60 min/42 ℃,5 min/70 ℃,4 ℃下保存)和qPCR(反应条件:95 ℃/10 min,40个循环,94 ℃/15 s,60 ℃/1 min,60 ℃/1 min,4 ℃下保存)实验,内参为GAPDH。通过比较循环阈值(ΔΔCt)分析RNA的表达水平。
1.3.5 CRC模型小鼠凝血功能检测:留取小鼠血液样本,采用全自动动物血液分析仪检测活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)和全血黏度。
1.4 统计学方法
2 结果
2.1 辛伐他汀对CRC模型小鼠肿瘤的影响
建模后第28日,辛伐他汀高剂量组小鼠的肿瘤体积和重量明显低于辛伐他汀低剂量组,且辛伐他汀高、低剂量组小鼠的肿瘤体积和重量明显低于对照组,差异均有统计学意义(P<0.05),见表1。
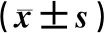
表1 辛伐他汀对CRC裸鼠肿瘤体积和重量的影响
2.2 辛伐他汀对CRC裸鼠模型细胞增殖的影响
辛伐他汀高剂量组小鼠Ki67、CyclinD1蛋白水平明显低于辛伐他汀低剂量组,且辛伐他汀高、低剂量组小鼠Ki67、CyclinD1蛋白水平明显低于对照组,差异均有统计学意义(P<0.05),见图1、表2。

表2 辛伐他汀对CRC裸鼠CyclinD1和Ki67蛋白的影响
A.对照组;B.辛伐他汀低剂量组;C.辛伐他汀高剂量组A. control grou; B. simvastatin low-dose group; C. simvastatin high-dose group
2.3 辛伐他汀对CRC模型裸鼠细胞凋亡蛋白表达的影响
抗凋亡蛋白Bcl-2和凋亡蛋白Bax检测结果表明,辛伐他汀高剂量组小鼠肿瘤组织中Bax表达水平明显高于辛伐他汀低剂量组,而Bcl-2表达水平明显低于辛伐他汀低剂量组;且辛伐他汀高、低剂量组小鼠肿瘤组织中Bax表达水平明显高于对照组,而Bcl-2表达水平明显低于对照组,上述差异均有统计学意义(P<0.05),见图2、表3。
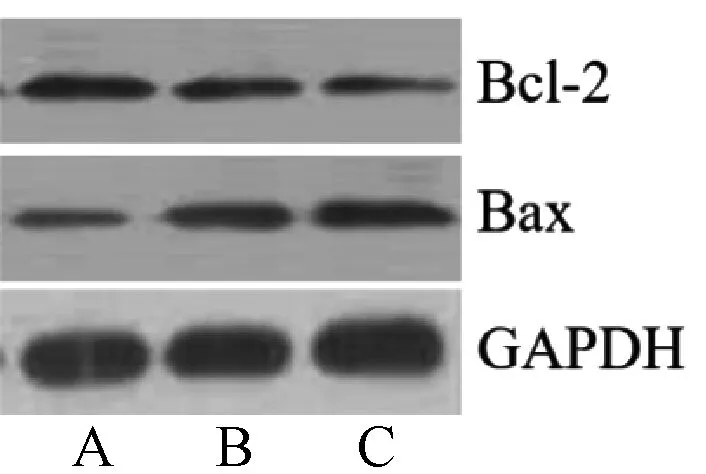
A.对照组;B.辛伐他汀低剂量组;C.辛伐他汀高剂量组A.control grou; B.simvastatin low-dose group; C.simvastatin high-dose group
表3 辛伐他汀对CRC裸鼠Bcl-2和Bax蛋白的影响
2.4 辛伐他汀对CRC裸鼠模型微血管密度的影响
辛伐他汀高剂量组小鼠微血管密度明显低于辛伐他汀低剂量组,且辛伐他汀高、低剂量组小鼠微血管密度均低于对照组,差异均有统计学意义(P<0.05),见图3、表4。图3中,蓝色为细胞核,棕色为CD34阳性染色,表示微血管。
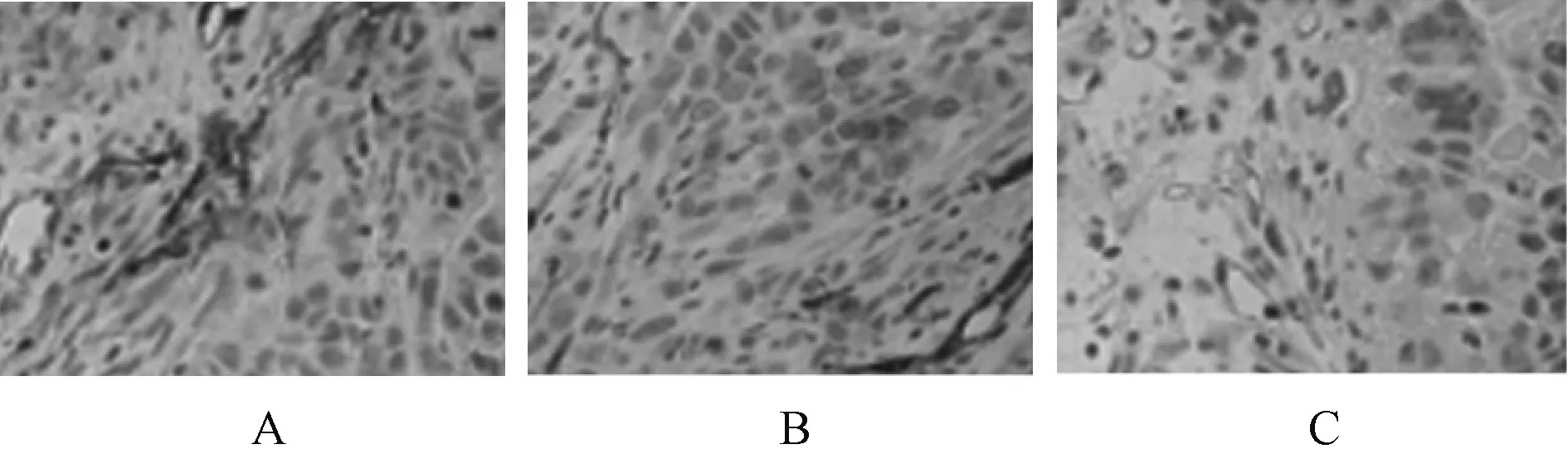
A.对照组;B.辛伐他汀低剂量组;C.辛伐他汀高剂量组A.control grou; B.simvastatin low-dose group; C.simvastatin high-dose group
表4 辛伐他汀对CRC裸鼠微血管密度的影响
2.5 辛伐他汀对CRC裸鼠模型VEGF的影响
辛伐他汀高剂量组小鼠VEGF水平明显低于辛伐他汀低剂量组,且辛伐他汀高、低剂量组小鼠VEGF水平均低于对照组,差异均有统计学意义(P<0.05),见图4、表5。图4中,蓝色为细胞核,棕色为VEGF阳性颜色。

A.对照组;B.辛伐他汀低剂量组;C.辛伐他汀高剂量组A. control grou; B. simvastatin low-dose group; C. simvastatin high-dose group
表5 辛伐他汀对CRC裸鼠VEGF水平的影响分)
2.6 辛伐他汀对CRC裸鼠模型血液流变学指标的影响
三组小鼠血液流变学指标比较,差异均有统计学意义(P<0.05)。与对照组比较,辛伐他汀低、高剂量组小鼠的全血黏度降低,PT和APTT延长,差异均有统计学意义(P<0.05);且辛伐他汀高剂量组小鼠的全血黏度低于辛伐他汀低剂量组,PT和APTT长于辛伐他汀低剂量组,差异均有统计学意义(P<0.05),见表6。
表6 辛伐他汀对CRC裸鼠血液流变学指标的影响
2.7 辛伐他汀对CRC裸鼠模型miR-181、IκBα和NF-κB mRNA和蛋白表达的影响
三组小鼠miR-181、IκBα和NF-κB mRNA表述水平比较,差异均有统计学意义(P<0.05)。辛伐他汀低、高剂量组小鼠的miR-181表达水平显著高于对照组,IκBα和NF-κB mRNA表达水平显著低于对照组,差异均有统计学意义(P<0.05);
且辛伐他汀高剂量组小鼠的miR-181表达水平显著高于辛伐他汀低剂量组,IκBα和NF-κB mRNA表达水平显著低于辛伐他汀低剂量组,差异均有统计学意义(P<0.05),见表7。三组小鼠IκBα和NF-κB蛋白表述水平比较,差异均有统计学意义(P<0.05)。辛伐他汀高剂量组小鼠NF-κB、IκBα蛋白表达水平低于低剂量组,辛伐他汀低、高剂量组小鼠的IκBα和NF-κB 蛋白表达水平低于对照组,差异均有统计学意义(P<0.05),见图5、表8。
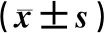
表7 辛伐他汀对CRC裸鼠IκBα、NF-κB mRNA表达的影响
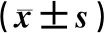
表8 辛伐他汀对CRC裸鼠IκBα、NF-κB蛋白表达的影响
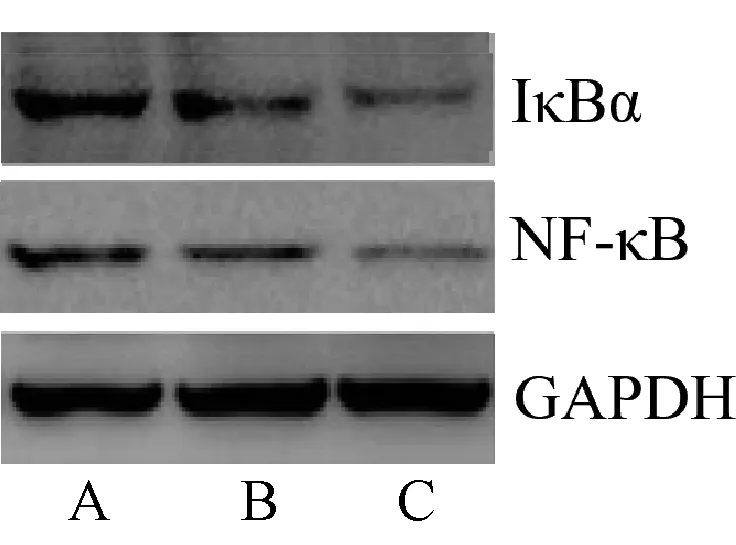
A.对照组;B.辛伐他汀低剂量组;C.辛伐他汀高剂量组A.control grou; B.simvastatin low-dose group; C.simvastatin high-dose group
3 讨论
一项全球性的统计结果显示,2018年结肠和直肠原发性肿瘤患者分别为1 096 601例和704 376例,分别占所有肿瘤患者的6.1%和3.9%,分别居第4位和第8位;每年死于结肠癌和直肠癌的患者分别占所有肿瘤患者的5.8%和3.2%,分别居第5位和第10位[10]。虽然新的诊断和治疗CRC的方法被不断应用于临床,但是CRC患者的生存情况仍不能令人满意。在临床上,CRC转移是导致治疗失败的主要因素,会使生存率降低。此外,CRC患者的高凝状态也会显著影响手术预后[11]。但目前临床上尚无可以有效抑制CRC和缓解高凝状态的特效药物。
有研究结果显示,他汀类药物具有抗肿瘤作用,与未使用他汀类药物者相比,使用他汀类药物者的全因死亡率和恶性肿瘤特异性死亡率降低了15%[12]。临床前研究结果表明,辛伐他汀在抑制肿瘤增殖、诱导细胞凋亡和抑制肿瘤转移中起着重要的作用[13-14]。本研究通过皮下注射的方法构建了CRC小鼠模型,并通过辛伐他汀干预,发现辛伐他汀能够抑制细胞增殖,减少血管生成,抑制肿瘤组织生长,促进肿瘤细胞凋亡,并存在一定的剂量依赖性。HMGCR为内质网驻留酶,研究结果显示,其可以促进肿瘤血管生成,从而抑制肿瘤的转移[15]。作为HMGCR抑制剂,辛伐他汀在CRC中也发挥抑癌作用。一项单臂Ⅱ期临床研究结果显示,在XELOX方案(卡培他滨+奥沙利铂)和贝伐单抗的基础上联合辛伐他汀作为CRC患者一线化疗方法,具有优秀的抗肿瘤效果[16]。血管生成是CRC细胞转移的关键,肿瘤细胞会通过新生的血管系统进入血液循环,并定植于肺部等部位[17]。Wang等[18]的研究结果显示,辛伐他汀可激活AMP活化蛋白激酶通路和抑制缺氧诱导因子-1α的水平,抑制乳腺癌的血管生成。此外,辛伐他汀还具有抗凝作用。赵涛等[19]的研究结果显示,辛伐他汀可以降低急性心肌梗死患者的全血黏度,延长PT。有研究结果显示,口服辛伐他汀会明显降低接受结直肠手术患者的高凝状态[20]。本研究结果发现,辛伐他汀可以剂量依赖性地抑制CRC细胞的增殖和血管生成,并诱导细胞凋亡,从而抑制小鼠模型的肿瘤生长,并且可以剂量依赖性地缓解CRC模型小鼠的高凝状态,但其分子机制仍需进一步分析。
基因表达的转录调控机制是近年来的研究热点,miRNA可通过碱基配对识别并结合mRNA,进而诱导mRNA的降解或者抑制翻译[21]。miR-181是近年来新发现的与恶性肿瘤发生发展密切相关的miRNA,研究结果显示,其具有抑制结直肠肿瘤进展的作用[22]。体外研究结果也证实,miR-181会抑制CRC细胞的增殖[23]。miR-181具有靶向调控NF-κB通路的作用,如卵巢癌中,miR-181通过抑制NF-κB通路蛋白水平发挥抗肿瘤作用[24]。Zhu等[25]的研究结果显示,miR-181通过抑制NF-κB通路调控炎症反应。研究结果显示,在2型糖尿病患者中,血浆miR-181与凝血状态呈负相关,miR-181会调控D-二聚体的水平并缓解高凝状态和减少血栓形成[26]。NF-κB信号通路参与脂多糖诱导的细胞凝血和纤溶因子表达异常,从而导致高凝状态[27]。王慧莲等[28]的研究结果显示,NF-κB会通过促进炎症反应,引起类风湿关节炎患者血液高凝状态,而miR-155通过靶向调控NF-κB通路缓解高凝状态。本研究结果显示,辛伐他汀可以促进miR-181表述,抑制NF-κB通路中IκBα、NF-κB mRNA和蛋白的水平,且呈剂量依赖性。提示辛伐他汀可能通过诱导miR-181的表达和抑制NF-κB通路来抑制CRC小鼠模型的肿瘤生长和血管生成,并缓解高凝状态。
综上所述,在CRC裸鼠模型中,辛伐他汀不但可以诱导CRC细胞的凋亡和抑制血管生成,还可以缓解高凝状态,其作用可能与miR-181/NF-κB有关。但是,关于辛伐他汀在CRC中的作用和调控miR-181/NF-κB的分子机制仍需要进一步研究。

