miR⁃218⁃5p靶向VEGFA基因促进宫颈癌HeLa细胞凋亡并抑制迁移
王旭 徐静 王笑笑 杜亚飞
河北医科大学第一医院妇产科(石家庄 050000)
宫颈癌又称子宫颈癌,系指发生在宫颈阴道部或移行带的鳞状上皮细胞及宫颈管内膜的柱状上皮细胞交界处的恶性肿瘤[1]。miRNA 是小分子非编码RNA,miR⁃218⁃5p 是miRNA 的一种,参与调控人类多种肿瘤的发展进程[2]。miR⁃218⁃5p 在胃癌中表达下调,起到潜在的抑癌作用,可能成为新的治疗靶点和预后标志物[3]。还有研究[4]结果显示,miR⁃218⁃5p 在宫颈癌患者尿液、血清及组织中低表达,过表达miR⁃218⁃5p 可抑制宫颈癌细胞增殖和侵袭,并促进细胞凋亡。血管内皮生长因子A(VEGFA)也参与了多种癌症的进程,如lncRNA⁃CP 通过调控HIF⁃1α/VEGFA 轴影响肾透明细胞癌侵袭、迁移[5]。过表达VEGFA影响人肝癌HepG2 细胞生长[6]。通过miRcode 预测显示VEGFA 是miR⁃218⁃5p 靶基因,但是关于miR⁃218⁃5p 和VEGFA 调控对宫颈癌细胞的研究尚不清楚,因此,本实验主要探究miR⁃218⁃5p 靶向VEGFA 基因对宫颈癌HeLa 细胞凋亡和迁移的影响。
1 材料与方法
1.1 材料正常宫颈上皮细胞NC104 和宫颈癌细胞株HeLa、CaSki、C33A 和SiHa 购自美国ATCC 公司;胎牛血清、RPMI⁃1640 培养基购自美国Gibco 公司;逆转录试剂盒、SYBR Premix Ex Taq 试剂盒购自大连宝生物公司;Annexin V⁃FITC/PI 凋亡检测试剂盒购自北京天根生化科技公司;Transwell 小室购自北京索莱宝生物公司;二辛可宁酸(BCA)试剂盒购自上海艾博抗生物公司。
1.2 方法
1.2.1 细胞培养和分组宫颈癌细胞株HeLa、CaSki、C33A 和HeLa 接种于含适量RPMI⁃1640 培养液(10%胎牛血清)的培养瓶中,在37 ℃、5%CO2条件下培养,当细胞密度达到80%~90%左右时进行消化传代,取对数生长期细胞用于实验。将miR⁃NC、anti⁃miR⁃NC、miR⁃218⁃5p、anti⁃miR⁃218⁃5p、si⁃NC、si⁃VEGFA、miR⁃NC 和pcDNA⁃VEGFA、miR⁃218 和pcDNA⁃VEGFA 转染至HeLa 细胞,分别作为miR⁃NC组、anti⁃miR⁃NC组、miR⁃218⁃5p组、anti⁃miR⁃218⁃5p 组、si⁃NC 组、si⁃VEGFA 组、miR⁃NC+pcDNA⁃VEGFA 组、miR⁃218⁃5p+pcDNA⁃VEGFA 组。
1.2.2 RT⁃qPCR 分析miR⁃218 和VEGFA 表达TRIzol 试剂提取细胞总RNA,利用逆转录试剂盒合成第一链cDNA,利用SYBR Premix Ex Taq试剂盒进行RT⁃qPCR扩增,2⁃ΔΔCT法计算miR⁃218⁃5p(U6为内参对照)和VEGFA(GAPDH为内参对照)相对表达量。
1.2.3 流式细胞术检测细胞凋亡用结合缓冲液调整各组细胞浓度为2 × 105个/mL。取5 μL 的Annexin V⁃FITC 加入细胞悬液中,再加入5 μL 的PI,在室温下暗室孵育1 h。流式细胞分析染色情况,计算细胞凋亡率。
1.2.4 Transwell 实验分析迁移能力收集细胞,重悬于无血清RPMI⁃1640 培养基中。取200 μL 细胞悬液加入Transwell 上腔室,取500 μL 含10%胎牛血清的RPMI⁃1640 加入下室作为化学引诱剂。培养箱孵育24 h,除去未迁移细胞,Transwell 小室下表面用95%乙醇室温固定15 min,结晶紫室温染色15 min,计算迁移细胞数。
1.2.5 Western blot 检测相关蛋白表达RIPA 裂解液细胞中总蛋白,以SDS⁃PAGE 电泳分离细胞蛋白,并转移PVDF 膜上。之后加入一抗溶液,4 ℃孵育膜过夜,之后用二抗室温孵育膜1 h。化学发光显色后,ImageJ 软件分析免疫反应条带的灰度值。
1.2.6 双荧光素酶报告实验miRcode 预测显示VEGFA mRNA 的3'⁃UTR 区域含有的互补序列,将含有miR⁃218⁃5p 结合位点的野生WT⁃VEGFA 序列或突变MUT⁃VEGFA 系列插入到荧光素酶报告质粒获得荧光素酶报告载体。将野生型VEGFA 荧光素酶报告载体(WT⁃VEGFA)、突变型VEGFA 荧光素酶报告载体(MUT⁃VEGFA)与miR⁃218⁃5p mimics、miR⁃NC 分别共转染HeLa 细胞,检测细胞相对荧光素酶活性。
1.3 统计学方法所有实验均设置3 个平行实验,独立重复3 次。SPSS 20.0 进行统计学分析,数据以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析和LSD⁃t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 宫颈癌细胞中miR⁃218⁃5p 和VEGFA 表达与正常宫颈上皮细胞NC104 比较,宫颈癌细胞HeLa、CaSki、C33A 和SiHa 中miR⁃218⁃5p 表达降低,VEGFA mRNA 表达升高(t =22.063、20.402、18.965、16.713、14.737、14.610、15.524、13.519,均P<0.01)。以HeLa 细胞最为明显,因此选择HeLa细胞进行后续实验。见图1。

图1 宫颈癌细胞中miR⁃218⁃5p 和VEGFA 表达Fig.1 Expression of miR⁃218⁃5p and VEGFA in cervical cancer cells
2.2 过表达miR⁃218⁃5p 对宫颈癌细胞凋亡和迁移的影响与miR⁃NC 组比较,miR⁃218⁃5p 组细胞miR⁃218⁃5p 表达升高,细胞凋亡率、Bax 蛋白表达升高,细胞迁移数、Bcl⁃2、MMP2、MMP9 蛋白表达降低(t= 15.638、28.950、14.205、46.396、14.445、15.974、17.820,均P<0.01)。见图2。
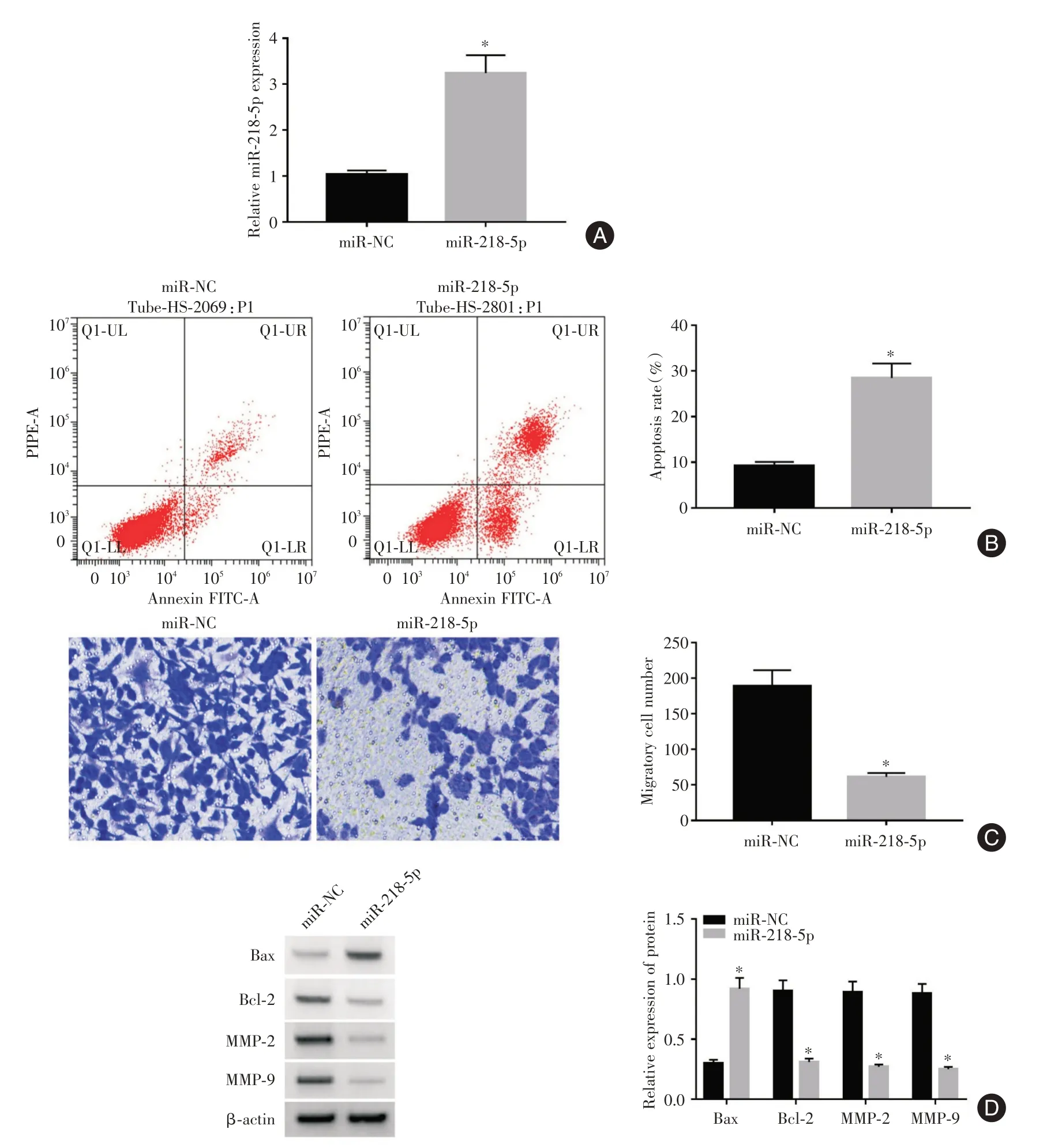
图2 过表达miR⁃218⁃5p 对宫颈癌细胞凋亡和迁移的影响Fig.2 Effects of overexpression of miR⁃218⁃5p on apoptosis and migration of cervical cancer cells
2.3 抑制VEGFA 表达对宫颈癌细胞凋亡和迁移的影响与si⁃NC 组比较,si⁃VEGFA 组细胞VEG⁃FA mRNA 表达降低,细胞凋亡率、Bax 蛋白表达升高,细胞迁移数、Bcl⁃2、MMP2、MMP9 蛋白表达降低(t= 15.604、30.009、14.708、56.389、16.480、17.508,均P<0.01)。见图3。

图3 抑制VEGFA 表达对宫颈癌细胞凋亡和迁移的影响Fig.3 The effect of inhibiting VEGFA expression on apoptosis and migration of cervical cancer cells
2.4 miR⁃218⁃5p 靶向调控VEGFA 表达StarBase预测结果得出,miR⁃218⁃5p 与VEGFA 存在靶向结合关系,见图4A。双荧光素酶活性检测结果,miR⁃218⁃5p mimics 和WT⁃VEGFA 共转染后细胞的相对荧光素酶活性与miR⁃NC 和WT⁃VEGFA 共转染后比较降低(t=13.729,P<0.01);miR⁃218⁃5p mimics和MUT⁃VEGFA 共转染后细胞的相对荧光素酶活性与miR⁃NC 和MUT⁃VEGFA 共转染后比较无显著变化(t=0.567,P=0.694),见图4B。与miR⁃NC 组比较,miR⁃218⁃5p 组细胞VEGFA mRNA 表达降低(t = 16.207,P < 0.01);与anti⁃miR⁃NC 比较,anti⁃miR⁃218⁃5p 组细胞VEGFA mRNA 表达升高(t =16.477,P<0.01),见图4C。

图4 miR⁃218⁃5p 靶向调控VEGFA 表达Fig.4 MiR⁃218⁃5p targeted regulation of VEGFA expression
2.5 上调VEGFA 表达可以逆转miR⁃218⁃5p 过表达对宫颈癌细胞凋亡和迁移的影响与miR⁃218⁃5p+pcDNA⁃NC 组比较,miR⁃218⁃5p+pcDNA⁃VEGFA组细胞VEGFA mRNA 表达升高,细胞凋亡率、Bax蛋白表达降低,细胞迁移数、Bcl⁃2、MMP2、MMP9蛋白表达升高(t= 15.387、37.358、17.350、64.723、16.260、18.335、16.307,均P<0.01)。见图5。
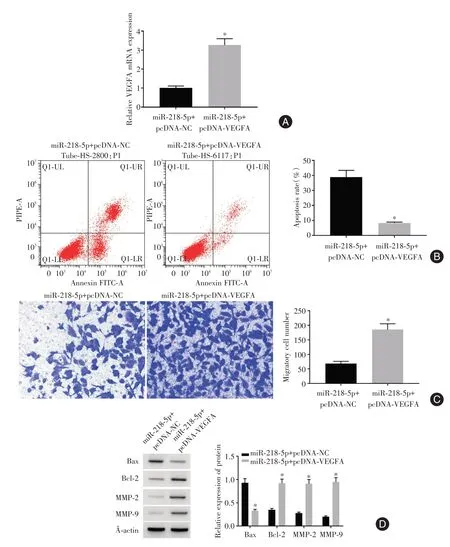
图5 上调VEGFA 表达可以逆转miR⁃218⁃5p 过表达对宫颈癌细胞凋亡和迁移的影响Fig.5 Up⁃regulation of VEGFA expression can reverse the effects of miR⁃218⁃5p overexpression on apoptosis and migration of cervical cancer cells
3 讨论
宫颈癌指发生在子宫阴道部及宫颈管的恶性肿瘤,是女性常见恶性肿瘤之一,发病率位于女性肿瘤的第二位,发病原因目前尚不清楚,目前治疗方案以手术和放射治疗为主,亦可采用中西医综合治疗,但中晚期患者治愈率很低[7]。极早诊断有利于宫颈癌预后改善,并降低其病死率和病发率。
近年研究发现,miRNA 与癌症发生发展密切相关,miR⁃218⁃5p 是一种抑癌基因,已有研究证实miR⁃218⁃5p 在胰腺癌、膀胱癌、口腔鳞癌中表达下调,上调miR⁃218⁃5p 表达可通过靶向下调PPME1、CCNE2/SMC4、LPCAT1 进而抑制这些肿瘤细胞增殖、迁移和侵袭,并诱导细胞凋亡,说明miR⁃218⁃5p 作为抑癌基因阻碍肿瘤发展进程[8]。有研究结果显示,miR⁃218⁃5p 在宫颈癌中表达下调,miR⁃218⁃5p 可通过靶向LYN/NF⁃κB 信号通路抑制宫颈癌细胞增殖、迁移和侵袭,提示miR⁃218⁃5p 有望成为宫颈癌潜在标记物[9]。本研究结果表明,宫颈癌细胞系(HeLa、CaSki、C33A、SiHa)中miR⁃218⁃5p 表达降低,过表达miR⁃218⁃5p 可降低宫颈癌HeLa 细胞迁移细胞数,增加细胞凋亡率,而Bax 蛋白表达上调,Bcl⁃2、MMP2、MMP9 蛋白表达下调,提示过表达miR⁃218⁃5p 可促进宫颈癌HeLa 细胞凋亡和抑制迁移,可作为抑癌基因参与宫颈癌发生发展。
为进一步探究miR⁃218⁃5p 抑制宫颈癌细胞侵袭且诱导细胞凋亡的分子机制,本研究通过miR⁃code 预测显示VEGFA 是miR⁃218⁃5p 靶基因,双荧光素酶报告实验和RT⁃qPCR 实验首次证实了miR⁃218⁃5p 可靶向负调控VEGFA。VEGF 家族成员众多,而VEGFA 是其主要成员,与机体生长发育、转移、血管形成、迁移等相关,目前的研究显示,VEGFA 在宫颈癌组织中表达上调,受上游多个miRNA 调控,进而参与宫颈癌发展[10-12]。本研究结果显示,宫颈癌细胞系(HeLa、CaSki、C33A、SiHa)中VEGFA 表达升高,抑制VEGFA 可降低宫颈癌HeLa 细胞迁移细胞数,增加细胞凋亡率,而Bax 蛋白表达上调,Bcl⁃2、MMP2、MMP9 蛋白表达下调,提示抑制VEGFA 抑制宫颈癌细胞迁移和诱导细胞凋亡。本研究恢复试验结果显示,上调VEGFA 逆转上调miR⁃218⁃5p 对宫颈癌细胞凋亡和迁移的影响,进一步提示miR⁃218⁃5p 通过靶向下调VEGFA 来发挥抗宫颈癌作用。
综上所述,miR⁃218⁃5p 靶向下调VEGFA 促进宫颈癌细胞凋亡并抑制细胞迁移,miR⁃218⁃5p 有可能成为宫颈癌治疗的分子靶点。本研究只着重研究体外实验研究,关于体内动物实验及miR⁃218⁃5p 调控下游mRNA 或信号通路需要进行后续实验研究。

