宫颈癌的免疫治疗:精准医学的到来
张颖 吴月玲
广东医科大学附属医院妇产医学中心(广东湛江 524001)
宫颈癌是威胁全球女性健康的恶性肿瘤之一,2020年全球宫颈癌新发病例约60.4 万,其中我国宫颈癌新发病例近11 万,病死例数4.77 万,分别约占全球发病和病死总数的18.3%和17.6%[1]。根据患者的疾病分期和临床病理,初步诊断后的一线治疗包括手术、同期放化疗、单独放疗及序贯放化疗,虽然早期宫颈癌大多可治愈,但晚期及复发转移性宫颈癌患者的治疗选择有限,手术治疗晚期及复发转移性宫颈癌患者效果甚微,目前多以放化疗或者单纯放疗或者序贯放化疗等方式相结合用于临床治疗,主要分为体外放射治疗以及近距离放射治疗,但由于放疗对当地医疗资源要求高以及目前临床对放疗药物剂量研究的局限性,放疗的应用还不是十分成熟[2]。所以长期以来,铂类化疗联合或不联合贝伐单抗一直是晚期及转移性宫颈癌化疗的一线标准治疗方案,但数据表明5年生存率仅为17%[3-4],特别是在含铂一线治疗进展后,单用顺铂和顺铂联合治疗的有效率分别为13%和36%[5],以此为基础的晚期宫颈癌患者复发率可达20%[6]。因此,晚期及复发转移性宫颈癌患者的治疗一直是诊治的难点。
近年来,免疫治疗在不同的恶性肿瘤患者中取得了突破性进展,已有研究表明[7],免疫治疗可以在宫颈癌中诱导强烈的免疫反应,且更有效、更特异性地靶向癌细胞,为改善宫颈癌患者的治疗和生存提供了希望。因此,为了给晚期宫颈癌患者的诊治提供新思路,本文将以宫颈癌免疫治疗特别是免疫检查点抑制剂治疗的发展及机制为切入点,结合其临床试验的结果,对目前宫颈癌免疫治疗的现状及困境进行探讨。
1 免疫治疗的发展及机制
免疫治疗至今已有百年沉浮史,直到2018年,美国及日本免疫学家在癌症疗法以及免疫负调控的抑制领域所作出的贡献被授予诺贝尔生理学或医学奖,从此,免疫治疗进入大众视野并呈快速发展阶段。
恶性肿瘤患者进行免疫治疗主要是基于免疫循环,即癌细胞在人体内释放抗原并呈递,启动和激活免疫反应,至T 细胞向肿瘤细胞迁移,并识别和杀伤肿瘤细胞这个过程。而在这个循环中,使用不同药物在不同的步骤进行干预以达到刺激或抑制免疫效应的目的,就是免疫治疗。其中根据作用机制的不同,免疫治疗主要包括免疫检查点抑制剂、过继T 细胞免疫疗法、抗体⁃药物偶联物、治疗性HPV 疫苗等,而针对宫颈癌的多种免疫治疗方法目前大多数都已经进入临床试验阶段(图1)。
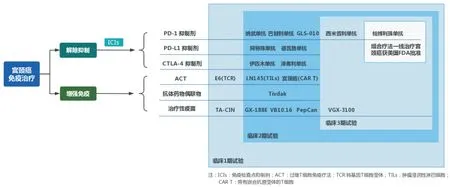
图1 宫颈癌的多种免疫治疗方法Fig.1 Multiple immunotherapy approaches for cervical cancer
目前在实体瘤中研究最为广泛的是免疫检查点抑制剂治疗,主要包括PD⁃1(程序性细胞死亡蛋白1)/PD⁃L1(程序性细胞死亡蛋白配体1)抗体和CTLA4(细胞毒性T 淋巴细胞抗原4)抗体的治疗。PD⁃1 主要表达于T 细胞表面,PD⁃L1 广泛表达于各个组织中,包括肿瘤细胞以及肿瘤微环境中的其他细胞,二者结合可以抑制T 细胞杀伤作用,达到负向免疫调节作用[8]。在正常组织中,这个负向调节机制可以保护机体不被外界攻击,而在肿瘤微环境中,这种负向调节被肿瘤细胞利用以达到免疫逃逸的目的。因此,使用PD⁃1/PD⁃L1 抗体,其竞争性的与PD⁃1 或PD⁃L1 结合,避免T 细胞的活化被抑制,恢复T 细胞的抗肿瘤活性,从而杀死癌细胞,就是免疫治疗最为热点的治疗方法之一。另外,CTLA4 也是常见的靶向分子,通过与CD28竞争性与宫颈癌细胞上的B7 结合,当CD28⁃B7 的表达比CTLA⁃4⁃B7 少时,将无法激活T 细胞。另一方面,CTLA⁃4 还通过下调宫颈癌细胞上B7 的表达调节T 细胞。由此可见,免疫治疗在宫颈癌的治疗中存在着巨大的潜力,而对于PD⁃1/PD⁃L1 抗体的深入研究,使其有望成为宫颈癌治疗的新方向[9]。
2 宫颈癌的免疫治疗
研究表明,大多数的宫颈癌患者有人乳头状瘤病毒(HPV)感染[10],对大多数人来说,这种感染可以被彻底清除,但是持续性的HPV 感染,特别是高危型HPV16 型和18 型感染更有可能被整合到宿主基因组中,从而导致癌蛋白E6 和E7 的过度表达,这些癌蛋白通过下调关键途径,干扰自然免疫应答[11]。有研究指出,HPV 的长期感染与宫颈癌的发生密切相关,并显著影响肿瘤组织中PD⁃L1的表达[12]。研究发现,PD⁃L1 是宫颈癌获得HPV感染的生物标志物,HPV 阳性与PD⁃L1 表达增加呈正相关关系及CD8+T 细胞在PD⁃L1 阳性区域表达增加,说明HPV 病毒感染可能通过抑制免疫活化达到使宫颈病变的目的。同时,有研究发现,PD⁃1/PD⁃L1 在宫颈癌中表达显著增强。据数据统计:宫颈癌患者的肿瘤间质组织中46.9%~60.8%存在PD⁃1 阳性表达,宫颈癌患者的34.4%~96%存在PD⁃L1 阳性表达。这些结果似乎说明了PD⁃1/PD⁃L1 抑制剂在HPV 感染的宫颈癌中潜在的治疗效果。
接下来,笔者回顾了两项有关宫颈癌免疫治疗的临床试验结果。帕博利珠单抗(pembrolizumab)单药在宫颈癌中的应用即KEYNOTE⁃028 研究[13],纳入了24 例复发/不可切除的晚期宫颈癌患者,给予帕博利珠单抗,10 mg/kg,每2 周1 次治疗,客观缓解率(ORR)达到了17%,6 个月无进展生存(PFS)率为13%,6 个月总生存(OS)率为66.7%。
基于以上研究,进一步开展了KEYNOTE⁃158[14-15]Ⅱ期篮子研究,纳入了98例先前经过系统治疗的晚期宫颈癌患者,其中97 例分期为Ⅲ-Ⅳ期,83.7%(82例)患者的PD⁃L1蛋白阳性,治疗方案为帕博利珠单抗,200 mg,每3 周1 次治疗,ORR 为12.2%,6 个月PFS 率为25%,6 个月OS 率达到了75.2%。
两项研究的结论指出:(1)PD⁃L1 阳性表达的患者治疗效果好,有效率达14.6%,而PD⁃L1 阴性的患者治疗效果不佳(有效率0%);(2)单药的副反应主要是甲状腺功能减退,疲乏,食欲减退等,副作用可以接受。这个结果虽然不理想,但对无药可救的晚期复发和转移的宫颈癌患者来说,总归有新药可以使用了。且以上两项研究证明,帕博利珠单抗对晚期/复发性宫颈癌具有一定的抗肿瘤效果。对于帕博利珠单抗而言,PD⁃L1 的表达或可作为潜在的预测治疗效果的标志物。因此2019年NCCN 指南也采纳了这个证据,即推荐帕博利珠单抗用于化疗中或化疗后疾病进展、PD⁃L1表达(综合阳性评分≥1)阳性的复发或转移性宫颈癌的二线治疗。
3 宫颈癌免疫治疗的应用
如前文所述,HPV 相关的宫颈癌患者可以进行免疫治疗,特别对于晚期和复发转移及不可切除的宫颈癌患者,PD⁃L1(CPS≥1)可用免疫检查点抑制剂治疗。而对于非HPV 感染引起的宫颈癌患者,目前相关的基础研究不多。但总体来讲,在非HPV 感染的宫颈癌患者中,肿瘤微环境是一种非炎症性的状态。但肿瘤抗原在这种环境中也是存在的。通过免疫调控,增强抗肿瘤T 细胞的激活,消除和阻断免疫抑制细胞和免疫抑制分子,也可让PD⁃1/PD⁃L1 抑制剂的治疗变得有效。今后还需要更多的研究。
而早期宫颈癌患者的免疫治疗研究较少。对于Ⅰ期宫颈癌,手术治疗后5年生存率能达到95%左右,接近治愈,IB 期也可以达到80%左右,也算理想。另一方面,早期肺癌使用PD⁃1 抑制剂的临床试验结果表明[16],博利珠单抗治疗早期可切除NSCLC 患者的反应率高于晚期NSCLC 患者的反应率,效果更佳。因此,免疫治疗对于早期宫颈癌患者的应用效果也值得期待。目前已经有新辅助治疗以及辅助治疗开展了PD⁃1 抑制剂的研究[17],并取得了不错的结果,未来期待通过免疫治疗或联合治疗最终能取代手术和放化疗。
4 宫颈癌免疫治疗的现状及困境
肿瘤的高突变负荷(tumor mutation burden,TMB)、微卫星不稳定性(microsatellite instability,MSI)等多种分子特征有力地支持了免疫治疗在宫颈癌中的应用[18]。宫颈癌是一种具有高TMB 的肿瘤,肿瘤突变负荷越高,则认为该瘤种在突变过程中可释放更多的肿瘤免疫抗原供免疫细胞识别,因而免疫治疗效果可能更好[19]。近年来,宫颈癌靶向免疫系统的各种治疗方法取得了许多突破性的结果[20-22],除上面讲述的免疫检查点抑制剂外,针对宫颈癌的多种免疫治疗方法目前已经进入临床试验的阶段(图1)[23]。
总体来说,免疫治疗单药有效率低,业界也开始尝试联合疗法,这些研究的联合方式主要采取的是已有的治疗手段(如免疫、放疗、化疗或靶向治疗等)以期达到更高的反应率。因此,多项一线化疗联合免疫治疗的临床试验正在进行中,其中最受关注的是KEYNOTE⁃826 的3 期临床研究[24],该研究纳入全球19 个国家151 地区持续性、复发转移子宫颈癌患者617 例,研究结果显示,帕博利珠单抗联合化疗±贝伐珠单抗对比安慰剂能延长PD⁃L1 阳性、持续性、复发转移性宫颈癌患者的PFS 和OS,PD⁃L1 阳性患者尤其CPS > 10 患者获益更明显。基于该研究,2021年美国FDA 批准帕博利珠单抗联合铂类化疗(加或不加贝伐单抗),用于一线治疗经FDA 批准的检测方法证实为肿瘤表达PD⁃L1(CPS ≥1)的持续性、复发性或转移性的宫颈癌患者[25]。同时2022年宫颈癌NCCN 指南指出,对于复发转移性宫颈癌(鳞状细胞癌、腺癌或腺鳞癌)的一线联合治疗,推荐PD⁃L1 阳性患者首选抗PD⁃1 抗体或PD⁃1 抑制剂联合化疗和贝伐珠单抗治疗[26]。但是,虽然KEYNOTE⁃826 研究为复发转移和晚期宫颈癌患者的治疗带来了希望,但延长PFS 也仅2 个月左右,2年OS 率仅增加10%,即使加上PD⁃1,中位生存期也仅仅为10 个月左右。因此,晚期及复发转移子宫颈癌患者的治疗还有很长的路要走。
5 总结
晚期及复发转移宫颈癌预后差,治疗效果不理想。目前NCCN 指南在一线治疗及二线治疗均推荐免疫治疗在这类患者中的应用,但免疫检查点抑制剂单药的临床应用仍应持有谨慎乐观的态度。免疫治疗联合化疗及靶向药物作为一线治疗有一定的效果,但对于特殊类型的宫颈癌比如宫颈内分泌肿瘤的治疗效果,对于非HPV 感染的宫颈癌治疗效果以及对于PD⁃L1 阴性表达患者该如何治疗等目前研究很少甚至没有答案,还需要更多的前瞻性研究来明确免疫治疗和联合治疗对这些患者的治疗效果,让医生对所有宫颈癌患者不再遗憾就诊太晚和治疗手段太少,从而实现真正意义上的精准治疗。

