RAB27B在宫颈癌干细胞中的作用研究
张科 陈洁 毛聿华 丰为 罗敏
1南方医科大学第一临床医学院(广州 510515);2中国人民解放军南部战区总医院妇产科(广州 510000)
宫颈癌是育龄期女性常见的恶性肿瘤之一,常规的治疗方法为手术治疗辅以放疗、化疗或靶向治疗等,早期患者获益较大。近年来,相关研究[1-2]表明,其高复发率及转移率可能与宫颈癌干细胞有关,即干细胞是宫颈癌复发、转移的种子细胞。因此寻找宫颈癌干细胞的发生发展机制,为晚期、复发及耐药患者提供更加有效的治疗手段意义重大。研究发现,肿瘤的侧群细胞(SPs)具有明显的干性特质,较非侧群细胞(NSPs)具有明显的增殖、侵袭及成球克隆能力,成为研究干细胞的一种有效的替代工具。且发现SP 细胞高表达ABCG2,而ABCG2 基因被认为是干细胞标志基因,与肿瘤耐药息息相关。研究[3]证实,利用流式分选及无血清细胞成球培养方法可以从Hela 及Siha 细胞中分离出SP 细胞,通过验证发现SP 细胞具有明显的干性特征,故而将SP 细胞作为宫颈癌干细胞的替代细胞进行研究。
RAB 蛋白可以调节肿瘤的增殖,与肿瘤的转移、侵袭也有一定的关系,这种调节作用一般通过调控细胞囊泡的分泌、转运等发挥作用[4-5]。研究发现RAB27B 与胰腺癌[6]、前列腺癌[7-8]、乳腺癌[9-10]、卵巢癌[11]、肺癌[12-13]、肝癌[14-15]、食管癌[16]等多种癌症的复发、转移及耐药相关。且文献表明RAB 蛋白与结直肠癌干细胞[17]、乳腺癌干细胞[18]、胶质瘤干细胞[19]干性维持具有一定的调控作用。单细胞转录组测序进行相关差异基因功能富集分析后发现宫颈癌非侧群细胞与侧群细胞相比,与囊泡分泌相关的RAB27B具有显著的差异性。故本文通过敲除RAB27B在宫颈癌SP 细胞中表达而探讨RAB27B 与宫颈癌干细胞的相关关系。同时,通过单细胞转录组测序进行相关差异基因分析后发现宫颈癌非侧群细胞与侧群细胞相比,分泌性卷曲蛋白SFRP1 在二者间表达具有显著的差异性,且研究发现RAB 蛋白以GTP 核苷酸依赖的方式介导SFRP1 的转运和分泌,而Rab⁃SFRP1⁃Wnt 轴可以作为减弱肺癌干性的潜在靶点[20],故本文初步探讨RAB27B 与分泌性卷曲蛋白SFRP1 的相互作用,为确定宫颈癌干细胞的靶向治疗提供依据。
1 材料与方法
1.1 材料来源人宫颈癌SiHa 细胞系,由中国科学院上海生命科学研究院细胞资源中心提供。人宫颈癌SP 细胞由流式分选侧群细胞所得。
1.2 主要试剂1999经济装三对siRNA⁃RAB27B+阴性对照+转染对照及RiboFECT CP Transfection Kit(166T)购自锐博生物[4];CCK8 试剂盒购自南京凯基;q⁃PCR 试剂购自艾科瑞;引物购自擎科生物;抗体SFRP1、RAB27B 均购自美国proteintech 公司,二抗购自弗德生物。
1.3 方法
1.3.1 细胞转染接种4×105~20×105个细胞至含有适量完全培养基的6 孔板培养孔中,使转染时的细胞密度达到30%~50%。于室温无菌超净台内[5]用30 μL 1X riboFECTTMCP Buffer 稀释1.25 μL 20 μmol/L siRNA 储存液,并用移液枪吹打均匀。再于稀释好的储存液中加入3 μL riboFECTTMCP Reagent,并混合均匀,室温条件下静置15 min。将6 孔板中原培养基吸净弃去,后加入riboFECTTMCP混合液,上下左右法轻轻混匀。将培养板置于37 ℃的CO2培养箱中培养24~48 h。
1.3.2 蛋白免疫印迹法(Western blot)检测细胞目的基因的蛋白表达提取所需样品细胞的蛋白并用BCA法测定蛋白浓度;按照30 μg蛋白上样,室温条件下进行,设置浓缩胶电压为80 V,分离胶电压为120 V,恒压电泳至溴酚蓝条带接近胶底部;按照海绵/3 层滤纸/胶/膜/3 层滤纸/海绵的顺序进行放置,装配成“三明治”状,后将整个转膜槽置于冰水中,打开电源,设置电流恒定在250~300 mA,按实际需要调整时间为60~120 min;转膜后,5%脱脂奶粉(1 g 脱脂奶粉+20 mL PBS 配置)室温封闭1 h,相应抗体4 ℃孵育过夜(一抗:标准抗体稀释液=1∶1 000);次日PBS 洗涤3 遍,10 min/次;后二抗(二抗原液:封闭液=1∶10 000)[6]室温孵育1 h 后再次PBS 洗涤;使用化学发光法进行条带发光显影,选择β⁃actin 作为内参对照,选择合适曝光时间进行拍照保存。
1.3.3 q⁃PCR 检测细胞目的基因的mRNA 表达提取各组细胞的RNA 并测定浓度;将RNA 产物及5×Evo M⁃MLVRT Master Mix 配制成为10 μL 体系后,在PCR 仪上以37 ℃15 min,85 ℃5 s 完成RNA反转录cDNA;将cDNA、目标分子上下游引物、2×SYBR®GreenProTaqHSPremix 按照比例混合,再在real time 7500 fast 仪器上以95 ℃5 s 、58 ℃20 s 、72 ℃30 s 共40 个循环的程序完成qPCR。(RAB27B上游引物序列:GACACTGCGGGACAAGAGC,下游引物序列:CTTGCCGTTCATTGACTTCC;SFRP1 上游引物序列:5'⁃CTTCTACTGGCCCGAGATGCTT⁃3',下游引物序列:5'⁃ATGGCCTCAGATTTCAACT⁃CGT⁃3';GAPDH 上游引物序列:5'⁃CAGTCAGCCG⁃CATCTTCTT⁃3',下游引物序列:5'⁃GACAAGCTTC⁃CCGTTCTCAG⁃3'。)
1.3.4 Transvell 实验检测细胞侵袭能力将转染NC 及si 片段48 h 的细胞收集并计数,接种2 × 105细胞/200 μL 于Transwell 小室内,小室外24 孔板内加入500 μL 的完全培养基,37 ℃的CO2恒温馥孵育箱孵育24 h 后取出24 孔板,将小室置于PBS 中轻轻漂洗,并用棉球将微孔膜上层细胞轻轻拭去,后置于4%多聚甲醛中固定20 min;PBS 中轻轻漂洗并吸水纸吸干;后置于0.5%结晶紫(PBS 配[7]置)染色20 min;PBS 中轻轻漂洗并晾干,显微镜下观察并取多个视野拍照计数。
1.3.5 CCK8 实验检测细胞增殖能力将转染NC及si 片段48 h 的细胞收集并计数,接种3 000 个细胞到96 孔板中,加入100 μL 完全培养基,37 ℃的CO2培养箱培养过夜。后于室温无菌超净台内将96 孔板待测孔中原培养基吸净弃去,并于待测孔中加入100 μL 溶液(10 μL CCK8 试剂+90 μL 全培溶液配制),注意配制及加样过程应全程避光,后置于5%CO237 ℃恒温培养箱中孵育1 h,用酶标仪避光条件下测定细胞在450 nm处的吸光度值[8]。并于第2、3、4、5 天同样操作测吸光度。
1.3.6 平板克隆实验检测细胞的克隆形成能力将各组细胞接种于6 孔板中,接种细胞数目为3 000个/孔,完全培养基进行培养[9],4 d 更换一次培养基,接种14 d 后,洗涤、固定、染色,随后用数码照相机拍照。
1.3.7 免疫荧光检测RAB27B 及SFRP1 的表达及细胞亚定位情况 取出样品,用无菌PBS 缓冲液摇床上洗涤2~3 次,每次5 min;4%多聚甲醛固定15 min;1%BSA/0.5%Triton X⁃100 配置的通透液通透封闭30 分钟。用抗体稀释缓冲液(1XPBS/1%BSA/0.3% Triton X⁃100)配制RAB27B、SFRP1 一抗溶液,摸索最佳浓度均为1∶200,倒掉孔中通透封闭液,适量PBS 洗涤,每个孔中加入配制好的一抗溶液200 μL,于4 ℃冰箱孵育过夜。次日,将孔中一抗溶液按标签回收,PBS 缓冲液摇床洗涤,每次5 min,共3 次。后加入抗体稀释缓冲液配制好的荧光二抗,室温避光孵育1 h,PBS 缓冲液洗涤3 次,共15 min。洗涤后DAPI 核染色剂避光孵育10 min,洗涤后加入防荧光淬灭剂,荧光显微镜下观察拍照。
1.3.8 酶联免疫吸附实验(ELISA)检测细胞分泌SFRP1 水平加入标准品或样品后37 ℃孵育2 h;弃去液体,加生物素标记抗体工作液,37 ℃孵育1 h;洗板后加HRP 标记亲和素工作液,37 ℃孵育1 h;洗板后加底物溶液,37 ℃孵育15 min;加终止液,终止反应5 min 内用标仪检测450 nm 波长处的光密度值。
1.3.9 统计学方法采用SPSS 22.0 软件进行统计学分析。计量资料经正态性检验符合正态分布,以均数±标准差表示,组间比较采用t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 Western blot 检测SP 细胞RAB27B 敲除后目的基因蛋白表达情况通过Western blot 实验发现SP 细胞转染si⁃RAB27B 48 h 后,RAB27B 蛋白表达量为SP⁃NC 组(2.86 ± 0.06)vs.SP⁃R3 组(1.03 ±0.02);SFRP1 蛋白表达量为SP⁃NC 组(1.75 ± 0.06)vs.SP⁃R3 组(0.91 ± 0.02),差异均具有统计学意义(均P<0.01,图1)。
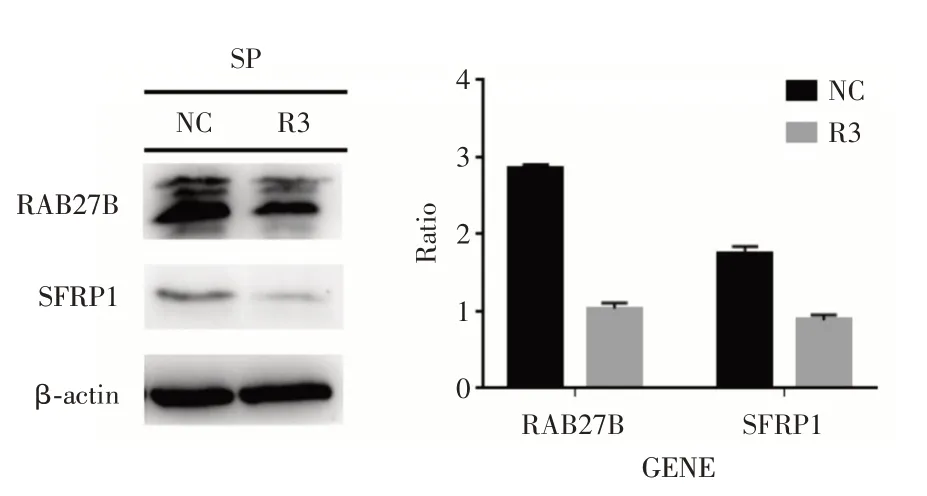
图1 Western blot 检测目的蛋白表达情况Fig.1 The expression of target protein was detected by Western blot
2.2 qPCR 法检测SP 细胞RAB27B 敲除前后RAB27B、SFRP1 的表达情况qPCR 法检测发现SP 细胞中RAB27B 表达量:SP⁃NC 组(1.0 ± 0.02)vs.SP⁃R3 组(0.449 3±0.026 4);SFRP1 表达量:SP⁃NC 组(1.0 ± 0.02)vs.SP⁃R3 组(0.390 5±0.027 0)。差异具有统计学意义(均P< 0.01)。结果与West⁃ern blot 结果相一致。见图2。
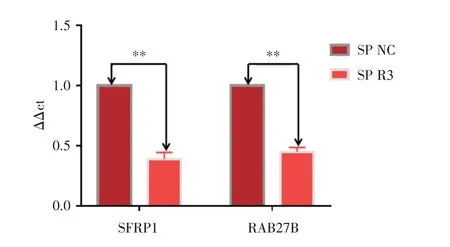
图2 SP 细胞RAB27B 敲除前后RAB27B、SFRP1 的mRNA表达情况Fig.2 mRNA expression of RAB27B and SFRP1 in SP cells before and after RAB27B deletion
2.3 Transwell 法检测SP 细胞敲除RAB27B 前后侵袭能力的变化Transwell 实验检测敲除宫颈癌SP 细胞RAB27B 后,与NC 组比较,肿瘤细胞穿过小室膜的细胞数目的对比变化(图3)。结果显示,SP⁃NC 组(290 ± 3.215)vs.SP⁃R3 组(162 ± 1.856),表明RAB27B 敲除后SP 细胞穿过小室膜的数目明显减少,差异具有统计学意义(t= 70.76,P<0.005)。提示RAB27B 能提高宫颈癌SP 细胞的体外迁移能力,与肿瘤远处转移相关。

图3 敲低RAB27B 对宫颈癌SP 细胞侵袭能力影响Fig.3 Effect of RAB27B knockdown on invasion ability of CERVICAL cancer SP cells
2.4 CCK8 法检测敲除RAB27B 对宫颈癌SP 细胞生长的影响将si⁃RNA RAB27B 及NC⁃RAB27B转染SP 细胞48 h 后铺板,在37 ℃、5% CO2条件下分别培养1、2、3、4、5 d后测OD值发现(图4),SP⁃NC 组(2.476 ± 0.058)vs.SP⁃R3 组(1.004 ± 0.050),差异具有统计学意义(t= 25.3,P< 0.005)。表明RAB27B 敲除后SP 细胞增值能力明显下降。提示RAB27B 可能在促进宫颈癌干细胞增殖方面发挥重要作用。
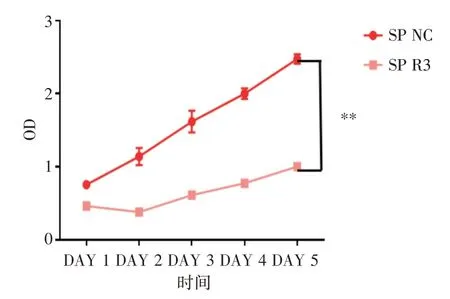
图4 敲低RAB27B 对宫颈癌SP 细胞增殖的影响Fig.4 Effect of RAB27B knockdown on proliferation of cervical cancer SP cells
2.5 平板克隆检测敲除RAB27B 对宫颈癌肿瘤细胞克隆形成能力的影响平板克隆实验结果显示,在敲除RAB27B 后,宫颈癌SP 细胞的增殖成球能力降低(图5),SP⁃NC 组(21±0.065)vs.SP⁃R3 组(10 ± 0.023),差异有统计学意义(t= 9.526,P=0.011),RAB27B 敲低组的细胞克隆数明显减少,细胞成球克隆能力明显下降。即RAB27B 可以促进宫颈癌SP 细胞形成更多细胞集落,在宫颈癌干细胞转移复发及放化疗抵抗方面可能发挥重要作用。

图5 敲低RAB27B 对宫颈癌SP 细胞平板克隆形成能力的影响Fig.5 Effect of RAB27B knockdown on plate clon⁃forming ability of cervical cancer SP cells
2.6 RAB27B、SFRP1 细胞荧光定位通过免疫荧光实验发现RAB27B 在SP 细胞中主要定位于细胞核中,在细胞质中也有少量表达。SFRP1在SP细胞中也主要定位于细胞核(图6)。
2.7 ELISA 酶联免疫吸附实验检测RAB27B 敲除后SFRP1的外分泌变化通过酶联免疫吸附实验发现,RAB27B 敲除后的SP 细胞分泌SFRP1 的能力下降。SP⁃NC组SFRP1外分泌值为(19.38±0.43)ng/mLvs.SP⁃si⁃R3 组(10.66± 0.25)ng/mL,P= 0.008。见图6。
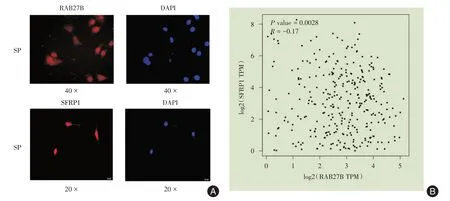
图6 RAB27B、SFRP1 细胞荧光定位Fig.6 Fluorescence localization of RAB27B、SFRP1 cells
3 讨论
宫颈癌作为我国女性常见癌症之一,具有较高的复发率及死亡率[1]。随着宫颈癌筛查的普及,其发生率有所降低,但对于晚期、复发及耐药患者仍无十分有效的治疗手段。越来越多的研究表明,肿瘤的复发、耐药与肿瘤干细胞高度相关[2],且研究发现RAB 蛋白可以介导乳腺癌干细胞[18]、胶质瘤干细胞[19]、肺癌干细胞[20]等干性维持,与结肠癌等耐药亦息息相关[17]。
前期前期单细胞转录组学测序研究发现,在宫颈癌SP 细胞中高表达而在NSP 细胞中低表达,表明RAB27B 在宫颈癌干细胞中高表达。且通过查阅TCGA 数据库可知,RAB27B 在正常宫颈组织中低表达而在宫颈癌组织中高表达,表明RAB27B在宫颈癌中发挥促癌基因作用,可以促进宫颈癌的发生发展。查阅文献发现RAB27B 与多种癌症干细胞的干性维持密切相关[18-20],故本文作者推测RAB27B 在宫颈癌干细胞的发生机制中起着重要作用。

图7 ELISA 法检测RAB27B 敲除前后SFRP1 分泌情况变化Fig.7 Changes of SFRP1 secretion before and after RAB27B knockout were detected by ELISA
因为目前对于宫颈癌干细胞并没有标准的分离鉴定方法,故本文作者选用流式分选出的具有干性特征的SP细胞作为研究对象[3]。通过RAB27B 敲低片段及对照片段转染48 h 后进行体外相关功能实验发现,RAB27B 敲低后的宫颈癌SP 细胞增殖、侵袭迁移及平板克隆能力明显降低,进一步发现RAB27B 在宫颈癌SP 细胞中具有重要的作用,可以促进宫颈癌干细胞干性能力的增强。在肺癌干细胞中,RAB37 与SFRP1 共定位于相同囊泡中,且RAB37 以GTP 核苷酸依赖方式介导SFRP1 的转运和分泌,故在宫颈癌SP 细胞中,RAB27B 也可能通过调控囊泡的分泌而调节SFRP1 的分泌。免疫荧光实验发现,RAB27B 与SFRP1 在SP 细胞中都主要定位于细胞核,且TCGA 数据库显示,RAB27B与SFRP1 在宫颈癌中表达具有一定相关性,结合RAB27B 敲低前后SFRP1 蛋白含量及mRNA 含量变化可知,RAB27B 对于SFRP1 的表达具有一定的调节作用。文献表明,SFRP1 通过WNT、EMT 等多条信号通路对宫颈癌的发生发展起到一定的调节作用[21-22]。故RAB27B 可能通过调节SFRP1 的表达而对宫颈癌干细胞干性的维持起到调控作用。
目前,本文发现RAB27B 对于宫颈癌干细胞的增殖、侵袭具有一定的调节作用,且文献表明,RAB 蛋白与多种癌症的干性维持及耐药密切相关[17-19],故RAB27B 可能成为宫颈癌患者预后标志物及新的治疗靶点,可以针对RAB27B 设计靶向药物或者RAB27B 高效安全的抑制剂来抑制宫颈癌干细胞的存活,从而延长晚期复发患者的生存时间。本文仅在体外细胞水平验证RAB27B 的作用,并没有在体内小鼠身上进一步验证。众所周知,动物体内微环境是一个复杂动态平衡的过程,由多种机制共同调控[4],是否RAB27B 在动物体内发挥同样的功效有待研究,后续可以设计皮下成瘤、肝转移及类器官模型加以验证。此外,下一步需要过表达及敲低SFRP1 观察宫颈癌干细胞的干性及RAB27B 的表达水平变化情况,进一步证实RAB27B 与SFRP1 在宫颈癌干细胞中相关关系。

