宫颈鳞癌患者手术前后的血清蛋白质指纹图谱差异研究
蔡思娜 陈剑光 关小倩 梁卫江
1南方医科大学第三附属医院肿瘤科(广州 510630);2广东省医学科学院,广东省人民医院医学研究部转化医学实验室(广州 510080);3南方医科大学南方医院肿瘤科(广州 510515)
宫颈癌的发病率居女性恶性肿瘤第4 位,仅2018年在中国就有10.6 万例发病[1]。晚期宫颈鳞癌的复发和死亡率高[2],提高其5年生存率的一个关键是找到能够准确预测疗效且灵敏度高肿瘤标志物。表面增强激光解吸飞行时间质谱技术(surface enhanced lasar desorption/ionization time of flight⁃mass spectrometry,SELDI⁃TOF⁃MS)[3]是近年来发展新技术,在较多肿瘤中已进行相关研究,如乳腺恶性肿瘤[4-5]、卵巢恶性肿瘤[6]、肺恶性肿瘤[7]等。然而大部分实验均是比较癌与正常人之间的差异蛋白质,很少研究肿瘤治疗后蛋白质变化情况,目前在国内外中未见宫颈鳞癌手术前后三个不同时期差异蛋白质的研究,因而本研究采取上述技术结合弱阳离子芯片(CM10),动态分析宫颈鳞癌患者手术前后蛋白质变化,从而找出相应差异蛋白质。
1 材料与方法
1.1 临床资料本研究在南方医科大学附属南方医院共收集27 例宫颈鳞癌患者的血清(2008年3月至2008年12月期间),患者术后病理分期具体如下:Ⅰa 期1 例,Ⅰb 期14 例,Ⅱa 期10 例,Ⅱb期2 例(其中高分化3 例,中分化16 例,低分化8 例)。患者的PS 评分均> 70 分,血清总蛋白及白蛋白正常,中位年龄46 岁(42~50 岁)。有20 例宫颈鳞癌患者随访收集了其术后30~40 d 的血清标本,中位年龄47岁(42~52岁)。纳入标准:(1)确诊时未经手术放化疗等治疗;(2)相关资料完整;(3)患者均行广泛全子宫切除+盆腔淋巴结清扫术。按照手术时间将宫颈癌患者分为术前(A1组)、术后7~10 d(A2 组)及术后30~40 d(A3 组)。将健康对照组设为B 组,取自健康体检女性的血清(同期南方医院),对照组和手术组之间的年龄构成比无统计学意义。本研究已通过南方医科大学南方医院伦理委员会的伦理批准和获得相关患者及健康组人员的知情同意。
1.2 仪器和试剂弱阳离子芯片(CM10)(美国Ciphergen 公司),5810R 低温台式离心机(德国Ep⁃pendorf),SELDI⁃TOF⁃MS(美国Ciphergen 公司),millipore 去离子水,尿素、Tris.Hcl、乙腈以及二硫苏糖醇等来自美国Sigma 公司。
1.3 检测血清蛋白
1.3.1 收集样品采集3~5 mL静脉血(需清晨空腹,血液不抗凝),60 min 静置后,在4 ℃1 000 rpm/min条件下用离心机离心20 min,小心吸取离心后上清放入EP 管内,于-80℃冰箱保存。
1.3.2 处理样品步骤在冰盒上融化样品,上述同样条件离心2 min ,用18 μL U9 缓冲液充分稀释9 μL 血清,进行30 min 冰浴震荡,随后将上述样品加入90 μL 的结合缓冲液(50 mmol/L NaAC,pH 4.0),混匀。
1.3.3 CM10 芯片的预处理步骤准备好生物芯片处理器,将芯片装入,然后每孔加200 μL 的结合缓冲液,在450 rpm/min 条件下,振荡5 min 后甩掉缓冲液;重复一次。
1.3.4 蛋白质结合反应步骤按照100 mL/孔的标准将上面处理好的样品加入处理器中,在450 rpm/min条件下,进行60 min 室温震荡,甩出样品后每孔再加入200 μL的结合缓冲液,相同条件下振荡5 min,再次甩去缓冲液,重复一次;随后每孔加入去离子水200 μL,马上甩出,待芯片微干时,加SPA 0.5 mL/孔,微干后,重复一次。
1.3.5 检测芯片质谱仪先用标准芯片进行校正,然后进行参数设置,随后在软件(Ciphergen ProteinChip)中按照设置程序来读取芯片数据,以及准确地得出相关蛋白质质谱图。
1.4 统计学方法设有意义蛋白峰的最低信噪比为5,最低出现频率阈值为15%。将信噪比(S/N)>3 和分子量偏差<0.5%的峰也标记为有效蛋白峰(为避免遗漏小的蛋白峰)。联用Ciphergen Protein Chip 3.1 和Biomarker Wizard 软件,对质谱图进行标准化,比较血清蛋白质谱峰差异。统计学处理采用SPSS 13.0,不同组之间蛋白峰比较采用t检验,对于手术前后三个不同时期蛋白峰对比采用析因分析,当P<0.05 时为差异具有统计学意义。
2 结果
对B 组与宫颈鳞癌患者A1 组、A2 组及A3 组的蛋白质指纹图谱进行对比,得到了2 组不同血清差异蛋白质。
2.1 宫颈鳞癌患者手术不同时期的16 种差异蛋白质第一组为16 个宫颈鳞癌与对照组相比的差异蛋白质,在术后7~10 d 其含量呈上升趋势(A3组与B 组比较,均P>0.1);其中12 个蛋白质(除表1中第13⁃16 蛋白)在A1 组与A2 组比较中差异有统计学意义(表1、图1,P≤0.001)。
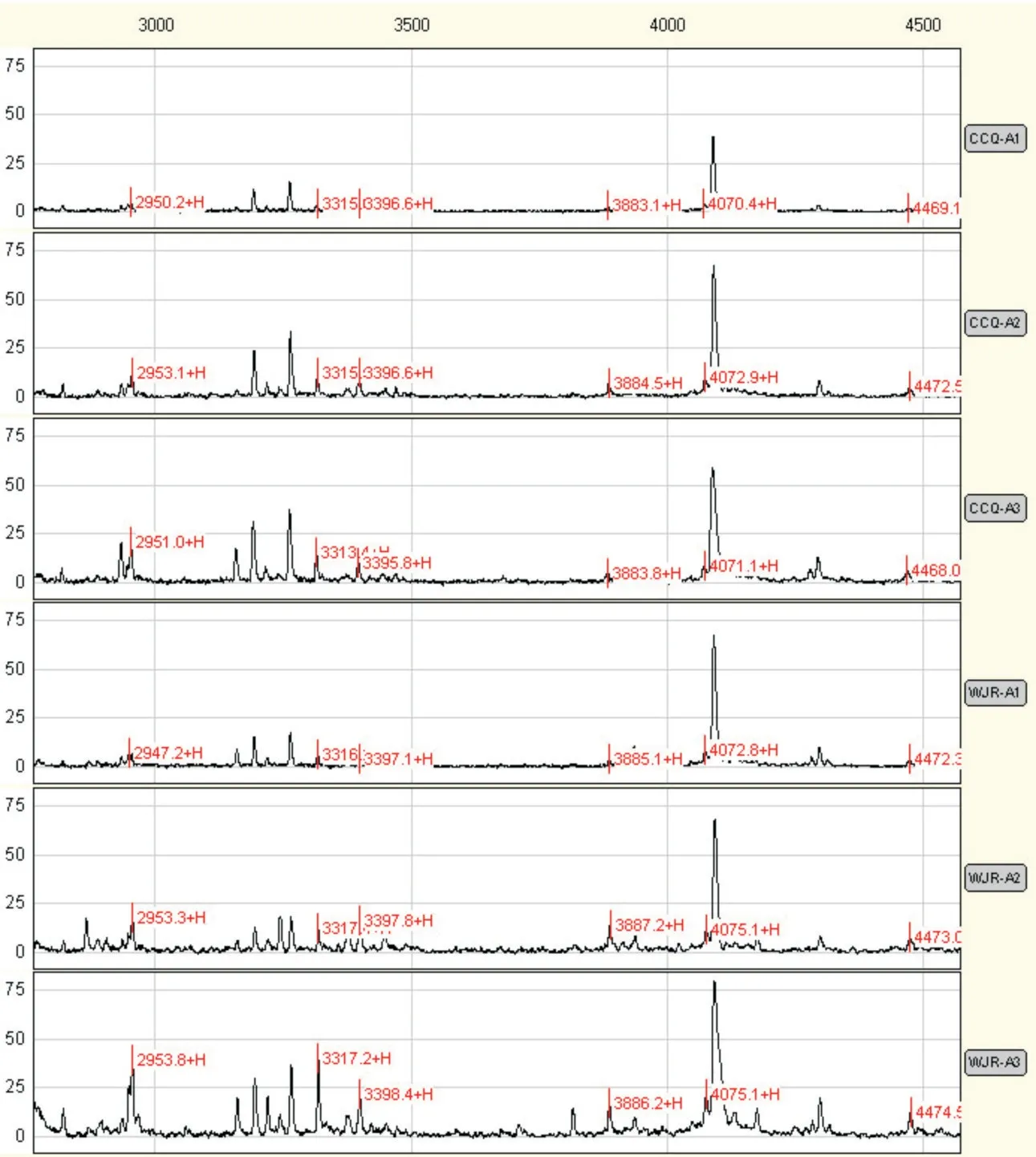
图1 宫颈鳞癌患者第一组部分血清差异蛋白质在不同手术时期质谱峰图Fig.1 The mass peak map of six different serum proteins in the same paitent with cervical squamous cell carcinoma between pre⁃operation and post⁃operation
表1 16 种差异蛋白质在宫颈鳞癌患者手术不同时期血清中的质谱峰值Tab.1 The peek intensity of 16 different proteins in the patient with cervical squamous cell carcinoma between pre⁃operation ±s

表1 16 种差异蛋白质在宫颈鳞癌患者手术不同时期血清中的质谱峰值Tab.1 The peek intensity of 16 different proteins in the patient with cervical squamous cell carcinoma between pre⁃operation ±s
编号A1 组(images/BZ_42_2142_2300_2165_2333.png±s)组内比较P 值Mass(Da)2 950.38 3 885.53 4 074.49 4 473.88 5 334.74 5 632.30 5 901.93 6 087.13 6 109.62 6 627.27 7 765.25 9 286.48 3 315.77 3 397.42 12 860.11 13 263.98 A2 组(images/BZ_42_2142_2300_2165_2333.png±s)A3 组(images/BZ_42_2142_2300_2165_2333.png±s)1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 7.058±2.765 4.832±1.488 8.844±2.807 3.782±1.671 7.282±3.171 28.502±12.421 36.991±10.794 1.999±0.985 4.320±1.616 45.631±16.555 15.911±5.343 5.463±3.538 12.407±6.906 5.655±1.629 0.396±0.252 0.255±0.217 11.390±4.320 9.528±3.749 12.674±3.927 6.212±2.358 14.232±5.920 41.286±9.453 57.339±10.506 4.847±1.861 9.228±3.242 61.471±10.474 32.016±9.982 12.884±5.479 19.757±7.146 12.357±6.240 0.771±0.448 0.606±0.370 15.612±7.308 8.545±3.853 13.842±4.781 7.518±2.426 18.228±10.339 49.212±13.970 62.509±14.690 5.256±2.936 11.061±5.464 61.868±12.078 27.220±11.452 10.197±5.368 20.944±9.712 11.998±6.222 0.537±0.260 0.501±0.478 P 值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.004 0.002 0.003 0.004 A1:A2 0.001<0.001<0.001<0.001<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 A1:A3<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.001 0.002 0.002<0.001 0.038 0.026 A2:A3 0.026 0.413 0.368 0.104 0.095 0.087 0.238 0.549 0.169 0.883 0.169 0.060 0.681 0.874 0.057 0.318
2.2 宫颈鳞癌患者手术不同时期的12 种差异蛋白质第二组为12 个A1 组与A3 组之间相比的差异蛋白质,在术前患者、术后7~10 d 及术后30~40 d 血清中的含量不断上升,有11 个蛋白质在术后30~40 d时基本恢复到对照组水平(表2、图2)。
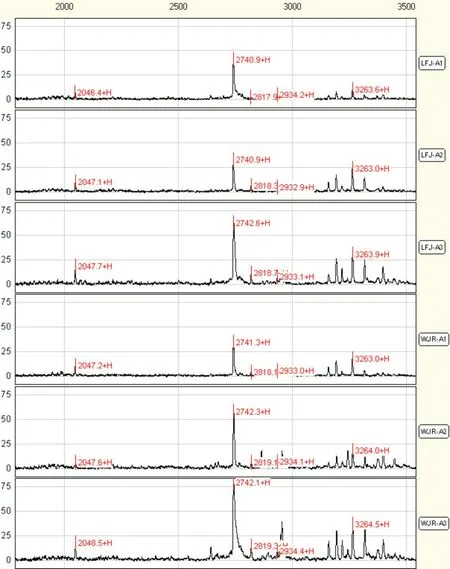
图2 宫颈鳞癌患者第二组部分血清差异蛋白质在不同手术时期质谱峰图Fig.2 The mass peak map of five different serum proteins in the same paitent with cervical squamous cell carcinoma between pre⁃operation and post⁃operation
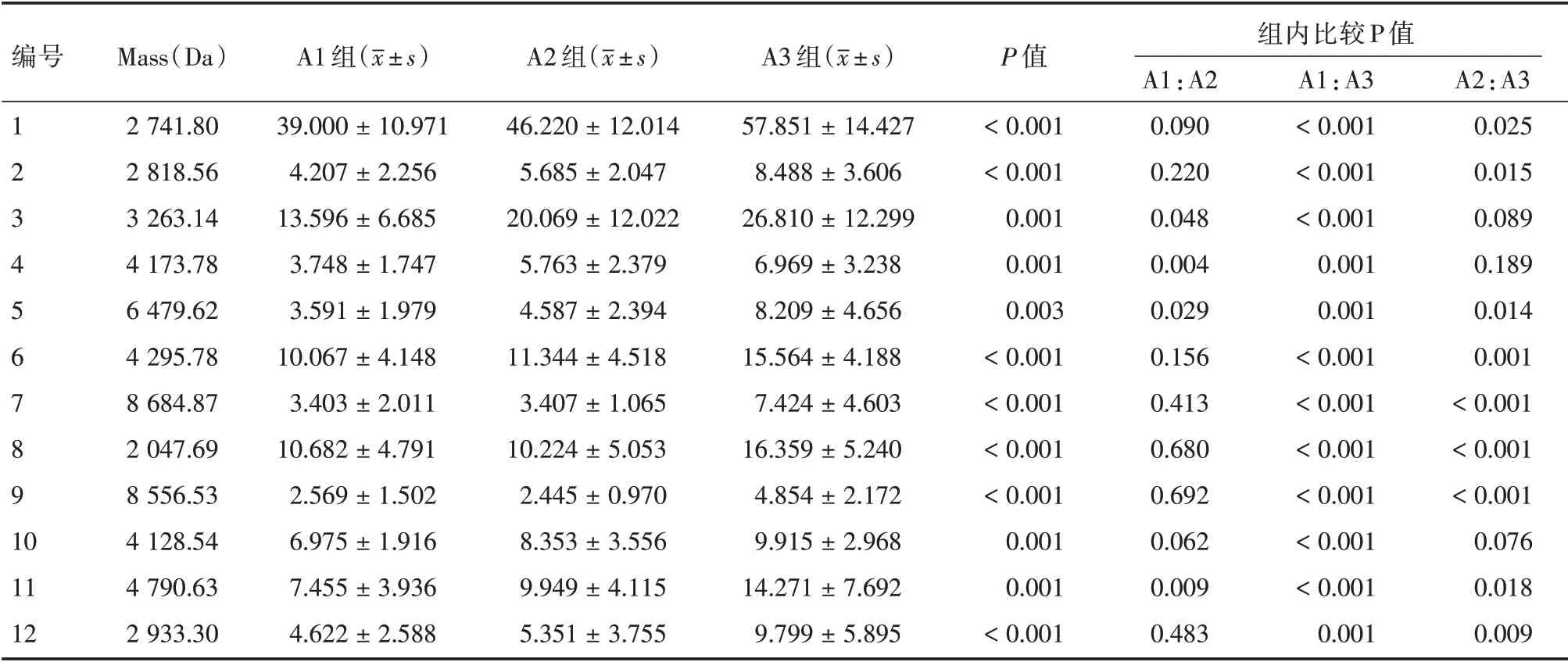
表2 12 种差异蛋白质在宫颈鳞癌患者手术不同时期的质谱峰值Tab.2 The peek intensity of 12 different proteins in the patient with cervical squamous cell carcinoma between pre⁃operation x±s
3 讨论
宫颈鳞癌的治疗以综合治疗为主,加强对手术效果监控和评价,尽早发现复发,对宫颈鳞癌整体诊疗非常重要[8]。目前国际上有许多蛋白组学技术应用于宫颈癌[9],而SELDI⁃TOF 技术则是一种非常有用的生物标志物筛选技术,可以直接分析复杂样品,可检测20 kda 以下的蛋白质,这些小分子量蛋白质可能因疾病而被切断或脱落,因此具有生物学意义。本技术在肝癌[10-11]、脑部疾病[12]、感染疾病[13]、Wilms 肿瘤[14]及筛选结肠癌手术后复发差异蛋白质[15]等多种疾病的诊断以及治疗中应用广泛,然而目前在国内外中未见宫颈鳞癌手术前后三个不同时期血清差异蛋白质的研究。
本研究通过对比宫颈鳞癌患者手术前后血清中蛋白质变化,结合对比健康人血清蛋白质,发现了两组差异蛋白质:第一组所含有的3 397.42(M/Z)、4 473.88(M/Z)、5 901.93(M/Z)等16 个差异蛋白质在术前患者的血清含量中,与对照组相比,明显处于低值,有可能作为生物标志物,用于区分宫颈鳞癌与健康人;进一步分析这16 个差异蛋白质含量在术后30~40 d 基本恢复至健康人水平;这种变化趋势与郭社珂等[16]采用不同于CM10 的铜离子芯片,使用SELDI 技术对比宫颈鳞状细胞癌患者术前和术后血清蛋白质,结果得到6 个低表达的差异蛋白质,这些蛋白质在术后3 个月有明显回升,和本实验结果一致,而且该研究中的M/Z为9 280.63 的差异蛋白质和本组所得到的差异蛋白质9 286.48(M/Z)几乎相同,可认为是同一蛋白质。由此可以推断通过SELDI⁃TOF 技术所检测出的结果有较高的可靠性及可重复性。第二组的差异蛋白质中有5 个在术前患者血清的含量明显低于对照组,也可作为区分宫颈癌患者与健康人的生物标志物;尤其是2 741.41(M/Z)、4 173.61(M/Z)、6 479.29(M/Z)3 个用于组成宫颈鳞癌诊断树模型的差异蛋白质[17]。虽然第二组差异蛋白的含量在A1 和A2 的对比中没有发生显著变化,但是在术后30~40 d 含量上升,结合第一组蛋白质含量变化趋势,由此可以推断这两组蛋白质是一组机体或其它器官组织分泌保护因子或抑癌因子,由于存在肿瘤组织的抑制,使其含量明显降低,在手术切除肿瘤后,含量不断上升至正常。从本研究可看出,手术治疗效果能够通过SELDI 技术结合芯片尽早检测出来,具体可通过观察相关差异蛋白质的变化趋势,而其他肿瘤研究也支持这个结论,CHAI 等[18]研究表明,通过该技术进行血清蛋白质组学分析,可以在盆腔放疗前发现易出现放射性直肠炎的宫颈癌患者,从而对后续干预起到指导作用。而ZHOU 等[15]使用该技术比较了结肠癌术后原位复发患者的特异性血清生物标志物,发现复发组和非复发组之间共有9 个蛋白质峰显示出差异,从而对疾病复发起到监测可能。
下一步的研究将是利用液相色谱⁃质谱等二级质谱方法鉴别出差异蛋白质,最后进行临床验证等。本研究样本量偏小,需继续收集,并结合患者临床特征如HPV 感染、病理等进行相应分层分析[19-20]。
综上所述,本研究采用SELDI⁃TOF 结合CM10芯片技术,得到了两组不同的差异蛋白质。第一组差异蛋白质可作为区分宫颈鳞癌与正常人生物学指标,在宫颈鳞癌和对照组比较差异有统计学意义,同时两组差异蛋白质含量在宫颈鳞癌患者手术前后三个不同时期均有明显不同,预测能作为宫颈鳞癌手术疗效评价和术后病情监测的指标。

