血管软化丸抑制血管炎症反应防治动脉粥样硬化的分子机制
秦合伟 牛雨晴 宋雪梅 王梦楠 孙孟艳
河南中医药大学第二附属医院康复科(郑州 450002)
动脉粥样硬化(atherosclerosis,AS)是冠状动脉粥样硬化心脏病的主要病理基础,过度的慢性炎症反应贯穿AS 病理全程[1],临床研究寻找抑制炎症反应的靶点和药物是研究重点和难点[2]。研究者发现长链非编码RNA⁃TGFB2⁃OT1(lncRNA⁃TGFB2⁃OT1)是介导炎症反应的关键分子,lncRNA⁃TGFB2⁃OT1 在AS 病变VEC 中呈现高 表 达,敲低lncRNA⁃TGFB2⁃OT1 时,能够抑制主动脉血管的脂质积累,抑制血管内皮的炎症反应,进而抑制了AS 的发生发展[3]。课题组既往研究发现,中药复方血管软化丸具有明显的抑制炎症反应和防治AS的作用[4-8],但具体作用机制不确定,本研究旨在观察中药复方血管软化丸防治AS 的机制是否通过靶向调控lncRNA⁃TGFB2⁃OT1 抑制miRNA4459,进而抑制LARP1/SQSTM1/CASP1/IL1B 炎症信号通路活化,降低ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 表达水平,抑制炎症反应产生效果。
1 材料与方法
1.1 实验动物SPF级健康雄性ApoE-/-小鼠75只,体质量(20 ± 2)g,购自北京维通利华公司[动物许可证号:SCXK(京)2016⁃0006]。饲养于河南中医药大学第二附属医院动物实验中心[试验单位使用动物许可证号:SCXK(豫)2016⁃0009],(22± 1)℃恒温、60%~75%恒湿、12 h 循环照明,自由摄食、饮水。经河南中医药大学第二附属医院动物实验伦理委员会审核通过,本实验设计方案符合安全性和公平性原则,符合国家对医学实验动物的有关要求[5],伦理审核批准标号:20210263。
1.2 实验药物本研究所用血管软化丸组成:山楂30 g、陈皮12 g、清半夏10 g、黄芪30 g、丹参12 g、三七12 g、莱菔子15 g。方中所有中药均来源于河南省中医院药剂科。按照“人和动物体表面积折算的等效剂量比率表”换算成中等剂量:43.2 g/kg,分别相当于60 kg 成人临床用量等效量的11.6 倍,医院煎药房按照要求煎煮成生药含量为:1.738 g/mL。
1.3 造模与给药ApoE-/-小鼠适应性饲养1 周后给予全程高脂饲料(含玉米淀粉23.51%、酪蛋白22.18%、可可脂17.19%、蔗糖12.53%,麦芽糊精7.87%,纤维素5.54%,大豆油2.77%,柠檬酸钾1.83%,磷酸钙1.44%,胆固醇1.25%,维生素预混料1.11%,矿物质预混料1.11%,碳酸钙0.61%,胆酸钠0.50%,胱氨酸0.33%,胆碱0.22%)喂养,随机分为5 组,每组15 只;饲养8 周造模成功(每组随机抽取1 只小鼠,经过HE 染色发现主动脉壁有斑块形成则为造模成功)后开始干预。
(1)模型对照组:0.9%生理盐水43.2 g/(kg·d);(2)TGFB2⁃OT1 inhibitor组:采用ApoE-/-小鼠造模后给予每只小鼠尾静脉注射200 μL(2 × 108TU/mL)慢病毒LV⁃TGFB2⁃OT1⁃RNAi;(3)NC(阴性对照)组:采用ApoE-/-小鼠造模后给予给予转染空载慢病毒;(4)血管软化丸组:给予血管软化丸43.2 g/(kg·d);(5)联合组(TGFB2⁃OT1 inhibitor+血管软化丸组):给予慢病毒LV⁃TGFB2⁃OT1⁃RNAi 和血管软化丸43.2 g/(kg·d)。
1.4 标本采集动物造模鉴定时每组各处死1 只小鼠,实验过程中因撕咬致死和灌胃致死8 只,采用偏度⁃峰度检验法来判断离群值,剔除离群值,最后各组进入统计的小鼠均为11 只[8]。各组每日干预一次,全程高脂饲养,连续干预8 周后取材进行检测。禁食12 h后摘眼球取血,检测血脂和血清炎性因子水平,取胸腹全长主动脉,一部分主动脉固定于4%福尔马林溶液中,用于HE 染色和免疫组化;一部分置于-80 ℃冻存用于相关指标检测。
1.5 检测指标
1.5.1 血脂分析采用生化检测仪检测各组小鼠血脂四项:TC、TG、HDL⁃C 和LDL⁃C。
1.5.2 病理学观察收集各组小鼠全主动脉用于组织学检查,采用苏木精⁃伊红染色,通过光学显微镜检查载玻片并拍照,放大200 倍拍摄图像。测量指标包括:管腔面积(LA)、血管内膜厚度(IMT)、斑块面积(PA)、脂质中心面积(LCA)。
1.5.3 采用免疫组化法检测主动脉病理结构改变和TGFB2⁃OT1 蛋白表达水平取石蜡包埋处理后的主动脉切片,按照实验流程进行[5],镜检及照像切片用中性树胶封片后,显微镜下观察结果。细胞核被染成蓝紫色,阳性信号为棕黄色或棕褐色;结果采用美国Keyence 公司的图像处理和分析软件BZ8000 analysis 进行光密度分析。
1.5.4 采用双染免疫荧光技术观察TGFB2⁃OT1分布情况和荧光强度采用anti⁃TGFB2⁃OT1(绿色)抗体对冰冻组织切片进行免疫荧光染色,CD31(红色)标记内皮层,采用激光共聚焦检测TGFB2⁃OT1 分布情 况,采用Zeiss LSM700,ZEN 2010 软件分析TGFB2⁃OT1 荧光强度。
1.5.5 ELISA 法检测外周血清炎性因子水平收集各组小鼠血清,采用ELISA 法按试剂盒说明书检测血清中ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 等炎性因子水平。
1.5.6 Real⁃time PCR法检测主动脉TGFB2⁃OT1、miRNA4459、LARP1、SQSTM1 的mRNA 表达水平取主动脉标本,提取总RNA,将总RNA 反转录为cDNA 模板,将荧光染料SYBR Green 和目的基因与内参GADPH 的引物混匀后,上机检测[4],在BIO⁃RAD Real⁃Time PCR 仪上进行实时荧光定量PCR,按照2-ΔΔCT计算目的基因的相对表达量[7]。引物序列:TGFB2⁃OT1 上游引物:5'⁃CCGGTACCAAC⁃TACTTCGTCG⁃3',下游引物:5'⁃GCTTACCGAGGC⁃GTACCAGCA⁃3';MIR4459 上游引物:5'⁃GCGTATT⁃TCATTACTCGTCG⁃3',下游引物:5'⁃CAGGGGCGA⁃GGCAGCA⁃3';LARP1 上游引物:5'⁃GCGTCAATGT⁃GATTCTGTTG⁃3',下游引物:5'⁃GCTGCGTTGGTC⁃GACCAGGCT⁃3';SQSTM1 上游引物:5'⁃AACAGC⁃GATCGTGTGGATTG⁃3',下游引物:5'⁃GCTGCG⁃GTTGTGTTAGGAGTCGGCT⁃3';GAPDH 上游引物:5'⁃AACACGGCGCTGTCAATATC⁃3',下游引物:5'⁃GGAGTCTAGCATCATGTTTCCA⁃3'。
1.5.7 Western blot 法检测主动脉TGFB2⁃OT1、CASP1、IL1B 蛋白水平取主动脉标本,提取蛋白,采用BCA蛋白定量法,电泳,分离,转膜,室温下5%脱脂奶粉封闭2 h,用相应的一抗,孵育,4 ℃过夜,洗涤后标记二抗杂交。采用化学发光试剂盒检测,使用Image Lab 4.1 图像分析软件检测TGFB2⁃OT1、CASP1、IL1B 印迹条带净吸光度值,以β⁃actin内参照,结果以样本灰度值/内参照灰度值表示[5]。
1.6 统计学方法所得数据采用SPSS 19.0 统计学软件分析,计量资料以()表示,采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠血脂水平比较干预后,与模型组相比,血管软化丸组血清TC、TAG 和LDL⁃C 水平明显较低(均P< 0.05),与血管软化丸组相比,联合组血清TC、TAG 和LDL⁃C 水平比较差异无统计学意义(P>0.05)。
表1 各组小鼠血脂水平比较Tab.1 Comparison of blood lipid levels of mice in each group ±s
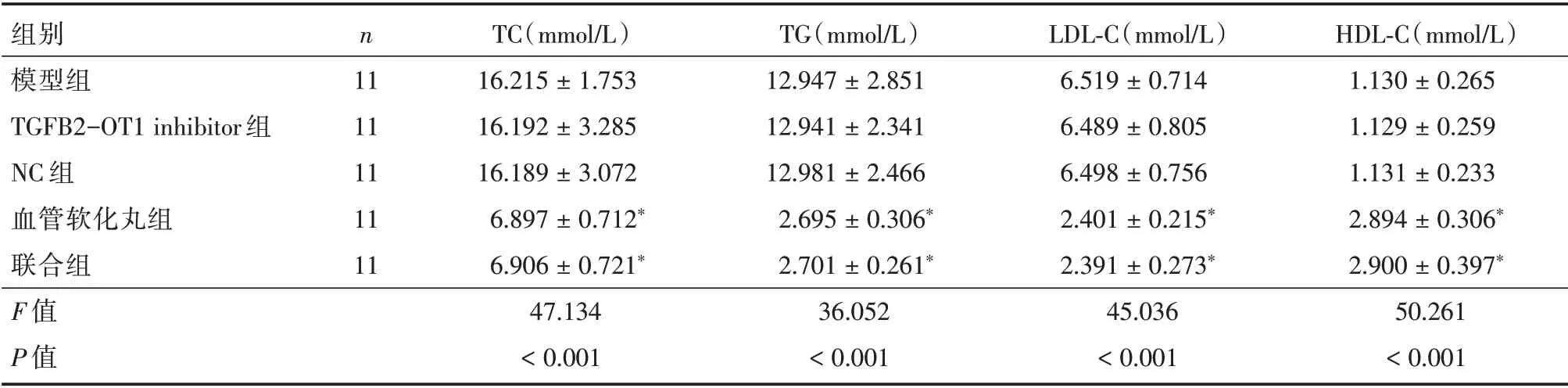
表1 各组小鼠血脂水平比较Tab.1 Comparison of blood lipid levels of mice in each group ±s
注:与模型组比较,*P<0.05
组别模型组TGFB2-OT1 inhibitor 组NC 组血管软化丸组联合组F 值P 值n 11 11 11 11 11 TC(mmol/L)16.215±1.753 16.192±3.285 16.189±3.072 6.897±0.712*6.906±0.721*47.134<0.001 TG(mmol/L)12.947±2.851 12.941±2.341 12.981±2.466 2.695±0.306*2.701±0.261*36.052<0.001 LDL⁃C(mmol/L)6.519±0.714 6.489±0.805 6.498±0.756 2.401±0.215*2.391±0.273*45.036<0.001 HDL⁃C(mmol/L)1.130±0.265 1.129±0.259 1.131±0.233 2.894±0.306*2.900±0.397*50.261<0.001
2.2 各组小鼠主动脉病理学检测模型组小鼠近心端主动脉管径较小,管壁厚薄不均匀,内膜不光滑,管腔内可见明显AS 斑块形成,斑块内可见浅染无定形物和钙化颗粒物。血管软化丸和联合组小鼠主动脉管径厚薄虽然不均匀,但病灶表层纤维帽较薄,中膜平滑肌厚度均匀,但少数主动脉可见AS 斑块,动脉血管结构相对清晰,见图1。与模型组比较,TGFB2⁃OT1 inhibitor 组、血管软化丸组和联合组的LA 大、IMT 薄、PA 小、LCA 小,差异有统计学意义(均P< 0.05),NC 组血清TC、TAG 和LDL⁃C 水平比较差异无统计学意义(P> 0.05)。与TGFB2⁃OT1 inhibitor 比较,血管软化丸组和联合组的LA大、IMT薄、PA小、LCA小,差异有统计学意义(均P<0.05)。与血管软化丸组比较,联合组的LA 大、IMT 薄、PA 小、LCA 小,差异有统计学意义(均P<0.05)。见表2。

图1 各组小鼠主动脉HE 染色结果(×200)Fig.1 Results of HE staining in each group(×200)
表2 各组小鼠主动脉病理学检测Tab.2 Pathological detection of the aorta of mice in each group ±s
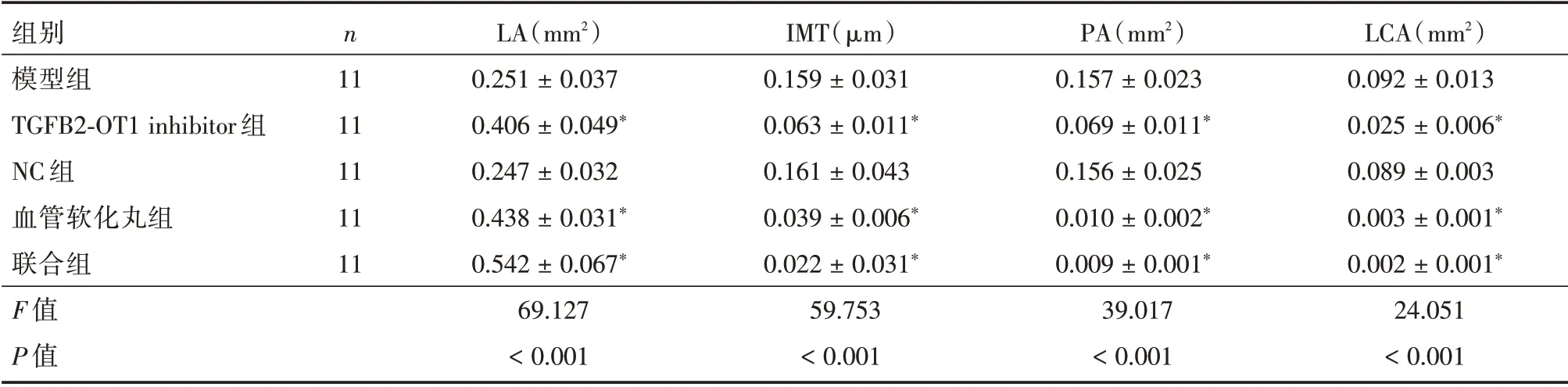
表2 各组小鼠主动脉病理学检测Tab.2 Pathological detection of the aorta of mice in each group ±s
注:与模型组比较,*P<0.05
组别模型组TGFB2⁃OT1 inhibitor 组NC 组血管软化丸组联合组F 值P 值LCA(mm2)0.092±0.013 0.025±0.006*0.089±0.003 0.003±0.001*0.002±0.001*24.051<0.001 n 11 11 11 11 11 LA(mm2)0.251±0.037 0.406±0.049*0.247±0.032 0.438±0.031*0.542±0.067*69.127<0.001 IMT(μm)0.159±0.031 0.063±0.011*0.161±0.043 0.039±0.006*0.022±0.031*59.753<0.001 PA(mm2)0.157±0.023 0.069±0.011*0.156±0.025 0.010±0.002*0.009±0.001*39.017<0.001
2.3 各组主动脉病理结构改变和TGFB2⁃OT1 蛋白表达水平免疫组化法结果显示TGFB2⁃OT1 蛋白表达阳性信号为棕黄色或棕褐色,以模型组和NC 组两组的AS 斑块形成最为明显(图2)。与模型组相比,TGFB2⁃OT1 inhibitor 组、血管软化丸组和联合组主动脉TGFB2⁃OT1 光密度值降低(均P< 0.05)。与联合组相比,TGFB2⁃OT1 inhibitor组、血管软化丸组主动脉TGFB2⁃OT1 光密度值升高(均P<0.05)。见图3。

图2 各组小鼠主动脉免疫组化染色结果(×200)Fig.2 Results of Immunohistochemical staining in each group(×200)
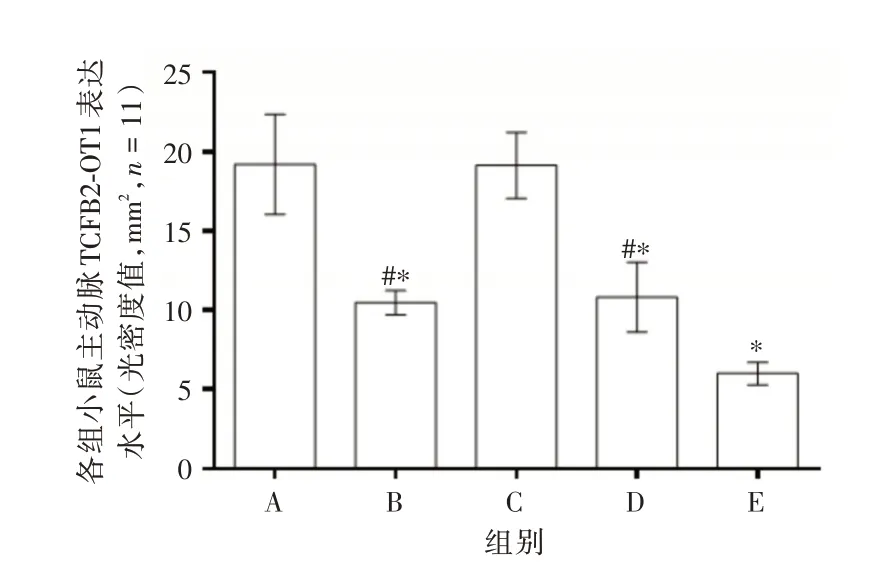
图3 各组小鼠主动脉TGFB2⁃OT1 蛋白表达水平Fig.3 Expression levels of TGFB2⁃OT1 protein in the aorta of mice in each group
2.4 各组小鼠主动脉TGFB2⁃OT1 免疫荧光染色结果与模型组相比,TGFB2⁃OT1 inhibitor 组、血管软化丸组和联合组主动脉TGFB2⁃OT1 荧光强度降低(均P<0.05)。与联合组相比,TGFB2⁃OT1 in⁃hibitor 组、血管软化丸组主动脉TGFB2⁃OT1 荧光强度明显升高(均P<0.05)。结果见图4、5。

图4 各组小鼠主动脉免疫荧光染色结果(Bar=60 μm)Fig.4 Results of Immunofluorescence staining in each group(Bar=60 μm)
2.5 各组血清ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1水平比较干预后,与模型组相比,TGFB2⁃OT1 inhibitor 组、血管软化丸组和联合组小鼠外周血清中ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 水平降低(均P<0.05)。与联合组相比,TGFB2⁃OT1 inhibitor组、血管软化丸组外周血清中ICAM⁃1、VCAM⁃1、IL⁃8和MCP⁃1 水平升高(均P<0.05)。结果见图6。
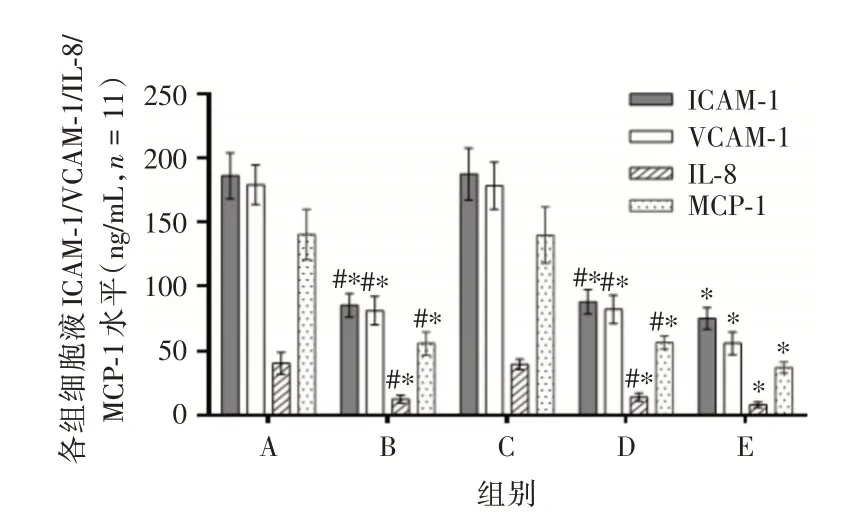
图6 各组小鼠血清ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 水平Fig.6 Serum ICAM⁃1,VCAM⁃1,IL⁃8 and MCP⁃1 levels of mice in each group
2.6 各组主动脉TGFB2 ⁃ OT1、miRNA4459、LARP1、SQSTM1 的mRNA 表达水平干预后,与模型组相比,TGFB2⁃OT1 inhibitor组、血管软化丸组和联合组小鼠主动脉TGFB2⁃OT1、miRNA4459、LARP1、SQSTM1 水平降低(均P< 0.05)。与联合组相比,TGFB2⁃OT1 inhibitor 组、血管软化丸组主动脉TGFB2⁃OT1、miRNA4459、LARP1、SQSTM1 水平升高(均P<0.05)。结果见图7。
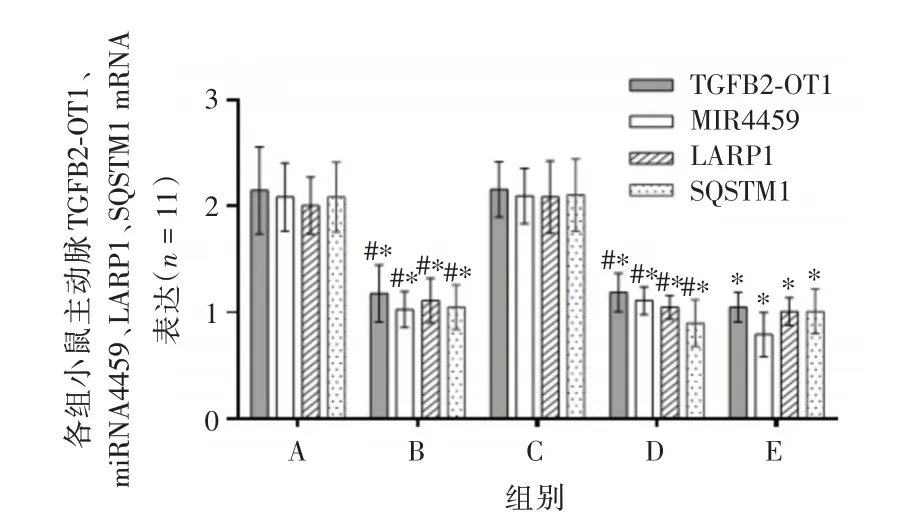
图7 各组主动脉TGFB2⁃OT1、miRNA4459、LARP1、SQSTM1 的mRNA 表达水平Fig.7 Expression levels of TGFB2⁃OT1,miRNA4459,LARP1 and SQSTM1 mRNA in each group
2.7 Western blot 法检测主动脉TGFB2⁃OT1、CASP1、IL1B 蛋白水平干预后,与模型组相比,TGFB2⁃OT1 inhibitor 组、血管软化丸组和联合组主动脉TGFB2⁃OT1、CASP1、IL1B 蛋白表达水平降低(均P<0.05)。与联合组相比,TGFB2⁃OT1 inhibitor组、血管软化丸组主动脉TGFB2⁃OT1、CASP1、IL1B蛋白表达水平升高(均P< 0.05)。结果见图8、图9。
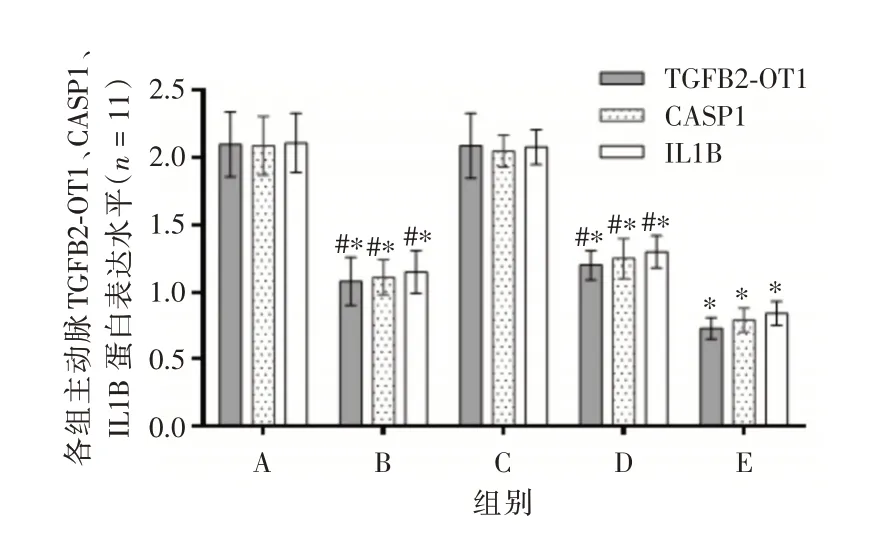
图8 各组小鼠主动脉TGFB2⁃OT1、CASP1、IL1B 蛋白表达水平Fig.8 Expression levels of TGFB2⁃OT1,CASP1 and IL1B proteins in each group

图9 各组主动脉TGFB2⁃OT1、CASP1、IL1B 蛋白表达Fig.9 Expression of TGFB2⁃OT1,CASP1 and IL1B proteins in each group
3 讨论
AS 属于中医学“脉痹”范畴,本课题组认为“痰瘀阻滞”是AS 的主要证型,本研究所用血管软化丸由保和丸化裁而来,方中山楂消食健胃,行气散瘀为君药;陈皮、半夏理气健脾、化痰散结;黄芪补气以推动血液运行;丹参,三七行气散结,活血化瘀共为臣药;莱菔子消食除胀、降气化痰为佐药;诸药合用,共奏消食化痰、活血化瘀之功;本课题组既往研究[4-9]发现,血管软化丸防治AS 是通过调控PI3K/Akt/mTOR 通路、miR⁃17⁃5p、CD40⁃CD40L、TLR3/TLR9、miRNA⁃467b 等信号通路产生效果。
目前认为AS 的过程是多因素介导的慢性炎症反应过程[10-14],内皮细胞覆盖于全身血管的内膜,对维持血管通透性、防治AS 具有重要的作用,当多种因素刺激损伤内皮细胞,引起粘附分子ICAM⁃1、VCAM⁃1 和炎性因子IL⁃8、MCP⁃1 的高表达,炎性因子刺激引起内皮功能紊乱,促进AS 斑块的发生和发展[15-18]。本实验中血管软化丸组小鼠外周血清中ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 水平明显低于模型组,并且能够降低小鼠血清TC、TG 和LDL⁃C 水平,改善AS 的进程,抑制AS 斑块形成。提示血管软化丸能够抑制ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 表达,抑制血管炎症反应。
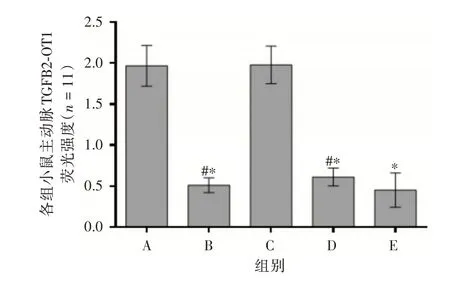
图5 各组小鼠主动脉TGFB2⁃OT1 荧光强度Fig.5 Fluorescence intensity of aorta TGFB2⁃OT1 in each group
研究者发现miRNAs 和LncRNA 参与AS 的发生发展过程[19],LncRNA⁃TGFB2⁃OT1 在AS 中呈现高表达,TGFB2⁃OT1 通过结合miRNA4459,靶向影响LARP1、SQSTM1、CASP1 和IL1B 等下游分子,导致血管内皮炎症反应,加重AS 程度[20]。SQSTM1是氧化应激反应的调节因子,通过调节炎性因子,上调氧化应激反应的基因,调控炎症受体蛋白,抑制炎症反应[21-23]。SQSTM1 通过促进炎性小体产生,激活CASP1,提高IL1B 的表达水平,引起炎症反应[24]。过度的慢性炎症反应贯穿AS 病理全程,寻找抑制炎症反应的靶点和药物是研究重点和难点[25-26]。本实验研究结果发现免疫荧光检测发现血管软化丸组主动脉TGFB2⁃OT1 荧光强度明显较低,血管软化丸能够抑制主动脉壁TGFB2⁃OT1蛋白表达,抑制主动脉TGFB2⁃OT1、miRNA4459、LARP1、SQSTM1、CASP1、IL1B 表达水平,血管软化丸与通过抑制lncRNA⁃TGFB2⁃OT1 表达具有相同作用。结果表明血管软化丸防治AS 的分子机制与调控lncRNA⁃TGFB2⁃OT1,抑制miRNA4459/LARP1/SQSTM1/CASP1/IL1B 炎症信号通路活化,抑制ICAM⁃1、VCAM⁃1、IL⁃8 和MCP⁃1 表达,抑制血管炎症反应、保护血管内皮有关。
本研究聚焦AS 的防治机制这一临床难点和中医药优势点,基于lncRNA⁃TGFB2⁃OT1 在AS 形成中的重要作用,运用分子生物学方法,在组织、细胞、分子水平和蛋白信号转导层面,将炎症反应和TGFB2⁃OT1 这两个关键病理机制点和中医药联合起来,提出了一个全新的研究思路,目前对中药复方治疗AS 作用机制与lncRNA⁃TGFB2⁃OT1 之间关系的研究国内外尚无报道。本研究首次揭示了血管软化丸防治AS 的分子机制是通过靶向调控长链非编码RNA⁃TGFB2⁃OT1、miR4459 及其下游信号抑制炎症反应产生效果,对中医药防治心脑血管疾病具有重要理论与应用价值,是科研思路上的持续创新。

