转分化肾小管上皮细胞对DJ-1蛋白分泌及甲状旁腺细胞增殖的影响*
位红兰,董骏武
(武汉市第四医院肾病内科,湖北 武汉 430030)
继发性甲状旁腺功能亢进是慢性肾脏病(chronic kidney disease,CKD)的常见并发症之一,主要表现为甲状旁腺细胞增殖、甲状旁腺激素(parathyroid hormone,PTH)分泌增加[1]。因其与钙磷代谢紊乱、血管钙化、心脑血管事件[2]、死亡等密切相关,近年已经受到高度重视,并成为研究热点,但其具体的发生发展机制仍有待深入研究。
慢性肾脏病(chronic kidney disease,CKD)早期FGF23与甲状旁腺细胞上的FGFR1结合,抑制甲状旁腺细胞增生及PTH分泌[3-6]。但FGF23对已经增生的甲状旁腺不起作用,且透析患者中血清FGF23与PTH正相关[7-8]。这一矛盾现象提示在CKD进展中可能存在某种竞争机制作用于FGFR1,影响甲状旁腺增生及PTH分泌。
DJ-1是一种新近发现的多功能蛋白[9],具有参与细胞转化、抗氧化反应、分子伴侣及抑制凋亡等多种生物学功能[10-11]。目前研究发现,DJ-1具有“细胞内”和“细胞外”两种存在形式[12]。成骨细胞分泌的细胞外DJ-1蛋白可以作为配体与FGFR1结合[13]。我们前期研究发现肾小管上皮细胞转分化中DJ-1蛋白的细胞内表达明显升高[14],但细胞外DJ-1蛋白分泌是否增加尚未进一步研究,且细胞外DJ-1蛋白是否能作用于甲状旁腺细胞的FGFR1尚无报道。
本研究旨在探究转分化肾小管上皮细胞是否分泌细胞外DJ-1蛋白,并作为配体与FGFR1结合,刺激甲状旁腺细胞增生、PTH分泌。
1 材料与方法
1.1 材料
人肾小管上皮细胞(HK-2)、人甲状旁腺细胞(武汉巴菲尔生物技术服务有限公司);DMEM/F12培养液、RPMI 1640培养液、胎牛血清(美国Gibco公司);胰蛋白酶-EDTA消化液(北京Solarbio公司);兔抗人α-SMA蛋白抗体、鼠抗人DJ-1蛋白抗体、鼠抗人p-FGFR1抗体、兔抗人p-ERK1/2抗体(美国Santa Cruz公司);FGFR1抑制剂SU5402(北京百奥莱博科技有限公司);细胞增殖检测试剂盒CCK8(Abcam中国);免疫共沉淀试剂盒(美国贝克曼);人PTH试剂盒(西门子公司)。纯化野生型分泌蛋白DJ-1及突变体由华中科技大学同济医学院附属同济医院肿瘤科刘顺芳教授赠送。
1.2 方法
1.2.1 细胞培养及分组
(1)HK-2细胞:含10%胎牛血清的DMEM/F12培养液37℃培养箱(95%湿度,5%CO2)培养,实验分正常培养组、10μg/L TGF-β1培养组(HK-2细胞转分化组)。
(2)甲状旁腺细胞:含10%胎牛血清的RPMI 1640培养液37℃培养箱(95%湿度,5%CO2)培养,甲状旁腺细胞分为常规培养组(A组)、加入HK-2细胞转分化上清培养组(B组)、加入转分化HK-2细胞上清+SU5402培养组(C组);加入纯化野生型分泌蛋白DJ-1 5ng/mL(D组)、10ng/mL(E组)、15ng/mL(F组);同时加入相同浓度的SU5402组(G、H、I组)、DJ-1突变体组(J、K、L组)。
1.2.2 ELISA检测分泌型DJ-1蛋白
两组HK-2细胞分别接种至6孔板,每组30样,培养0、1、3d,分别收集培养液上清,ELISA试剂盒检测分泌型DJ-1蛋白。
1.2.3 免疫共沉淀检测分泌型DJ-1蛋白与FGFR1相互作用
A、B组甲状旁腺细胞培养48h后,收集细胞。加入裂解液提取并稀释蛋白,制成1g/L的溶液,取500μL加入抗体1μL,4℃缓慢摇晃、孵育过夜。次日加入50μL琼脂糖珠,4℃缓慢摇晃、孵育4h,使抗体与琼脂糖珠偶联;4℃、3 000r/min离心3min,弃上清。用250μL裂解缓冲液清洗琼脂糖珠3次;加入4μL的5×上样缓冲液和16μL的1×磷酸盐缓冲液,煮沸5min待用。Western blot检测DJ-1、P-FGFR1、FGFR1。
1.2.4 Western blot检测P-ERK1/2表达
A、B、C 3组甲状旁腺细胞培养48h后,收集细胞。加入预冷的蛋白裂解液提取蛋白,BCA法测蛋白浓度,上样,SDS-PAGE凝胶电泳,将蛋白转移到PVDF膜上。在5%脱脂奶粉中封闭2h后加一抗,4℃孵育过夜。次日在室温下加入二抗孵育2h,采用ECL发光液曝光。
1.2.5 CCK8法检测细胞增殖
甲状旁腺细胞接种于96孔板,每组32孔,48h后CCK8溶液按1∶10加入每孔染色,2h后酶标仪450nm条件下检测吸光度(A)值,计算细胞增殖率=(A样本-A空白)/A空白×100%。
1.2.6 电化学发光法检测甲状旁腺激素
甲状旁腺细胞接种于96孔板,每组32孔,48h后提取3组培养液上清,人PTH试剂盒电化学发光法检测上清液中甲状旁腺激素含量。
1.3 统计学方法
使用SPSS 20.0处理数据,非正态分布计量资料用中位数(四分位间距)表示,非参数检验比较两组统计学差异,GraphPad Prism 9.0绘图。P<0.05表示差异有统计学意义。
2 结 果
2.1 转分化肾小管上皮细胞分泌DJ-1蛋白
10μg/L TGF-β1培养HK-2细胞72h,Western印迹检测α-SMA表达较正常培养组明显升高(图1),提示肾小管上皮细胞转分化。分别提取HK-2细胞正常培养组及10μg/L TGF-β1培养组0、1、3d培养液上清,ELISA法检测分泌型DJ-1蛋白浓度,TGF-β1培养组较正常培养组分泌型DJ-1蛋白浓度明显升高,差异有统计学意义,见表1。
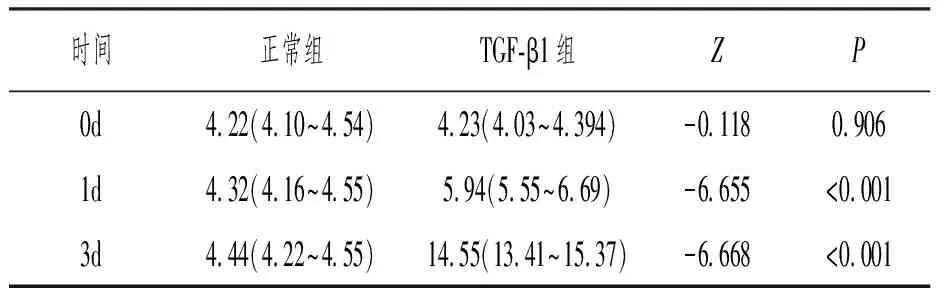
表1 ELISA法检测肾小管上皮细胞分泌DJ-1蛋白浓度(ng/mL,n=30)
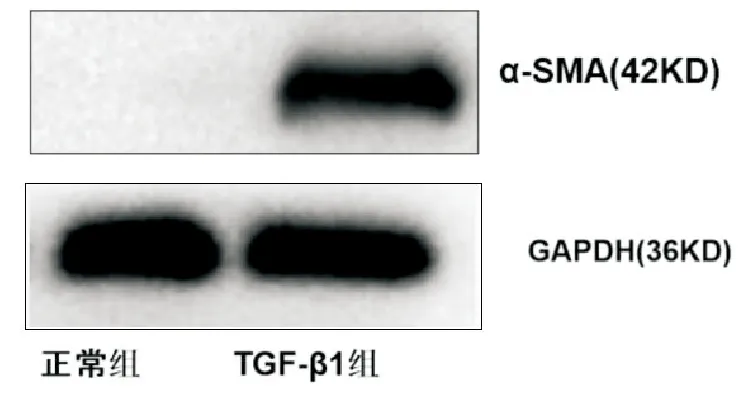
图1 Western印迹检测HK-2细胞α-SMA蛋白表达
2.2 分泌型DJ-1与P-FGFR1相互作用激活下游P-ERK1/2通路
免疫共沉淀检测发现B组甲状旁腺细胞中DJ-1与P-FGFR1相互作用(图2),同时下游P-ERK1/2蛋白表达升高,但加入FGFR1抑制剂SU5402后(C组)P-ERK1/2蛋白的表达被部分抑制,见图3。
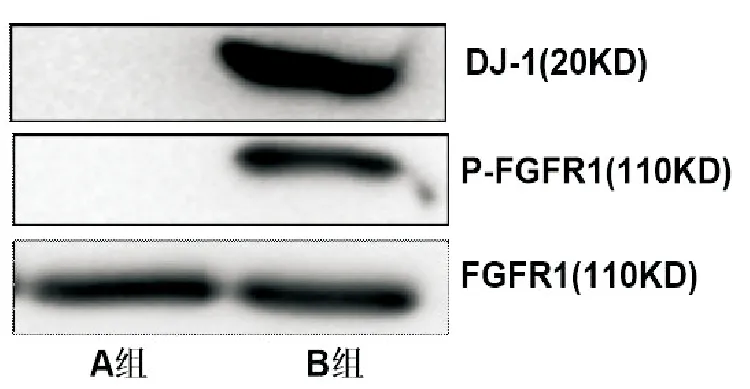
图2 免疫共沉淀检测两组甲状旁腺细胞DJ-1与FGFR1相互作用
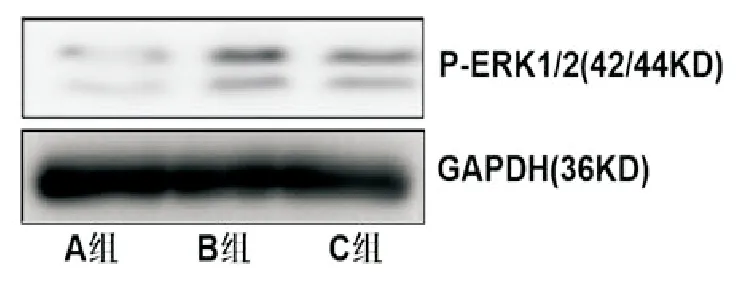
图3 Western印迹检测三组甲状旁腺细胞P-ERK1/2蛋白浓度
2.3 转分化肾小管上皮细胞培养液上清促进甲状旁腺细胞增殖及PTH分泌
CCK8法检测B组甲状旁腺细胞增殖率为118.40%(112.47%~119.55%),较A组98.44%(97.12%~99.45%)显著升高,差异有统计学意义(Z=-6.876,P<0.001),但C组细胞增殖率98.73%(97.23%~99.45%)较A组无统计学差异(Z=-0.309,P=0.757),见图4。电化学发光法检测3组细胞上清液中PTH浓度,B组125.38pg/mL(117.56~147.35pg/mL),较A组67.66pg/mL(55.37~79.77pg/mL),差异有统计学意义(Z=-6.875,P<0.001);但C组67pg/mL(54.38~78.99pg/mL),较A组差异无统计学意义(Z=-0.544,P=0.587)。见图5。
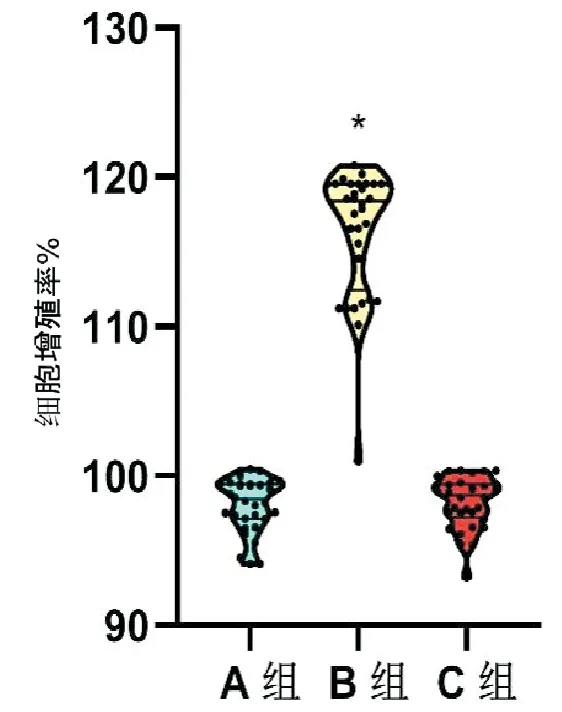
图4 CCK8法检测三组甲状旁腺细胞增殖率(与A组比较,*P<0.001,n=32例)
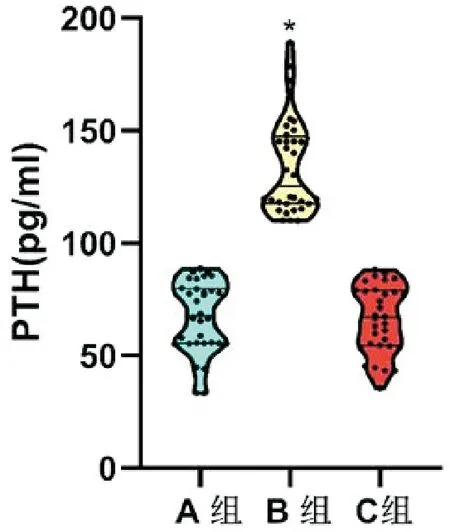
图5 电化学发光法检测3组甲状旁腺细胞上清中PTH浓度(与A组比较,*P<0.001,n=32例)
2.4 不同组CCK8法检测各组甲状旁腺细胞增殖率与电化学发光法检测各组甲状旁腺激素浓度比较
不同浓度纯化野生型分泌蛋白DJ-1(或加SU5402)及突变体加入甲状腺细胞培养液后细胞增殖率分别为:D组118.67%(115.55%~119.56%)、E组120.67%(118.89%~130.82%)、F组130.50%(128.30%~139.59%),较A组98.44%(97.12%~99.45%)差异均有统计学意义(P<0.001),但G组97.68%(95.95%~99.41%)、H组98.90%(97.55%~99.54%)、I组98.51%(96.45%~99.52%)、J组99.44%(97.64%~99.54%)、K组99.26%(97.89%~100.50%)、L组98.52%(96.70%~99.35%)较A组差异均无统计学意义(P>0.05)。见图6。
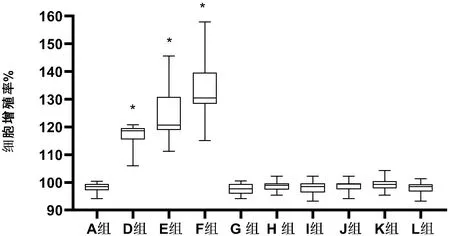
图6 CCK8法检测各组甲状旁腺细胞增殖率(与A组比较,*P<0.001,n=32例)
不同浓度纯化野生型分泌蛋白DJ-1(或加SU5402)及突变体加入甲状腺细胞培养液后PTH浓度分别为:D组129.88pg/mL(118.70~142.25pg/mL)、E组147.10pg/mL(140.65~158.08pg/mL)、F组165.61pg/mL(150.22~179.33pg/mL),较A组67.66pg/mL(55.37~79.77pg/mL)差异均有统计学意义(P<0.001),但G组61.49pg/mL(55.29~79.36pg/mL)、H组57.35pg/mL(50.90~73.98pg/mL)、I组66.66pg/mL(55.56~77.72pg/mL)、J组68.03pg/mL(59.46~77.72pg/mL)、K组74.23pg/mL(59.28~78.48pg/mL)、L组68.79pg/mL(58.98~78.23pg/mL)较A组差异均无统计学意义(P>0.05)。见图7。
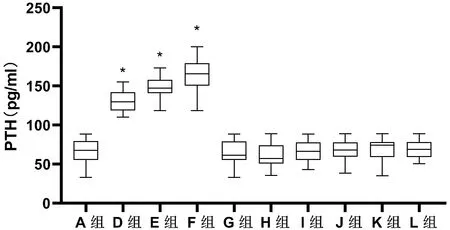
图7 电化学发光法检测各组甲状旁腺激素浓度(与A组比较,*P<0.001,n=32例)
3 讨 论
目前DJ-1在肾脏疾病中表达的研究多集中在细胞内表达水平上,尚无细胞外相关报道。在急性肾损伤模型中,Leeds等[15]发现内毒素处理小鼠24h后DJ-1蛋白表达较4h升高更明显,且主要表达在肾小管。Eltoweissy等[16]用促纤维化激动剂ANG Ⅱ(0.5mmol/L)或PDGF(10nmol/L)处理肾小管上皮细胞,DJ-1蛋白与纤维化标志物表达平行升高;在纤维化小鼠模型中同样观察到DJ-1蛋白表达随模型周龄增加而逐渐升高。然而,Yin等[17]报道5ng/mL TGF-β1处理肾小管上皮细胞后前36h DJ-1表达逐渐升高,但随后开始下降;同时在UUO模型中发现DJ-1蛋白表达低于对照组。这种差异或许与药物浓度及模型不同有关。我们用10μg/L TGF-β1处理肾小管上皮细胞后,随着时间的延长,细胞外DJ-1蛋白分泌增加,但其是否能在CKD患者血清中检测需进一步临床研究证实。
此外,本研究首次发现加入细胞外DJ-1蛋白可以刺激甲状旁腺细胞增生及PTH分泌,这种作用可以被FGFR1抑制剂SU5402阻断,免疫共沉淀同时证实了细胞外DJ-1与FGFR1结合,并使其磷酸化。前期研究发现甲状旁腺上的FGFRs-Klotho复合物可以与FGF23结合,通过活化丝裂原活化蛋白激酶旁路发挥对甲状旁腺激素合成的调控作用[5]。体外和体内试验均证明FGF23/FGFR1可减少PTH信使RNA合成和抑制PTH分泌,上调甲状旁腺细胞1-α羟化酶表达,增加局部1,25(OH)2D3合成,发挥对PTH的抑制作用[6]。目前认为FGF23与FGFR1结合是继发性甲状旁腺功能亢进的主要调节机制,但本研究首次发现了DJ-1/FGFR1可能也参与其中。
另外,我们通过Western blot检测发现下游信号通路P-ERK1/2被激活。但抑制FGFR1后,P-ERK1/2蛋白的表达仅轻度下降。一方面ERK通路可由生长因子、细胞因子及G蛋白耦联受体的配体等多种途径激活,单纯抑制FGFR1不能完全阻断ERK1/2的活化,推测细胞外DJ-1蛋白可能还与其它分子存在相互作用;另一方面DJ-1/FGFR1相互作用后下游可能也不仅仅激活了ERK1/2蛋白,其它下游途径有待进一步深入研究。

