劈离式肝移植围手术期管理
李川 赖彦华
肝移植是目前终末期肝病唯一有效的治疗手段,而供肝短缺一直是全球性的问题。劈离式肝移植是将1个供肝分割并移植给2例患者,实现“一肝两用”的目的,扩大供者数量。相比常规肝移植,劈离式肝移植在技术上要求更高,围手术期并发症发生风险增大,并有可能将1个高质量的供肝转化为2个边缘供肝,因此对术前评估(供肝评估、受者选择)、受者及术后并发症的管理就显得尤为重要。本文将结合我中心的工作体会,对劈离式肝移植围手术期管理进行讨论,为促进劈离式肝移植发展提供参考。
1 术前评估
劈离式肝移植术前评估包括供肝的评估与受者的选择。劈离式肝移植对供者的选择更为严格,主要集中在供者年龄、供肝是否存在脂肪变性及其程度、重症监护室(intensive care unit,ICU)入住时间等方面,各中心采用的标准大致相同。2020年中国《劈离式肝移植专家共识》制定的标准如下:年龄<50岁,ICU入住时间<5 d,血流动力学稳定,肝脏脂肪变性程度<10%,天冬氨酸转氨酶(aspartate aminotransferase,AST)/丙氨酸转氨酶(alanine aminotransferase,ALT)<3倍正常值上限,总胆红素<2倍正常值上限,谷氨酰转移酶<50 U/L,血清钠<160 mmol/L及冷缺血时间<10 h[1]。由于供肝短缺,对于质量良好,供者年龄为50~55岁的供肝,在严格控制冷缺血时间的情况下,我中心也常规使用,并取得良好效果[2]。另外,只要匹配程度良好[无或单次低剂量血管加压药治疗,脑死亡供者,移植物与受者质量比(graft to recipient weight ratio,GRWR)为2%~4%],使用儿童(<7岁)供肝也能取得令人满意的效果[3]。而在对受者的选择上,需更加谨慎,应尽量避免GRWR过低,谨慎选择终末期肝病模型评分过高(>30分)、重度门静脉高压以及门体分流明显的受者[1]。
2 受者管理
劈离式肝移植受者的围手术期管理不仅需要注意常规肝移植术后的呼吸功能、心血管血流动力学监测、神经系统监测、移植肝功能、肾功能监测等,还需结合劈离式肝移植的特点,监测出入量平衡情况,引流液的量和性状(浆液、血性或胆汁等),采用床旁超声动态监测肝动脉、门静脉、肝静脉情况,以及进行超声血容量评估和中心静脉压监测。
2.1 液体管理
终末期肝病患者术前往往存在严重的低蛋白血症,导致第三间隙液体量增加,血容量相对不足。对这类患者,应每日详细记录24 h出入量及体质量变化,尽量纠正低蛋白血症,以保持血清白蛋白水平>40 g/L为宜,限制晶体液入量的同时给予适当利尿,尽可能在减少第三间隙液体的同时保证充足的有效循环血容量,密切监测电解质,防止低钾血症的发生。肝移植术后大剂量使用糖皮质激素、早期分解代谢增加、全身毛细血管渗漏综合征等会导致受者全身各器官发生一定程度的水肿,此时液体管理应遵循量出为入原则,术后前3 d内至少有2 d液体负平衡≥300 mL可以有效减少肺部并发症的发生[4]。我中心结合患者术前水钠潴留严重程度及术中出入量调整每日液体负平衡的量,在循环稳定前提下尽可能保持全身较“干”状态,可以减少肺部并发症及腹部的渗出,有利于肝断面和各个吻合口愈合。
2.2 肺功能管理
重度肺动脉高压(≥45 mmHg,10 mmHg=1.33 kPa)被列为肝移植的禁忌证。相对于术前无肺动脉高压患者,轻中度肺动脉高压(25~44 mmHg)患者肝移植术后的院内不良事件发生率及1年内移植肝失功风险较高[5]。采用严格的液体管理保护右心功能,有利于移植肝恢复及降低肝静脉压力,减少肝断面出血风险。肝移植术后尽早脱机拔管有利于降低肺部并发症发生的风险[6]。对术前合并肝肺综合征的受者,术后应早期拔管预防呼吸机相关性肺炎,吸入纯氧以维持血氧饱和度(oxygen saturation,SaO2)≥85%,同时避免液体潴留,氧合不佳的受者可应用体外膜肺氧合来过渡[7]。我中心采取全流程肺康复锻炼,术前评估与纠正,术后在ICU期间康复师即到床旁指导肺康复锻炼,降低了受者术后肺部并发症的发生率,特别是肺功能不全和年龄较大的受者[2]。
2.3 心功能管理
术前应完善超声心动图、心肌酶谱、心肌标志物等常规监测,有胸闷、活动后心前区不适、糖尿病史的高龄患者,可考虑行冠状动脉造影等排除冠状动脉粥样硬化性心脏病。术后注意出入量监测,避免心脏前后负荷增加,同时注意电解质的平衡。术后出现心房颤动时,可使用胺碘酮,其对移植肝无不良影响[8]。
2.4 营养管理
等待肝移植手术期间,可采用患者主观整体评估(patient-generated subjective global assessment,PGSGA)、营养风险筛查(nutritional risk screening,NRS)等综合评估患者的全身营养状况,建议每日摄取35~40 kcal/kg能量,如果患者食欲较差,预计营养不能满足需求时,可通过给予肠内营养为主的方式尽快改善患者的营养状况[9-11]。术后应尽早进行肠内营养,排除肠内营养禁忌证后,建议以10~20 mL开始,并在2~3 d内逐渐达到最大目标[12]。
2.5 凝血功能管理
由于劈离式肝移植创面较大,开放后可能导致创面渗血较多,术后出血的风险也会增高,断面出血的预防依靠肝脏劈离过程中血管的仔细结扎和围手术期凝血功能的监测调整,而不是依赖术后止血药物的使用。供肝获取时应仔细缝扎断面血管,肝门板断面的细小动脉也要予以缝扎。对于术前凝血功能较差的患者,可于术前2~3 d内适当输注新鲜冰冻血浆、凝血酶原复合物及冷沉淀等补充凝血因子,减少出血。术前及术中进行血栓弹力图检测可帮助全面评估凝血功能[13]。无肝前期主要以术前凝血因子缺乏以及术中出血导致的凝血因子、血小板消耗为主,可适当输注新鲜冰冻血浆、红细胞、冷沉淀等物质,防止游离肝脏时创面渗血过多。无肝期由于机体处于低凝及纤溶状态,出血风险进一步增加,然而过度补充凝血物质易导致移植肝血栓形成风险增加,故此期不主张过度纠正凝血功能,尽量缩短无肝期才是避免凝血功能进一步加重的根本。在新肝期,可根据创面渗血程度适当补充新鲜冰冻血浆、冷沉淀等物质。如果术后早期移植肝逐渐发挥正常功能,且引流量不多,可不用输注凝血物质,以防增加肝动脉血栓形成的风险[14]。
2.6 肾功能管理
良好的肾功能是劈离式肝移植术后液体调节、中心静脉压调节的重要保障,劈离式肝移植术后肾功能保护策略与常规肝移植一致。肝移植术后早期联合应用钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂(如依维莫司),可减少CNI类药物的使用剂量,从而减轻肾毒性。研究表明,肝移植术后1个月引入依维莫司并减少他克莫司的暴露与单用标准剂量他克莫司相比,使用低剂量他克莫司和依维莫司可改善肾小球滤过率,且不增加急性排斥反应、移植肾失功或受者死亡风险[15]。然而,在肝移植术后早期使用西罗莫司对肾功能的保护作用还存在争议。
3 术后并发症管理
3.1 感 染
供者的选择和维护是降低供者来源性感染的关键因素。高通量测序技术的常规应用弥补了传统培养阳性率低和时间久的缺点,有利于及早进行感染的干预。由于肝移植术后免疫功能低下,感染风险极高,尤其是真菌感染。预防性抗真菌治疗现在被认为是肝移植术后管理的基石,棘白菌素类抗真菌药物对CNI类药物血药浓度影响小,是预防的首选。治疗上,伏立康唑是侵袭性曲霉病的首选药物,而棘白菌素和两性霉素B脂质体由于抗感染强度欠佳作为次要选择[16]。对侵袭性曲霉病和侵袭性假丝酵母病,目前指南建议术后预防抗感染的时间延长至14~21 d[17-18]。米卡芬净和卡泊芬净同样被证实安全有效[19-20]。
3.2 血管并发症
劈离肝脏过程中需要对肝动脉、门静脉和肝静脉进行分配,因此增加了术后血管并发症发生风险。有条件的尽可能在术前对供者进行CT血管造影,了解上述血管有否变异,增加手术确定性。没有条件或者肾功能不佳不适合进行CT血管造影者,可采用超声造影或床旁彩色多普勒超声进行门静脉类型评估,如发现门静脉右前支汇入门静脉左支者则不适合进行劈离,我中心评估工作见图1。在肝中静脉的分配上,大多数情况下采取将肝中静脉完全劈离给右半肝的方式,也可将肝中静脉主干保留于左半肝,而对右肝Ⅴ、Ⅷ段肝中静脉分支进行重建,以及将肝中静脉沿正中劈开,取供者髂静脉分别将左右半肝的肝中静脉修补成形[21-22]。因此术后需常规进行抗凝治疗,并予彩色多普勒超声动态监测肝静脉血流。
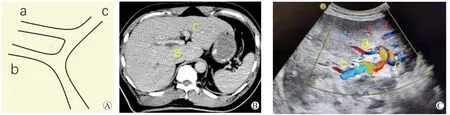
图1 门静脉变异示意图及影像学检查结果Figure 1 Schematic diagram and imaging examination results of portal vein variation
肝动脉血栓形成是肝移植术后早期严重的并发症,供肝获取及修整时应动作轻柔,避免损伤动脉内膜。术后密切监测移植肝超声,查看动脉血流情况。肝动脉血栓一旦形成,应尽早行手术治疗,小部分患者(约10%)采用保守治疗可以取得成功[23]。肝动脉狭窄主要以吻合口狭窄多见,可首选介入治疗,主要有经皮腔内血管成形术及血管内支架置入术,目前来说这两种术式疗效相似,但支架置入术后再狭窄的发生率更低[24]。当受者肝动脉血管条件较差(如存在动脉夹层),不适合与供肝动脉进行端端吻合时,可尝试取受者的脾动脉、髂内动脉、腹腔干、结肠中动脉或人工血管进行血管重建,搭桥的部位常取腹主动脉[25]。术后肝动脉破裂出血常继发于供者来源性感染,表现为腹腔出血,其病死率高,一经发现应尽早行开腹切除被细菌感染的动脉,可用供者髂动脉桥接血管两端,但如果仅仅简单的缝合止血有再次破裂出血的可能[26]。术后门静脉血栓(portal vein thrombosis,PVT)形成较少见,主要危险因素有术中门静脉取栓不完全、门静脉内膜损伤、既往有脾切除史、术后高凝状态等,术中发现PVT时,视PVT分期处理。早期PVT(Yerdel分级Ⅰ~Ⅱ级)通常可以通过血栓切除术进行处理,而Yerdel分级Ⅲ级PVT可选择肠系膜上静脉、脾静脉、胃左静脉用来与移植肝的门静脉进行吻合,但完全性门静脉肠系膜血栓形成则是一个巨大的挑战,多器官联合移植可能是其唯一的选择[27-28]。对急性梗阻的门静脉血栓患者,首选急诊手术解除梗阻恢复门静脉血流[29]。
3.3 胆道并发症
胆管损伤和术后胆漏是劈离式肝移植围手术期需要关注的重点。在左外叶和右叶的供肝劈离中,通常认为没有必要进行胆道造影,而在进行左右半肝劈离时,术中胆道造影有助于识别复杂的胆道解剖特征。主要目的是辨别汇入到左肝管的右后部胆管,并准确识别S4段胆管的走形。肝断面的仔细结扎缝合和肝门板的缝合,有利于减少小胆管造成的胆漏风险。
肝脏断面放置引流管有利于识别是否存在胆漏。拔除引流管后的迟发胆漏往往形成胆汁湖(图2),可以采用经皮肝穿刺引流的方法[2]。目前常规肝移植胆管端端吻合时不留置T管,尽管肝移植发展早期认为留置T管能降低胆道狭窄的风险并预防胆漏的发生,但更多研究表明留置T管并不能降低术后胆漏及胆管狭窄的发生率[30]。磁共振胰胆管成像是目前唯一一种诊断肝移植术后胆道并发症且具有高灵敏度(0.96)和特异度(0.94)的无创方法[31]。劈离式肝移植中是否留置T管是一个值得关注的问题,应由经验丰富的医师在术中做出决定。我中心常规不留置T管,但对胆总管较细、供受者胆管不匹配、探查胆总管通畅性存在不确定的受者,为降低胆道压力减少断面胆漏的风险,选择放置T管更为稳妥(图3)。
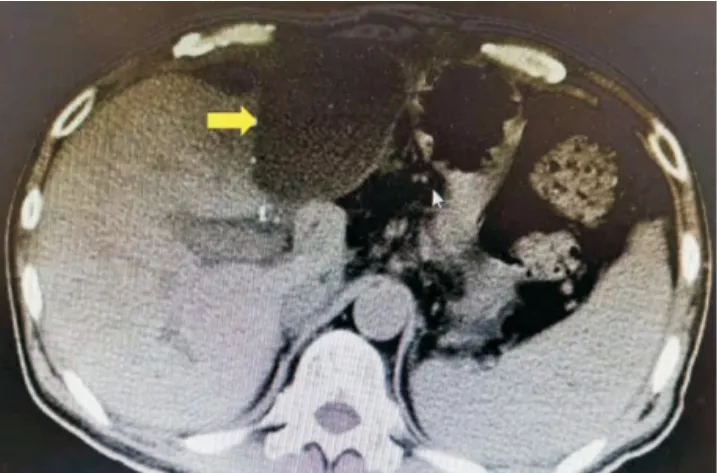
图2 劈离式肝移植术后胆汁湖形成的CT图像Figure 2 CT image of bile lake after split liver transplantation
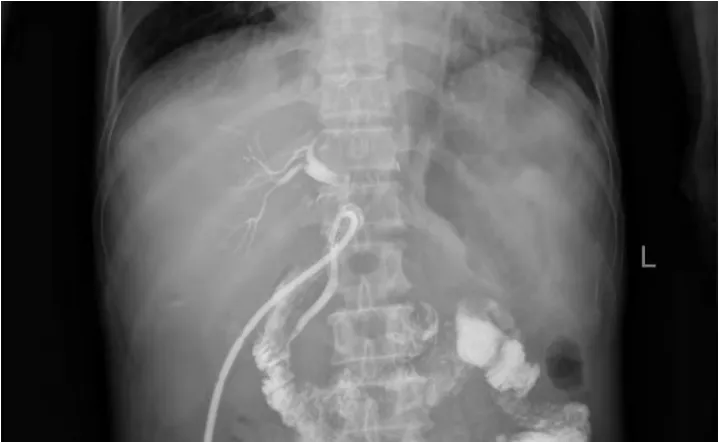
图3 T管留置的胆道造影图Figure 3 Cholangiography image with indwelling T tube
3.4 小肝综合征
小肝综合征的防治重点在于术后肝功能、腹腔积液及凝血功能监测。排除技术性(血栓形成、静脉回流受阻或胆漏)、排斥反应、感染(胆管炎和败血症)等问题后,接受小体积肝脏(GRWR<0.8%)的受者在术后1周内连续3 d具有以下临床表现中的2种即可诊断为小肝功能不全:(1)总胆红素>100 μmol/L;(2)凝血酶原时间国际标准化比值>2;(3)肝性脑病3~4期。需要再次肝移植或死亡的受者则诊断为小肝无功能[32]。为尽量避免小肝综合征,术前应严格把控供肝的质量和冷保存时间,常规超声监测门静脉压力与血流,避免流出道梗阻,尽量改善受者术前各器官功能等[33]。
4 小 结
劈离式肝移植的发展是拓展供肝来源的重要方法之一,如何有效降低术后并发症发生率,需要精准的术前评估、精细的手术操作以及精良的术后管理。尽管目前仍面临着诸多困难和挑战,但随着手术技术的不断进步和围手术期管理水平的提升,劈离式肝移植将有更大的应用前景。

