成人原位肝移植术后常见胆道并发症的诊疗
胡鑫文 李亭
经过长达半个世纪的发展,肝移植已成为治疗终末期肝病的有效方法,良性病变患者肝移植术后10年生存率可达60%。由于外科技术、供者选择、器官保存和运输、免疫抑制药、围手术期管理的长足进步,肝移植总体手术并发症明显下降,但胆道并发症发生率仍处于较高水平。据报道,原位肝移植术后胆道并发症的发生率为5%~30%,病死率高达10%。最常见的胆道并发症包括吻合口狭窄、非吻合口狭窄和胆漏,胆管结石、铸型、Oddi括约肌功能障碍、胆道出血、胆汁瘤、残余胆管等较为少见。肝移植术后胆道并发症是多种病理过程共同作用的结果,病因及发病机制尚不明确,可能与移植类型、胆管重建方式、特殊原发疾病、肝动脉血栓形成或狭窄、缺血-再灌注损伤、免疫因素、感染、胆盐毒性作用等因素相关。胆道并发症的治疗首选内镜逆行胰胆管成像(endoscopic retrograde cholangiopancreatography,ERCP),经皮穿刺肝胆道成像(percutaneous transhepatic cholangiography,PTC)是治疗方式的有效补充,但部分患者仍需外科手术治疗,甚至需行再次肝移植手术[1-2]。
1 肝移植术后胆道并发症的病因及发病机制
1.1 外科手术技术因素
1.1.1 胆管端-端吻合与胆管空肠Roux-en-Y吻合 胆管端-端吻合具有恢复胆道正常解剖结构、保持Oddi括约肌功能、避免肠内容物反流、操作简单快速、便于施行ERCP等优点,因此成为肝移植胆道重建的首选方式。当存在供受者胆管口径不匹配、受者伴有肝外胆管异常(胆道闭锁或原发性硬化性胆管炎)、既往多次胆道手术史、胆管本身质量欠佳、接受再次移植等情况时,则考虑行胆管空肠Roux-en-Y吻合。因此,胆管空肠Rou-en-Y吻合的胆道狭窄发生率高于胆管端-端吻合。胆道重建的技术要点在于使用可吸收缝线、保证良好的胆道血液供应、适当保留胆管周围组织、保证完好的胆管黏膜、保持管腔通畅、把握缝合边距与针距和进行无张力缝合[3-4]。
1.1.2 T管放置 时至今日,关于胆管重建术是否放置T管仍存在显著的争议。早期大部分肝移植学者认同T管的积极影响,认为放置T管有助于观察胆汁的分泌量和性状,便于对移植肝功能进行评估,胆汁外引流还有助于缓解胆管内压力,预防胆道并发症的发生,必要时还可通过胆道镜行进一步诊治。然而最近的一项荟萃分析显示,放置T管虽可在一定程度上预防胆管狭窄,但同时增加胆漏、胆管炎及总体胆道并发症的发生风险[5]。随着手术方法的改进、围手术期管理、快速康复理念的发展,总体上主流思想从常规放置T管转变为在胆道狭窄高风险患者中使用T管。留置T管的胆漏风险大部分来自于术后T管拔除。Navez等[6]通过隧道式腹膜后路径放置T管,有效降低了T管拔除后胆漏发生率。根据López-Andújar等[7]的研究,使用乳胶T型管有助于降低胆道并发症发生的风险。当存在发生胆道并发症的高危因素时,如供受者胆管不匹配、供者或受者的胆管直径<7 mm、原发性硬化性胆管炎行胆管端端吻合、冷缺血时间>11.5 h、再次肝移植等,放置T管可能使受者受益[5,7-8]。
1.1.3 胆管内支架 使用胆管内支架是否真的能减少胆管端-端吻合中的胆道并发症?在Yoon等[9]的回顾性研究中显示,使用胆管支架不能降低胆道并发症的总体风险,但显示了令人满意的安全性,没有显著的支架相关不良事件。目前使用的大部分胆管支架不可降解,需要通过后续的侵入性操作取出,因此增加了额外的成本和相关胰腺炎、出血等风险。经过多年的研究,已有关于生物可降解支架在临床实践中应用相关报道[10-11]。Zhang等[12]报道了在猪模型中,携带脂肪来源间充质干细胞的胆管支架植入能减轻吻合口纤维化,促进局部血管生成。因此,依托于材料学与免疫学的进一步发展,胆管支架在临床的应用前景十分可观。
1.1.4 胆管血供 胆管的血液供应仅来自于动脉系统。动脉发出分支相互吻合,形成沿胆管左右两侧“3点钟”“9点钟”走行的边缘血管供应胆总管血供,末端动脉分支形成毛细血管网、胆道周围血管丛滋养肝门和肝内胆管。大约60%的血供来源于胃十二指肠动脉,30%~40%的血供来自肝动脉,非轴向供血稀疏,仅占不到5%。陈焕伟等[13]提出保留供肝胃十二指肠动脉的改良修肝方法可保持胰十二指肠上后动脉及周围组织的完整性,有利于保护肝外胆管的血供,降低肝外胆管缺血所致的肝移植术后胆道并发症发生率。
1.2 肝动脉狭窄与血栓形成
肝动脉狭窄或血栓形成导致胆管上皮灌注不足,出现难治性胆管狭窄、胆漏等并发症,其严重程度与动脉并发症发生时间有关。研究显示,如果肝动脉狭窄发生时间在术后早期(≤90 d),且肝功能≥3倍正常值上限,需要胆道重建(通常是胆肠吻合)的可能性更高[14]。及时的血管再通治疗可能缓解胆道并发症的进展,当出现移植肝失功或坏死时需再次肝移植。由于动脉侧支循环建立,术后晚期(>90 d)肝动脉血栓形成导致的胆道并发症表现呈多样性,如胆管炎、胆瘘、脓肿等,部分患者可无临床症状,主要通过内镜胆道干预治疗[15]。因此,肝移植术后肝动脉的血流动力学监测十分重要。
1.3 缺血-再灌注损伤
胆管的血液供应单一,因此,胆管上皮细胞较肝细胞更容易出现直接缺血性损伤。研究发现再氧化过程中胆管细胞内活性氧浓度增加,而抗氧化的谷胱甘肽水平较低,因此再灌注过程中胆管细胞容易发生再氧化损伤。较长的冷缺血时间和热缺血时间会增加肝移植术后胆管病变的发生率,目前大多数移植中心要求冷缺血时间不超过10 h,热缺血时间不超过30 min。由于器官资源短缺,心脏死亡器官捐献(donation after cardiac death,DCD)成为移植器官的重要来源,与胆道并发症的高风险相关。DCD器官使用的改善紧随于器官灌注与保存技术的进步。2021年,van Rijn等[16]的多中心随机对照研究比较了低温氧合机械灌注与传统的静态冷保存后移植相关并发症的风险,结果表明低温氧合机械灌注降低了缺血性胆管病变的发生风险。常温机械灌注也表现出了类似的优势[17]。胆周腺(peribiliary gland,PBG)是位于肝内、肝外胆管壁内的管泡状腺体,通过腺小管与胆管腔相通,是多功能分化的胆管树干/祖细胞的生态位。胆管树干细胞对缺血-再灌注损伤相对耐受,同时通过增殖和表达血管内皮生长因子-2,使受损胆管上皮再生恢复。PBG与胆周血管丛损伤导致的再生不足可能是胆管狭窄的重要原因[18-19]。而低温氧合机械灌注表现出对PBG的保护作用[20]。
1.4 免疫因素
ABO血型不相容和排斥反应可导致肝内胆管广泛不规则狭窄。ABO抗原是细胞表面的寡糖,在人体多种细胞上表达。在肝脏中,ABO抗原主要表达于血管内皮细胞和胆管细胞。目前通过血浆置换、免疫吸附、脾切除、使用静脉注射用免疫球蛋白和抗 CD20 单克隆抗体(利妥昔单抗)等方法已能克服ABO血型不相容移植的诸多困难,弥漫性胆道狭窄成为亟需解决的主要问题[21]。多项研究提示间充质干细胞具有胆管损伤的潜在修复能力[12]。最近的一项前瞻性对照研究结果显示,相较于利妥昔单抗,输注来源于脐带的同种异体间充质干细胞更有助于预防ABO血型不相容肝移植术后胆道并发症[22]。
1.5 胆盐毒性作用
生理情况下,由于胆汁酸盐与磷脂形成复合物,疏水性胆盐的毒性作用被部分中和,同时胆管上皮细胞分泌HCO3-,碱性环境下疏水胆汁酸盐脱质子,使其对脂质细胞膜的去垢性能降低。Hoekstra等[23]利用Mdr2+/-基因鼠仅向胆汁中分泌正常量50%的磷脂的特性进行比较研究,来自Mdr2+/-供体小鼠的肝移植受体小鼠出现了胆管损伤、胆汁淤积。Buis等[24]对111 例肝移植受者术后胆汁成分进行测定,结果显示发生胆道狭窄的受者胆汁中的磷脂/胆盐比例较低。这可能是由于肝移植术后,移植物再灌注后即可产生胆汁酸盐,但磷脂分泌的功能恢复较慢。除了充分的胆道冲洗,熊脱氧胆酸亦可降低肝移植术后胆道狭窄、胆道结石和淤泥的发生率[25]。
2 肝移植术后胆道并发症的分类
胆道狭窄和胆漏是临床上最常见的肝移植术后胆道并发症,根据发生部位的不同,胆道狭窄又进一步分为吻合口狭窄和非吻合口狭窄(表1)。
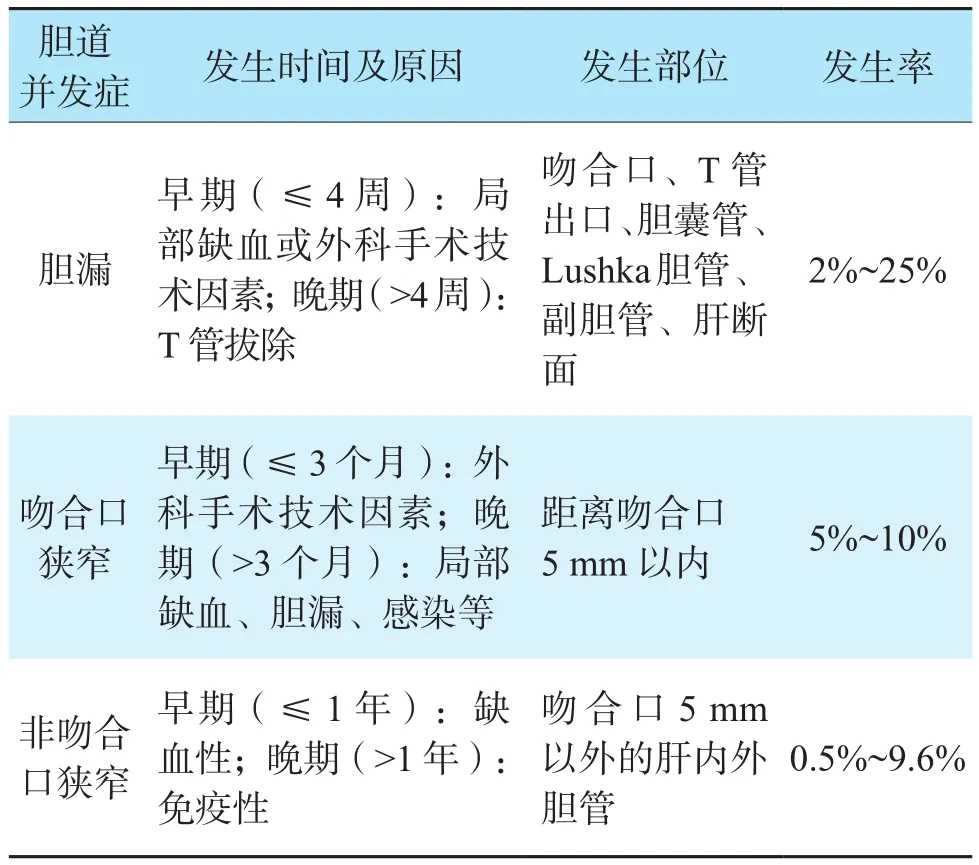
表1 原位肝移植术后常见胆道并发症Table 1 Common biliary complications after orthotopic liver transplantation
2.1 胆 漏
胆漏是肝移植术后最常见的并发症之一,发生率为2%~25%,可发生在吻合口、T管出口、胆囊管残端、Lushka胆管、副胆管、肝断面。根据发生部位可分为吻合口胆漏、非吻合口胆漏,根据发生时间是否>4周分为早期胆漏和晚期胆漏。早期胆漏的发生与外科手术技术有关,包括发生血管并发症导致胆管血供不足、胆管断端活动性出血、过度剥离胆管周围组织、胆管吻合张力过大、胆囊管残端缝合不当或使用电刀止血等。当出现胆道缺血性坏死、胆管远端梗阻和Oddi括约肌高压时,出现胆漏的风险增加。胆漏增加胆管狭窄的风险,反之亦然。晚期胆漏的发生与T管过早拔除有关。T管拔除后出现发热、腹痛或腹膜炎体征时,应怀疑胆漏。
2.2 吻合口狭窄
吻合口狭窄的定义是距离吻合口5 mm以内的单发狭窄,狭窄距离常常较短。吻合口狭窄的发生率为5%~10%,可发生在肝移植术后任何时期,但多发生于术后5~8个月。胆管吻合后水肿可导致相对狭窄,其中部分患者可发展成临床显著狭窄,机制不明。吻合口狭窄的发生与黏膜-黏膜吻合不充分、外科手术技术、局部组织缺血、愈合过程中的胆管纤维化、胆漏、感染等有关。
2.3 非吻合口狭窄(缺血性胆道病变)
发生于距离吻合口5 mm以外的胆道狭窄称为非吻合口狭窄,常为多发,狭窄距离较长,发生时间略早于吻合口狭窄,常发生于术后3.3~5.9个月。非吻合口狭窄较吻合口狭窄少见,发生率为0.5%~9.6%,占胆道狭窄的10%~25%。Buis等[26]提出基于胆道树解剖对胆道病变进行定位的方法,将胆道树分为4个区域,肝外胆总管包括肝门分叉(A 区)、一级和二级分支之间的胆管(B 区)、二级和三级分支之间的胆管(C 区)和肝脏周围的胆管(D 区)(图1)。基于病因,Moench等[27]将非吻合口狭窄分为3类,大血管病变、微血管病变和免疫原性。大血管病变主要由肝动脉血栓形成等造成的动脉供血不足引起。微血管病变的特点是缺血-再灌注损伤导致胆道周围血管丛损伤。de Jong等[28]对42例再次移植受者的肝门周围胆管进行组织形态学分析,研究结果表明胆道持续缺氧和缺乏再生是移植后非吻合口狭窄的关键发病机制。缺血性非吻合口狭窄通常发生在肝移植术后1年内,而肝移植术后1年后出现的非吻合口狭窄考虑由免疫介导。非吻合口狭窄包括一系列的胆道病变,从轻微的局部黏膜不规律到广泛弥漫的胆道多发狭窄,类似于胆道树的缺血性改变,因此非吻合口狭窄又称为缺血性胆道病变[29]。非吻合口狭窄的临床表现可无或轻微,或表现为反复胆管炎发作,因此其治疗暂无统一标准,应为患者制定综合的、个性化的治疗方案。
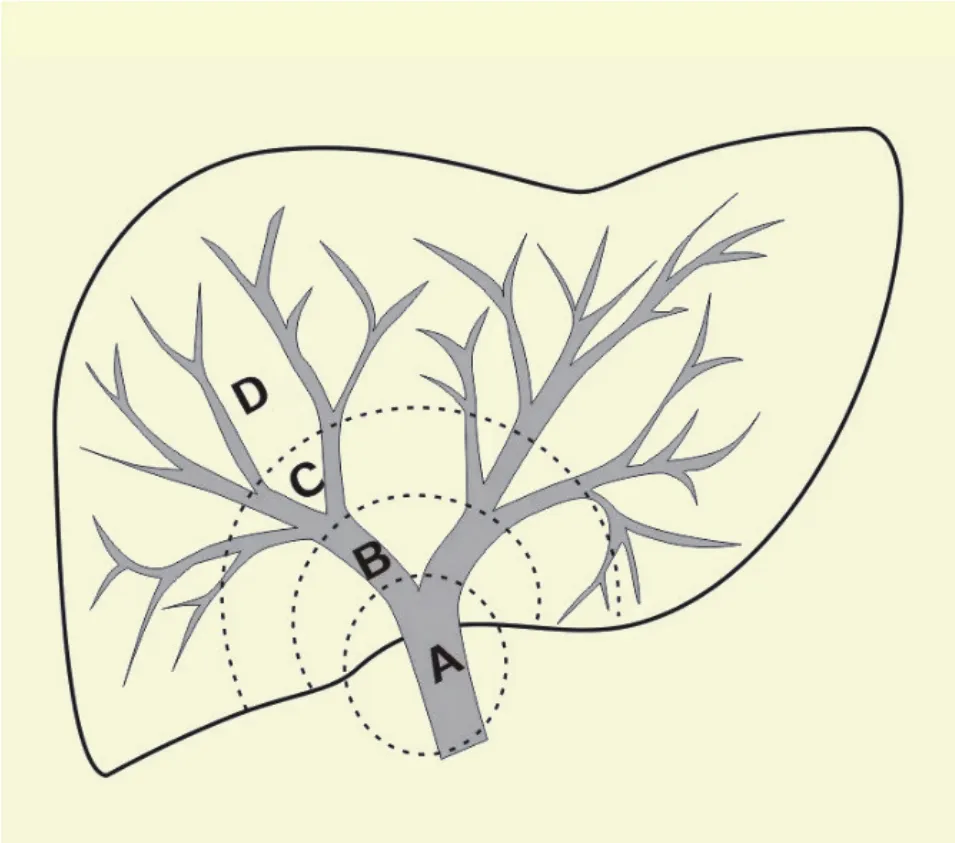
图1 非吻合口狭窄解剖位置分区Figure 1 Anatomic location division of non-anastomotic stenosis
3 肝移植术后胆道并发症的诊断
胆道并发症的临床表现不具有特异性,可表现为腹痛、发热、食欲减退、黄疸、瘙痒等,严重者出现胆管炎、腹膜炎、败血症。不同程度临床表现不同,部分患者可无临床症状。肝移植术后出现不明原因的血清胆红素升高、环孢素水平改变或腹腔引流液胆汁样改变,应警惕胆漏发生,无症状的血清γ-谷氨酰转移酶(γ-glutamyl transferase,GGT)或碱性磷酸酶(alkaline phosphatase,ALP)升高是部分患者的首要症状。彩色多普勒超声检查通常是筛查肝移植术后胆道并发症的第一步,同时可排除肝动脉狭窄或血栓形成等血管并发症。近年来,超声造影被用来检测肝门胆管的血流动力学情况,经T管胆管腔内超声造影可能是一种行之有效的诊断方法,但目前还缺乏大型移植中心的研究支持。由于彩色多普勒超声的灵敏度不足,当彩色多普勒超声出现阴性结果,但临床可疑胆道并发症时,应继续筛查。磁共振逆行胰胆管造 影(magnetic resonance cholangiopancreatography,MRCP)是首选的影像学诊断方法,具有无创、损伤小、准确度高的优点,适用于胆管端端吻合或胆肠吻合的患者[30]。经T管胆管造影、ERCP或PTC仍然是诊断胆道并发症的金标准。胆道并发症的组织学变化缺乏特异性,肝穿刺活检可与排斥反应、原发疾病复发、病毒性肝炎等行鉴别诊断。肝胆管亚氨基二乙酸(hepatobiliary iminodiacetic acid,HIDA)扫描对于胆漏具有一定的诊断价值,由于其在高胆红素血症患者中的检测存在较高的假阳性率,因此目前在临床应用较少。
4 肝移植术后胆道并发症的治疗
4.1 ERCP和PTC
ERCP和PTC不仅具有诊断价值,同时也是治疗胆道并发症的主要手段。ERCP可行Oddi括约肌切开、放置支架、鼻胆管引流降低胆管内压力,从而达到缓解胆漏的目的。80%~90%的吻合口胆漏可以通过ERCP放置胆道支架解决。由于免疫抑制状态下的患者愈合延迟,建议置入胆管支架时间8~12周。由于发病机制、病变部位、严重程度的差异,吻合口狭窄与非吻合口狭窄的治疗方式与治疗效果存在差异性。目前,胆道狭窄最常使用的治疗方式是ERCP+球囊扩张+多个塑料胆道支架置入。通过6~8 mm球囊反复多次扩张吻合口狭窄部位,然后放置1个或数个7.0~11.5 Fr塑料支架。为防止胆道淤泥或结石形成,一般每3个月重复行ERCP,进行球囊扩张和支架更换,疗程1~2年。治疗效果与支架留置时间、支架使用数量相关。根据Kao等[31]的研究,支架置入时间>12个月,97%的吻合口狭窄得到治愈,而支架置入时间<12个月治愈率为78%,ERCP次数为2.7~5.4次,每次置入1.9~2.5个支架。非吻合口狭窄通常使用4 mm球囊扩张,然后只放置1个8.5~10.0 Fr塑料支架。内镜治疗对于非吻合口狭窄效果较差,同时所需的治疗时间往往更长。透视下导丝无法穿过狭窄是内镜治疗吻合口狭窄失败的主要原因。对于复杂性胆道狭窄,ERCP结合胆道镜检查的会合技术可提高成功率[32-33]。SpyGlass单操作胆道镜具有操作简便、直视化、可行组织采样等优点,是对胆道并发症行系统性评估的重要方法,可区别ERCP难以诊断的胆道扭转、胆管铸型[34]。当内镜治疗失败时,PTC行经皮内外引流或支架置入是有效的替代治疗方式,也是胆管空肠Roux-en-Y吻合首选的治疗方式。单气囊、双气囊或螺旋小肠镜辅助下,行胆管空肠Roux-en-Y吻合的患者也可接受ERCP治疗[35]。当非手术治疗效果不佳时,应及时行手术治疗,包括胆道修复术、胆肠吻合术、再次肝移植术(图2)。
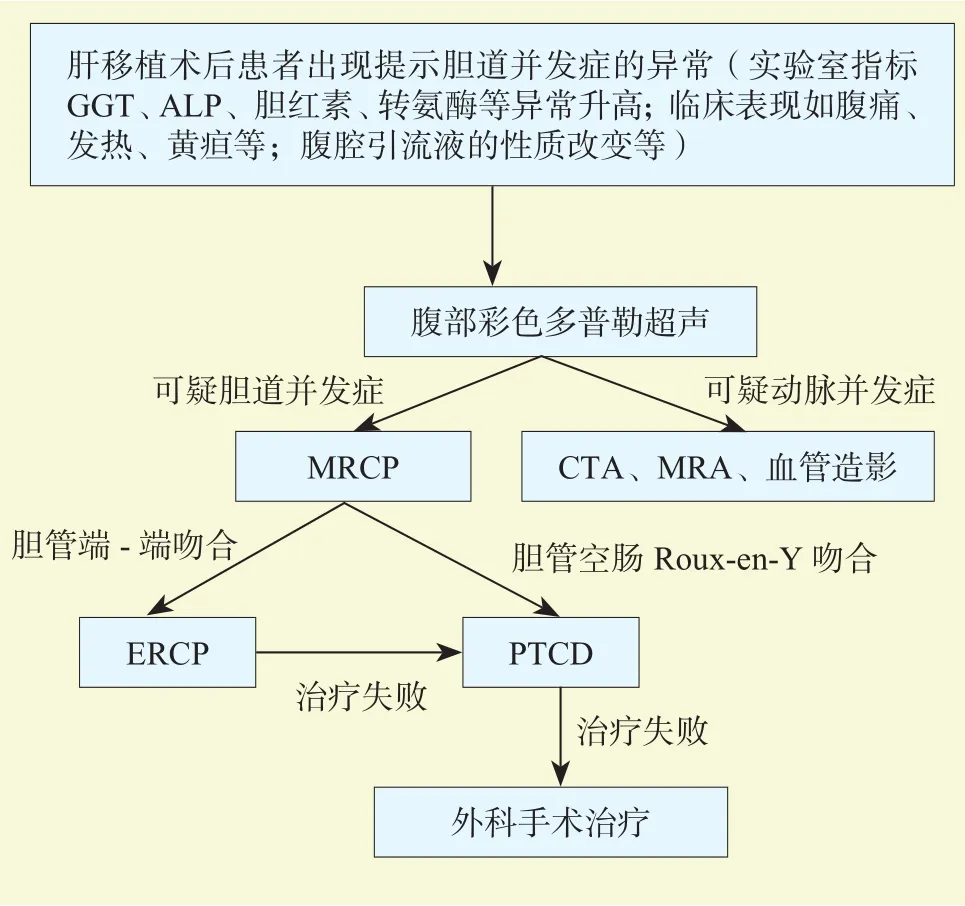
图2 原位肝移植术后胆道并发症的诊治思路Figure 2 Diagnosis and treatment idea of biliary complications after orthotopic liver transplantation
4.2 全覆膜自膨式金属支架
新的研究表明,全覆膜自膨式金属支架(fully covered self-expanding metal stent,FCSEMS) 可 能成为治疗胆道并发症的有效方法。多项研究显示FCSEMS在缓解良性胆道狭窄方面与塑料胆道支架具有可比性,且所需的ERCP干预次数更少[36-38]。但Coté等[39]报道了FCSEMS使用过程中高达16%的移位风险,此外还存在支架嵌顿、组织长入的风险。目前没有研究证明FCSEMS在治疗胆道并发症中的有效性明显优于普通塑料支架,FCSEMS的远期疗效仍需进一步研究。
4.3 磁力再通技术
对于ERCP和PTC治疗失败的胆管吻合口严重狭窄或闭塞,磁力再通技术可能是手术的替代治疗。磁力再通技术通过PTC和 ERCP将磁体分别放置在胆管吻合口狭窄的两侧,通过磁性吸力对合磁体,从而达到解决狭窄的目的[40]。Li等[41]采用磁力再通技术对9例肝移植术后发生良性胆道狭窄的患者进行治疗,取得 100%的治愈率,术后随访未发现吻合口狭窄复发。
4.4 细胞治疗
Sampaziotis 等[42]将表达红色荧光蛋白(red fluorescent protein,RFP)胆囊类器官注射到接受离体常温机械灌注的供肝的肝内胆管,实验开始时胆汁pH值<7.5,提示胆管缺血性损伤。供肝灌注正常体温的含氧血液和营养物质,维持近乎于生理的微环境100 h后,注射到表达RFP胆囊类器官的肝内胆管中,40%~85%检测到再生RFP细胞,并表达关键的胆道标志物,镜下未找到胆管病变的证据。相反,未接受注射的对照胆管发现缺血性损伤,表现为管腔上皮连续性丧失和腔内细胞脱落。并且,来源于注射表达RFP胆囊类器官的胆管的胆汁表现出更高的pH值和分泌量,证明移植的胆囊类器官具有改变胆汁成分的功能[42-43],揭开了胆道并发症基于细胞治疗的面纱。
5 小 结
胆道并发症仍然是导致肝移植术后移植肝失功和受者死亡的重要病因。外科手术技术、胆道缺血损伤、免疫因素是胆道并发症的主要危险因素,其中免疫因素介导的晚期胆道并发症治疗难度较大,需要进一步的研究阐明其机制。临床上明确诊断胆道并发症首选无创的MRCP,根据胆道重建的方式选择ERCP或PTC可行进一步诊断与治疗,基于内镜与放射介入的治疗手段可使90%以上的胆道并发症患者获得满意的治疗效果,少数患者需行补救性手术或因移植肝失功再次行肝移植术。近年来,肝移植研究在胆道并发症的各方面取得显著的进步,从发病机制到预防治疗,从对胆道微环境的深入理解到颇具优越性的机械灌注,胆道并发症领域的进步将为肝移植术后长期生存拉开新的序幕。

