肾移植术后IgA肾病复发
张寅生 彭形彤 杨庭楷 邢家利 文进 纪志刚
IgA肾病(IgA nephropathy,IgAN)是世界范围内最常见的原发性肾小球肾炎,也是进展为终末期肾病(end-stage renal disease,ESRD)的重要危险因素[1]。IgAN临床表现多样,主要特征为以IgA为主的免疫球蛋白在肾小球系膜和部分毛细血管袢中沉积。肾移植是IgAN所致ESRD的首选治疗方法,与其他肾病患者相比,IgAN患者通常更加年轻,合并症相对较少。然而,IgAN患者肾移植术后可出现原发病复发,导致肾功能恶化,影响移植物的存活率[2]。一项纳入504例受者的多中心回顾性研究表明,肾移植术后IgAN复发是移植肾丢失的常见危险因素,在诊断IgAN复发后8年,移植物丢失率可高达32%[3]。
目前,肾移植术后IgAN复发的研究领域进展相对缓慢,大多数研究都是样本量相对较小的单中心研究,且对肾移植后IgAN复发也缺乏公认的诊疗指南,移植肾IgAN复发的确诊有待准确评估,其治疗方案的选择及预后情况也有待进一步研究[3]。本文主要综述肾移植术后IgAN复发的发病机制、诊断、危险因素及治疗的最新进展,以期为肾移植术后IgAN复发的管理提供参考。
1 肾移植术后IgAN复发的发病机制
现阶段IgAN的发病机制尚未完全明确,目前认为IgAN的发生由遗传、环境、免疫等多重因素介导[4]。较为接受的是多重打击发病机制:(1)半乳糖缺陷型 IgA1(galactose-deficient IgA1,Gd-IgA1)生成过多为IgAN的始动阶段;(2)抗聚糖或糖肽的自身抗体因此产生;(3)抗聚糖抗体识别并与Gd-IgA1形成免疫复合物在系膜区沉积;(4)激活系膜细胞,诱导细胞因子、趋化因子和细胞外基质蛋白分泌,进而导致肾损伤[5-6]。
对多重打击发病机制中分子标志物的研究,可能有助于预测肾移植术后IgAN复发与进展程度,提供潜在的治疗靶点。Berthelot等[7]研究表明,移植前较高水平的血清Gd-IgA1和IgA-IgG免疫复合物以及较低水平的IgA-sCD89(IgA的骨髓细胞受体)循环复合物都可预测肾移植术后IgAN的复发情况。而Berthoux等[8]发现,与健康受试者相比,移植后血清Gd-IgA1的IgG自身抗体和IgAN复发风险较高有关。
近十年来,全基因组关联研究(genome-wide association study,GWAS)对研究IgAN遗传基础做出了显著贡献,发现了近20个IgAN的独立风险等位基因位点,但仍需进一步明确相关分子机制[9]。一项对20 612例欧洲与东亚血统IgAN患者的大型GWAS,除了确认主要组织相容性复合体(major histocompatibility complex,MHC)、补体因子H(complement factor H,CFH)、肿瘤坏死因子配家族成员13(tumor necrosis factor ligand super family member 13,TNFSF13)、HORMAD2和DEFA基因座的关联之外,还确定了多个新的IgAN基因座[如ITGAM-ITGAX、VAV3、CARD9、人类白细胞抗原(human leukocyte antigen,HLA)-DQB1、DEFA]在肠道黏膜中的作用,大多数基因座与炎症性肠病、肠上皮屏障的维持和对黏膜病原体的反应相关[10]。
补体系统调节异常也与IgAN复发有关。张春云等[11]研究表明,大部分肾移植术后IgAN复发的患者合并补体C3沉积,而少见C1q、C4沉积。也有研究证实甘露糖结合凝集素(mannose-binding lectin,MBL)途径参与IgAN复发过程,并与蛋白尿与肾损伤增加相关,存在C4d沉积的患者预后情况较差[12]。C1q在系膜上的沉积对肾移植术后IgAN复发也具有较高的预测价值[13]。
近期有研究表明,其他几种非特异性生物标志物可预测肾移植术后IgAN复发的风险,但其临床相关性需进一步在更大的独立人群队列中验证。如Garnier等[14]研究发现血清IgA水平与肾移植术后IgAN复发相关,可作为预测的生物标志物。Wu等[15]概述了肿瘤坏死因子(tumor necrosis factor,TNF)超家族中B细胞激活因子(B cell activating factor,BAFF)和增殖诱导配体(a proliferation-inducing ligand,APRIL)可通过降低血清IgA水平和IgA在肾小球中的沉积参与IgAN发病过程。Martín-Penagos等[16-17]发现相较于BAFF,APRIL与IgAN的相关性更高,肾移植术后APRIL早期和持续的升高可能诱导Gd-IgA1过度产生,加速IgAN的复发,但由于IgAN具有异质性,结论尚未明确。一项针对69例IgAN患者移植前后的临床研究数据表明,移植前血清APRIL高水平与移植后IgAN复发相关[18]。此外,Lee等[19]利用蛋白质组学确定尿液中丝氨酸蛋白酶抑制剂(serine protease inhibitor,SERPIN)A1、转铁蛋白、载脂蛋白(apolipoprotein,APO)A4和视黄醇结合蛋白(retinol binding protein,RBP)4可作为监测肾移植术后IgAN复发的生物标志物。
对IgAN发病机制的研究可以更好地识别高复发风险患者,有助于提高诊断的灵敏度和特异度,对改善治疗方案和预后也有一定临床意义。
2 肾移植术后IgAN复发的诊断
IgAN复发可定义为临床复发和组织病理学复发。临床复发表现具有高度异质性,可不表现出明显的临床症状,多以无症状的镜下血尿、蛋白尿和移植肾功能进行性下降为主要特征,较少表现为与上呼吸道感染相关的肉眼血尿。组织病理学复发则表现为系膜IgA沉积伴或不伴系膜增生,少数具备新月体特征[20]。组织病理学复发往往早于临床复发,Ortiz等[21]研究表明,约52%的患者肾移植术后2年内出现组织学复发但不伴蛋白尿或血尿。因此,对于肾移植术后IgAN复发的主要诊断手段依赖于肾脏的程序化活组织检查(活检),包括光学、免疫荧光及电子显微镜检查,从而鉴别复发性IgAN与慢性排斥反应、药物毒性、感染等因素导致的肾小球疾病。其诊断标准包括:(1)移植前经肾活检确诊原发病为IgAN;(2)肾移植术后经肾活检确定再发相同的病理类型;(3)移植肾的零点穿刺活检排除供肾IgAN(部分研究)[4]。但实际临床工作中很难具备以上3种要素,很多患者发现该病时已进入ESRD阶段,难以明确原发病,或复发时因症状轻微不愿实行肾活检,以及活检适应证、诊断标准和随访时间的差异,现有文献报道的IgAN复发率为4.5%~70.5%[22-23]。
此外,IgAN的复发具有时间依赖性。一项回顾性分析澳大利亚和新西兰透析移植登记处(Australia and New Zealand Dialysis and Transplant Registry,ANZDATA)肾移植受者资料的研究发现,在2 501例活检证实原发病为IgAN的肾移植受者中,术后5、10、15年的疾病复发率分别为5.1%、10.1%、15.0%,复发率随移植时间延长而增加[24]。
由于长期的免疫抑制状态及合并排斥反应等,肾移植术后IgAN复发相较于普通人群的IgAN,其病理表现更具多样性[25]。2009年提出的IgAN牛津病理分型包括系膜增殖(mesangial hypercellularity,M)、毛细血管内增生(endocapillary hypercellularity,E)、节段性肾小球硬化/粘连(segmental glomerulosclerosis/adhesion,S)和肾小管萎缩/间质纤维化(tubular atrophy/interstitial fibrosis,T),对于IgAN诊断的标准化具有重要作用[26]。有研究发现伴新月体形成的复发性IgAN移植肾失功的发生率达88.8%,表明新月体形成对复发性IgAN的预后有着重要价值[27]。因此,2017年将细胞和(或)纤维细胞性新月体(cellular/fibrocellular crescents,C)也纳入了预后参数,IgAN牛津病理分型更新为MEST-C[28]。具体IgAN牛津病理分型见表1[28]。
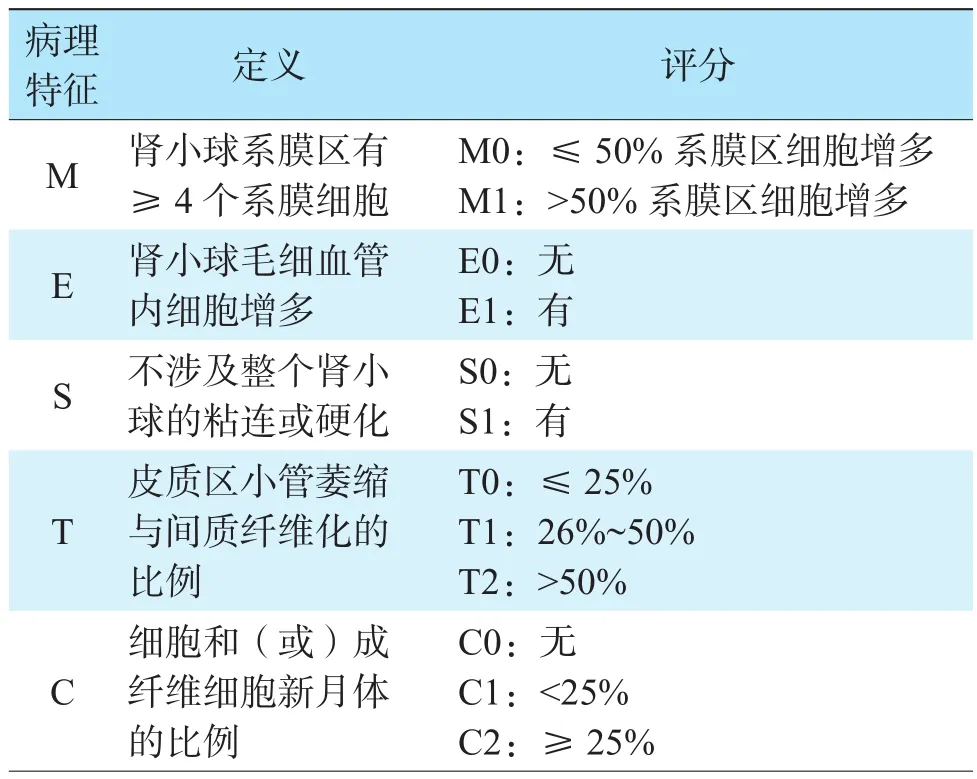
表1 IgAN牛津病理分型[28]Table 1 Oxford pathological classification of IgAN
有研究认为这种病理分型系统在肾移植术后IgAN复发预测中未见明确优势,可能与免疫抑制治疗及供者因素干扰了病理参数的预测价值有关[13,29]。也有很多研究表明各亚型对IgAN复发的预后具有一定预测价值。一篇纳入16项回顾性队列研究的荟萃分析验证了M、S、T病变可预测肾功能下降和移植肾存活时间,而E与免疫抑制治疗反应相关,C与进展为肾衰竭密切相关[30]。近期韩国一项纳入333例肾移植术后IgAN复发受者的双中心回顾性队列研究进一步验证了M、E、S、C与复发性IgAN预后相关[31]。季曙明等[32]研究148例肾移植术后IgAN复发受者的资料发现,与非复发组相比,复发组新月体形成、肾小球粘连、系膜细胞增生、肾小球节段硬化和肾间质纤维化等发生率明显增高。张春云等[11]研究表明,肾移植术后IgAN复发类型为T与术后肾功能下降有关,S与蛋白尿相关,伴球囊粘连的患者蛋白尿更显著。杨喆等[25]发现,E往往与合并急性抗体介导的排斥反应呈正相关,合并慢性排斥反应的患者可出现肾小球毛细血管基底膜双轨征,也体现了发病机制的复杂性。基于以上结果,在IgAN复发受者中进行移植物活检,并进行牛津病理分型,可有效评估受者预后。
3 肾移植术后IgAN复发的危险因素
由于危险因素是通过人群队列研究分析发现的,因而难以确定其真正因果关系,且不同研究的结果也存在一定差异。但多个随访时间较长的回顾性研究就移植时年龄较小、原发病快速进展、未使用糖皮质激素(激素)或早期停用激素的免疫治疗方案、供者因素和HLA等位基因亚型数个危险因素达成共识[4,33]。
移植时年龄较小是复发的危险因素,可能因为年轻IgAN患者异常免疫复合物的形成与沉积较高龄患者多,因此复发率也相对更高[34-35]。原发病的快速进展,包括新月体的数量、术前蛋白尿的严重程度与复发后的不良结果存在相关性[34,36]。术后随访时间长、术后免疫抑制方案对IgAN的复发也存在一定影响[35,37]。研究表明,激素的使用可降低复发风险,术后激素撤除时间与IgAN复发率相关[38]。其他免疫抑制药包括环孢素、吗替麦考酚酯、他克莫司等与复发性IgAN的关联尚未有明确定论[22]。Moroni等[27]的研究表明,未使用吗替麦考酚酯或使用3种以下免疫抑制药是IgAN复发的危险因素。而Di Vico等[38]的研究表明,吗替麦考酚酯、他克莫司和哺乳动物雷帕霉素靶蛋白抑制剂与疾病复发无关。一些生物标志物,包括血清Gd-IgA1、IgG自身抗体和IgA-sCD89复合物等可预测IgAN复发[7-8]。此外,既往移植物丢失、术后透析时间也是IgAN复发的危险因素[22,34]。
一项针对中国人的长期随访研究表明,亲属活体供肾移植是IgAN复发的独立危险因素,其移植物丢失率高于非亲属活体供肾移植[39]。亲属活体供肾移植的移植物长期存活率较低,可能与家族性遗传因素有关[20,35]。因此,术前需排除有潜在家族性IgAN风险的亲属活体捐献。多项研究也表明供肾肾小球系膜区IgA沉积也是术后复发的危险因素[22]。亦有研究得出相反的结论,Sofue等[40]研究发现,供肾IgA沉积与移植肾的存活率、肾功能、尿检异常及IgAN复发情况无相关性。
HLA作为与供受者均相关的因素,有研究报道受者IgAN复发与HLA特异性相关。目前研究发现HLA-B35、DR4、B8、DR3等在移植后复发IgAN人群中更常见[22]。亲属活体供肾移植受者IgAN复发情况与供受者HLA匹配程度相关,而在非亲属活体供者或尸体供者肾移植中未发现[41]。研究发现,与零错配供肾相比,1个或多个HLA错配的肾移植受者IgAN复发率较低,表明移植肾失功可能由排斥反应以外的因素导致[42]。
4 肾移植术后IgAN复发的治疗手段
考虑到肾移植受者的免疫抑制状态,其IgAN复发的临床过程可能与其他患者不同,个体间也存在较大差异,目前暂无特效的IgAN复发防治方案,需根据受者情况进行个体化治疗。
4.1 保守治疗
根据改善全球肾脏病预后组织指南建议,复发性IgAN的治疗原则与原发性IgAN相同,旨在控制血压、减少蛋白尿与抑制炎症状态。因此,主要治疗手段包括使用血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor blocker,ARB)等阻断肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS),降低全身血压和肾小球内压,减少蛋白质排泄和继发性肾小球损伤[43]。
IgAN患者的治疗标准如下:蛋白尿>0.5 g/d的患者使用ACEI或ARB;蛋白尿<1 g/d的患者严格控制血压<130/80 mmHg(10 mmHg=1.33 kPa);蛋白尿>1 g/d的患者控制血压<125/75 mmHg;持续性蛋白尿>1 g/d且估算肾小球滤过率(estimated glomerular filtration rate,eGFR)>50 mL/(min·1.73m2)的患者推荐使用激素[43]。一项双中心回顾性队列研究证实RAAS阻滞剂可通过减少蛋白尿,改善IgAN复发的预后[44]。但RAAS阻滞剂能否降低肾移植术后IgAN复发率以及能否让受者获益仍存在争议[45]。有研究表明,ACEI和ARB的使用对提高移植物的存活率无益处,接受ACEI治疗的受者中,57.6%发生了移植物丢失[38]。
4.2 免疫抑制治疗
除症状管理以外,如何有效预防IgAN的复发是也临床医师关心的重点,因此需着重考虑IgAN复发的免疫抑制治疗。对保守治疗难以控制病情的患者,可考虑免疫抑制治疗。
激素是目前唯一被证实可有效治疗IgAN的免疫抑制药,IgAN患者肾移植术后应维持低剂量激素使用,以降低复发风险。为避免激素治疗的不良反应,早期停用激素是活体供肾移植中的一种安全干预措施,但对于复发风险高的受者则应谨慎考虑。研究表明,停用激素可能会导致IgAN复发,增加移植物丢失风险,但不影响受者和移植物的总体存活率[38]。一项国际多中心、双盲、随机对照试验表明,激素的使用对尿蛋白>2 g/d的患者具有潜在益处,可降低肾功能恶化及ESRD的风险,但足量剂量治疗时,以感染为主的严重不良事件和死亡的风险较高,表明需要谨慎评估激素的不良反应后再进行干预[46]。因此,根据经验,原发病为IgAN的肾移植受者可使用低剂量激素(口服泼尼松0.6 mg/kg,隔日1次)[13]。而对于进展较快的复发性IgAN,尤其是尿蛋白>1 g/d且eGFR>50 mL/(min·1.73m2)的受者,大多数中心仍会选用大剂量激素治疗[泼尼松1 mg/(kg·d)],几个月后缓慢减至低剂量[22]。
当疾病快速进展且激素无法控制时,临床医师会建议受者接受基于激素的联合免疫抑制治疗。常用的免疫抑制药包括硫唑嘌呤、钙调磷酸酶抑制剂、环磷酰胺、吗替麦考酚酯、利妥昔单抗和来氟米特等,但有关其疗效的研究数据参差不齐,尚缺乏前瞻性研究证实[47]。钙调磷酸酶抑制剂可通过抑制T细胞的活化和增殖从而抑制白细胞介素(interleukin,IL)-2、IL-4、TNF-α的合成,但对于肾移植术后IgAN复发受者肾功能保护作用的数据相对有限,使用他克莫司受者的复发率明显低于使用环孢素受者[22]。吗替麦考酚酯可通过选择性地抑制淋巴细胞增殖、抗体合成等改善肾小球肾炎的炎症反应,其与激素的联合使用,可降低激素剂量,与全剂量激素使用相比,其缓解蛋白尿作用相当,且不良事件发生率更低[48]。也有病例报道,快速进展性且组织学表现出新月体的IgAN复发受者使用环磷酰胺或利妥昔单抗可能获益,但无法成功逆转疾病病程,仍需进一步研究[49]。
免疫诱导治疗是预防肾移植术后IgAN复发的重要手段,最常用的是抗胸腺细胞球蛋白(antithymocyte globulin,ATG)[50]。韩国的一项研究对1995年至2015年218例IgAN肾移植受者分别进行无免疫诱导、抗CD25抗体免疫诱导和ATG免疫诱导治疗,发现使用ATG进行免疫诱导治疗的受者在肾移植术后4、5年的复发率较低,说明ATG可延缓IgAN的复发,但由于数据缺失以及随访时间有限,仍需前瞻性研究来进一步证实[51]。
对肠道黏膜免疫系统的新药物制剂也逐步开展临床试验。近期一项双盲、随机对照试验表明,在原发性IgAN患者中,针对肠道黏膜免疫系统的布地奈德靶向释放制剂可以减少蛋白尿,有望成为肾移植术后IgA复发的新型特异性治疗方法[52]。
4.3 其他治疗
由于产生Gd-IgA1的免疫细胞存在于扁桃体等黏膜相关淋巴组织中,因此扁桃体可能是IgAN的重要治疗靶点,具有独立于激素治疗以外的益处[53]。一项日本的单中心回顾性队列研究提示肾移植1年后行扁桃体切除术可降低IgAN组织学复发率[54]。对肾移植术后IgAN复发受者行扁桃体切除术,不仅可以缓解临床症状,减轻蛋白尿程度,也可改善其造成的组织学损伤[55]。我国邓荣海等[56]研究表明,扁桃体切除术可帮助肾移植术后IgAN复发受者维持肾功能稳定,但病理表现较重者效果可能欠佳。
鉴于补体系统参与调节IgAN的发病机制,阻断补体介导的肾脏炎症反应可能对肾移植术后IgAN复发具有治疗作用,如抗C5抗体依库珠单抗可挽救快速进展性IgAN患者的肾功能,减少蛋白尿,降低血清肌酐水平[57]。此外,也有部分病例报道生长抑素类似物奥曲肽治疗可延缓肾移植术后IgAN复发的进展[58]。哺乳动物雷帕霉素靶蛋白抑制剂依维莫司和激素联合治疗也被证明能降低IgAN的复发风险[59]。而靶向BAFF、APRIL的拮抗剂以及脾酪氨酸激酶抑制剂的原生IgAN临床Ⅱ期试验逐步开展,有待评估新型治疗手段对IgAN的获益情况[50]。
5 小 结
早期识别肾移植术后IgAN复发的高风险受者不仅可以降低复发率,也有助于优化IgAN治疗流程。但由于IgAN的临床症状缺乏特异性,其诊断依赖于手术前后的程序化肾活检,而不具有明确症状的受者行肾活检意愿较低,不同研究的随访时间和诊断方式也不同,对于IgAN的复发率以及移植物丢失率可能有所低估。因此,需要规范化诊断流程,推进程序化肾活检,促进临床、检验、病理多学科合作,以便及早诊断IgAN复发。
目前对IgAN的危险因素及最佳治疗方案尚未有定论,有待于多中心合作展开大规模、随机、长期随访的队列研究进行评估。对该病发病机制的深入研究也有助于提高其诊断准确性,为治疗方案提供新思路。

