基底外侧杏仁核至伏隔核环路在大鼠丙泊酚依赖中的作用
黄炳武,陈依尔,崔燕华,连庆泉,苏 颖,林 函,
(1.温州医科大学附属第二医院育英儿童医院麻醉与围术期医学科,浙江温州 325027;2.浙江省麻醉学重点实验室,浙江温州 325035)
药物滥用和药物依赖是严重的公共安全和个人健康问题,给整个社会和个人造成了不可估量的损失。目前,药物滥用以大麻类、鸦片类和可卡因最为常见,而这些药物都属于麻醉药品范畴。丙泊酚(propofol)又名异丙酚,是一种起效快、苏醒迅速的静脉麻醉用药,自1986年问世以来,已广泛应用于临床麻醉的诱导和维持[1]。近年来,国外相继报道多起与丙泊酚相关的死亡事件,引起了广大社会群体和医务人员的关注和担忧,越来越多的证据表明,丙泊酚可能存在一定的成瘾性[2-3]。本课题组前期已成功建立大鼠丙泊酚自身给药行为模型,并验证了大脑伏隔核(nucleus accumbens,NAc)多巴胺受体1、细胞外信号调节激酶(extracellular signalregulated kinases,ERK)和糖皮质激素受体(gluco⁃corticoid receptor,GR)参与调控大鼠丙泊酚自身给药行为[4-6]。目前,关于谷氨酸(glutarnate,Glu)能受体在药物成瘾中发挥重要调控作用的研究报道日益增多,而最近本课题组也发现,ip给予Glu受体拮抗剂可减少大鼠丙泊酚自身给药行为[7],但在NAc区给药对大鼠丙泊酚觅药行为的影响,迄今尚无文献报道。
基底外侧杏仁核(basolateral amygdala,BLA)是中脑边缘系统的组成部位,以Glu能神经元为主,主要参与调控线索诱发的成瘾行为[8-9]。NAc是边缘奖赏系统的关键部分,可与边缘系统内其他脑区相互作用,参与调控多种成瘾药物的奖赏机制[10]。研究表明,BLA向NAc有Glu能神经投射,形成BLA-NAc环路并参与自然奖赏行为的调控[11]。最近,Puaud等[12]发现,抑制BLA-NAc环路可减少可卡因诱导的大鼠自身给药行为,提示BLA-NAc环路有可能参与药物成瘾的调控机制,但此环路对大鼠丙泊酚自身给药行为的影响及机制目前未见文献报道。本研究采用大鼠自身给药行为方法建立丙泊酚依赖模型,用Western印迹法检测丙泊酚依赖大鼠NAc内Glu能α-氨基-3-羟基-5-甲基-4-异唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxa⁃zole-propionic acid receptor,AMPAR)的 亚 基GluA1和GluA2蛋白表达水平,然后在NAc内注射NBQX(AMPAR拮抗剂),观察其对大鼠丙泊酚自身给药行为的影响,最后通过蓝光刺激和NAc区给药探索BLA-NAc环路对大鼠丙泊酚依赖行为的调控作用及其机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠60只,7~8周龄,体重240~290 g,购自北京维通利华生物科技有限公司,动物许可证编号:SCXK(浙)2019-0001。大鼠用独立代谢笼适应性饲养,保持环境温度22~24℃,相对湿度50%~70%,每日限制进食30 g鼠饲料,饮水自由,保证 12 h灯光照明(2∶00~14∶00开灯,14∶00~次日2∶00关灯)。本实验过程符合温州医科大学动物中心动物伦理管理条例规定。
1.2 药品、试剂和仪器
丙泊酚,德国Fresenius Kabi公司;NBQX,美国Sigma-Aldrich公司;蔗糖,德国BioFroxx公司;多聚甲醛,上海凌峰化学试剂有限公司;兔抗鼠GluA1和GluA2单克隆抗体,美国Cell Signaling Technology公司;兔抗鼠GAPDH单克隆抗体和HRP标记山羊抗兔IgG抗体,碧云天生物技术研究所;生理盐水,河北天成药业股份有限公司。
脑立体定位仪(68025)、微注射系统(KDS310)、导管、导管帽和注射内管,深圳瑞沃德生命科技有限公司;微量注射器,德国Hamilton公司;4℃孵育摇床(DLHR-Q200)和冰冻切片机(HI1210),美国Thermo公司;蛋白电泳仪,美国Bio-rad公司;凝胶成像系统,美国GE公司;荧光正置显微镜(DM5500B),德国Leica公司;智能激光光源(Aurora-220-473),杭州纽顿科技有限公司;光纤和跳线,杭州荧博科技有限公司。AES-SYS16大鼠自身给药行为训练笼,宁波安来科学仪器有限公司。整个行为实验装置由大鼠操作行为箱和计算机控制系统组成。大鼠操作行为箱中配有左、右各1套鼻触键和鼻触灯及1个笼灯,若大鼠鼻触反应正确,则笼灯灭,鼻触灯亮,此时大鼠可通过置入体内的静脉导管获得1次丙泊酚(1.7 mg·kg-1)的泵入。实验过程由计算机自动控制完成。
1.3 重组腺相关病毒构建
腺相关病毒载体(adeno-associated virus,AAV)-钙调蛋白依赖性蛋白激酶Ⅱα(calmodulindependent protein kinaseⅡα,CaMKⅡα)-黄绿色荧光蛋白(enhanced yellow fluorescent protein,eYFP)和AAV-CaMKⅡα-光敏感通道蛋白(chan⁃nelrhodopsin-2,ChR2)-eYFP(每管20 μL,滴度为5.3E+12 μg·mL-1),武汉枢密脑科学技术有限公司。AAV-CaMKⅡα-eYFP含有CaMKⅡα基因启动子序列,可精确感染Glu能神经元,但不含ChR2基因,光照后不能激活Glu能神经元。AAV-CaMKⅡα-ChR2-eYFP含有CaMKⅡα基因启动子序列和ChR2基因,可以精确感染Glu能神经元并使其被相应的蓝光激活,从而使Na+和Ca2+通过激活的ChR2通道内流,导致神经元去极化。
1.4 大鼠丙泊酚依赖模型的建立
1.4.1 自身给药训练和分组
大鼠经5%水合氯醛麻醉后,将PE-硅胶管置入右侧颈外静脉,并将导管出口从背后穿出,固定。取12只颈外静脉置管后的大鼠进行丙泊酚自身给药行为训练。每天14∶00至次日2∶00为行为学实验时间,连续14 d,每天每只训练3 h。训练时,将大鼠放入训练笼,将PE-硅胶导管出口与输液泵连接,运行固定比率1(fixed ratio 1,FR1)程序,即当大鼠鼻触1次左侧鼻触键(有效开关),会得到1次丙泊酚(1.7 mg·kg-1)泵入,并伴随笼灯熄灭、左侧鼻触灯亮以及持续5 s的声音刺激线索。2个训练周期间间隔30 s的不应期,若大鼠在不应期内再次鼻触有效开关不能获取丙泊酚泵入及相关线索发生,但系统会记录1次鼻触次数;而当大鼠鼻触1次右侧鼻触键(无效开关)不会得到丙泊酚泵入及相关线索的发生[4]。训练结束后,程序停止并记录有效和无效鼻触次数。根据训练第12~14天有效鼻触次数将大鼠分为丙泊酸依赖大鼠(有效鼻触次数均>40次,且波动≤10%)和丙泊酚非依赖大鼠(有效鼻触次数均<20次)。
1.4.2 Western印迹法检测NAc区GluA1和GluA2蛋白表达水平
在第15天训练结束后,立即将大鼠处死,取脑并分离NAc区,加入裂解液和蛋白酶抑制剂,捣碎、碾磨、静置后超声匀浆,4℃,12 000×g离心30 min,收取上清液。用BCA试剂盒测定匀浆液蛋白浓度。在匀浆液中加入上样缓冲液,100℃煮沸10 min变性。每条泳道蛋白上样量30 μg,经电泳、转膜后用5%脱脂牛奶封闭2 h,加入抗GluA1,GluA2和GAPDH一抗(稀释比例均为1∶1000),4℃摇床孵育16~20 h。TBST洗膜,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1∶2000),室温孵育2 h,TBST充分洗膜,曝光后显示条带。ImageJ 1.51软件分析蛋白条带的积分吸光度(integrated absor⁃bance,IA),以目标蛋白与内参蛋白IA值的比值表示目标蛋白相对表达水平。
1.5 NAc区注射NBQX对丙泊酚依赖大鼠觅药行为的影响
1.5.1 NAc区套管置入手术
正常大鼠ip给予5%水合氯醛(7 mL·kg-1)麻醉后固定在脑立体定位仪上,切开颅顶皮肤暴露前、后囟,调整至同一平面。根据前囟的位置,在NAc区(A/P:+1.8 mm;M/L:-1.5 mm;D/V:-8 mm)钻孔,将套管经孔缓慢下降至目标脑区,用凝胶海绵填塞套管与孔间的缝隙。在钻孔位置旁开5 mm处钻2个浅孔,各拧入1枚螺丝钉,用牙托粉将套管和螺丝钉包裹并固定。
1.5.2 大鼠分组、给药和丙泊酚觅药行为检测
大鼠NAc区埋置套管(同1.5.1)和静脉埋置给药管(同1.4.1),手术后恢复7 d,而后进行丙泊酚自身给药训练,训练方法同1.4.1,训练结束后次日(第15天)进行测试。测试开始前30 min,将24只丙泊酚依赖模型大鼠随机分为4组(n=6):对照组及NBQX 0.25,0.5和1 μg组,在套管内置入给药管,通过微量注射泵在NAc区分别泵入生理盐水或NBQX(泵入体积为 0.3 μL,流速为 0.2 μL·min-1),在FR1程序下观察NBQX对大鼠丙泊酚觅药行为的影响。实验流程见图1。

Fig.1 Flow chart of propofol self-administration training coupled with NAc administration in rats.The test was performed the day after 14 days of continuous propofol self-administration training.The propofol addicted rats were randomly divided into control group and NBQX〔α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptors(AMPAR)antagonist,0.25,0.5 and 1 μg〕group(n=6),and were given saline or NBQX via guide cannulae to the nucleus accumbens(NAc)(injection volume:0.3 μL;flow rate:0.2 μL·min-1)30 min before testing.The effect of NBQX on the number of active nasal contacts in propofol addicted rats was observed under the fixed ratio 1(FR1)procedure.
1.6 蓝光激活BLA-NAc环路对大鼠丙泊酚觅药行为的影响
1.6.1 重组腺相关病毒注射
正常大鼠麻醉后固定在脑立体定位仪上,在BLA区(A/P:-2.5mm;M/L:-4.9mm;D/V:-8.5mm)钻孔,然后将微量进样针缓慢插入至目标脑区,使用微量注射泵以0.1 μL·min-1的速度缓慢注入0.5 μL病毒,注射完毕后停针10 min,缓慢退出微量进样针,并缝合皮肤和消毒。
1.6.2 大鼠分组、光刺激和丙泊酚觅药行为检测
将正常大鼠随机分为2组,分别在BLA区注射AAV-CaMKⅡα-eYFP和AAV-CaMKⅡα-ChR2-eYFP(同1.6.1),注射3周后,手术植入套管(同1.5.1)和静脉给药管(同1.4.1)。恢复1周后进行丙泊酚自身给药训练,训练方法同1.4.1。选取丙泊酚依赖大鼠分为eYFP组、eYFP+NBQX组、ChR2-eYFP组和 ChR2-eYFP+NBQX组(n=6),在第15天进行测试。测试开始前30 min,eYFP组和ChR2-eYFP组在NAc区给予生理盐水,eYFP+NBQX组和ChR2-eYFP+NBQX组给予NBQX 0.5 μg(同1.5.2)。测试时将套管内置入光纤并与470 nm激光发生器和训练笼相连接。根据ChR2通道蛋白的光电特性[13],采用持续时间4 s、频率10 Hz、脉冲宽度20 ms、输出功率40 mW的激光方波(蓝光),并控制输出至光纤尖端的功率稳定在4~10 mW。在FR1程序下(即当大鼠鼻触1次有效开关,可获得1次药物泵入,同时伴随相关线索的发生和一串蓝光刺激)观察蓝光刺激对大鼠丙泊酚觅药行为的影响。实验流程见图2。
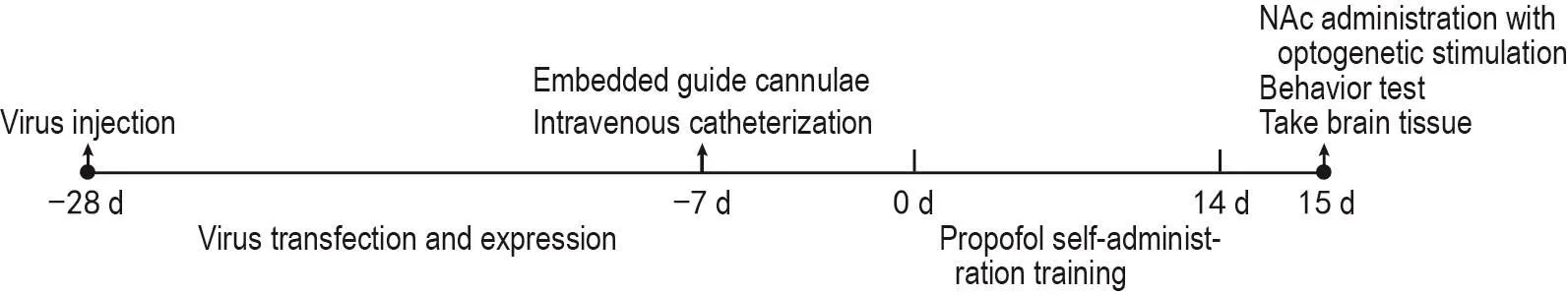
Fig.2 Flow chart of propofol self-administration training coupled with optogenetics test in rats.Four weeks before propofol self-administration training,the virus was injected into the basolateral amygdala(BLA).One week before propofol self-admin⁃istration training,the venous catheter was placed and the guide cannulae was embedded into the NAc.The optogenetics test was performed the day after 14 days of continuous propofol self-administration training.The propofol addicted rats were randomly divided into enhanced yellow fluorescentprotein(eYFP)group,eYFP+NBQX group,channelrhodopsin-2(ChR2)-eYFP group and ChR2-eYFP+NBQX group(n=6),and were given saline or NBQX 0.5 μg via guide cannulae to the NAc(injection volume:0.3 μL;flow rate:0.2 μL·min-1)30 min before testing.During the test,optogenetic stimulation was delivered via guide cannulae to BLA-NAc circuit of propofol addicted rats and the number of active nasal contacts was observed under the FR1 procedure.
1.6.3 免疫荧光法检测大鼠BLA和NAc区病毒表达
行为学测试结束后,将大鼠麻醉后心脏灌流,取脑固定、脱水、包埋。然后冰冻切片机切片,厚度200 μm,固定漂洗后滴加抗荧光淬灭剂封片。在荧光正置显微镜下拍片,观察大鼠脑BLA和NAc区荧光表达并拍照。
1.7 统计学分析
采用SPSS 21.0统计软件进行数据分析。所有结果数据符合正态分布,用±s表示。丙泊酚依赖与丙泊酚非依赖大鼠行为学结果采用重复测量方差分析和Tukey t检验,Western印迹结果采用独立样本t检验;蓝光刺激和NAc区注射给药后各组大鼠行为学结果采用单因素方差分析和Tukey t检验。P<0.05为差异有统计学意义。
2 结果
2.1 丙泊酚依赖大鼠觅药行为及NAc区GluA1和GluA2蛋白表达
行为学实验结果(图3A)显示,与丙泊酚非依赖大鼠相比,丙泊酚依赖大鼠有效鼻触次数明显增加(P<0.05),即觅药行为增加。Western印迹检测结果(图3B-3D)显示,与非依赖大鼠相比,丙泊酚依赖大鼠NAc内GluA1和GluA2蛋白表达水平升高(P<0.05)。
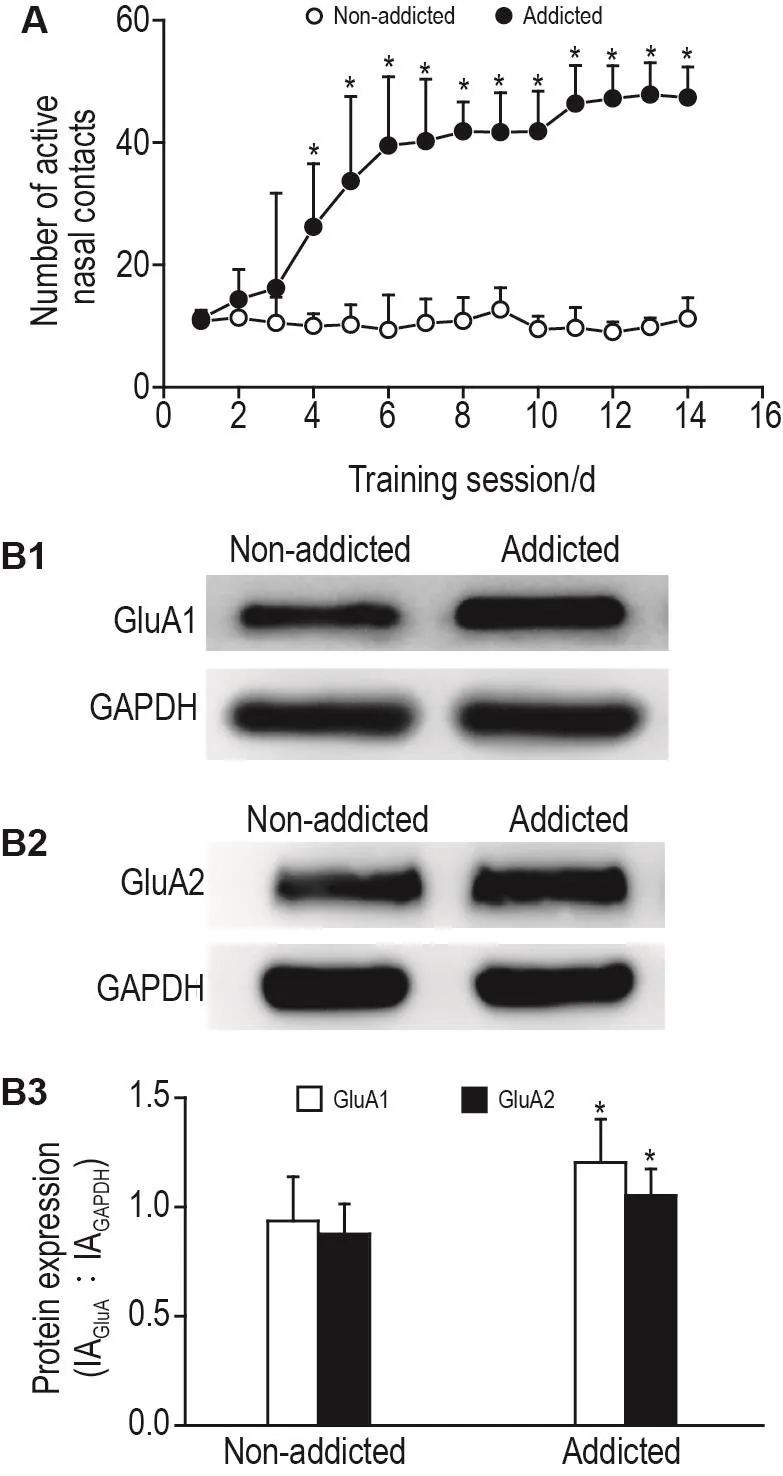
Fig.3 Propofol self-administration behavior(A)and expressions of GluA1 and GluA2(B)in NAc of propofol addicted rats.Rats were trained under a FR1 schedule to discrimi⁃nate propofol addicted from non-addicted.After 14-day training,rats whose number of active nasal contacts was 40 or larger in the last three days of the training and whose fluctuation was 10%or less were considered propofol addicted,while rats whose number of active nasal contacts was 20 or less were considered non-addicted.B3 was the semi-quantitative result of B1 and B2 by Western blotting.IA:integrated absorbance.±s,n=6.*P<0.05,compared with non-addicted rats.
2.2 NAc区注射NBQX对丙泊酚依赖大鼠觅药行为的影响
与对照组相比,NBQX 0.5和1 μg组大鼠有效鼻触次数显著减少(P<0.01)(图4)。提示阻断NAc区AMPAR可以抑制大鼠丙泊酚觅药行为。
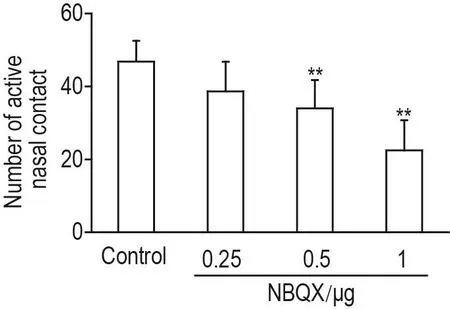
Fig.4 Effect of NBQX on propofol seeking behavior in propofol addicted rats.See Fig.1 for the rat treatment.±s,n=6.**P<0.01,compared with control group.
2.3 蓝光刺激BLA-NAc环路对丙泊酚依赖大鼠觅药行为的影响
与eYFP组相比,ChR2-eYFP组大鼠有效鼻触次数增加(P<0.01),而eYFP+NBQX组大鼠有效鼻触次数减少(P<0.01)。与eYFP+NBQX组相比,ChR2-eYFP+NBQX组大鼠有效鼻触次数增加(P<0.01)。与ChR2-eYFP组相比,ChR2-eYFP+NBQX组大鼠有效鼻触次数减少(P<0.01)。与eYFP组相比,ChR2-eYFP+NBQX组大鼠有效鼻触次数无明显变化(图5)。
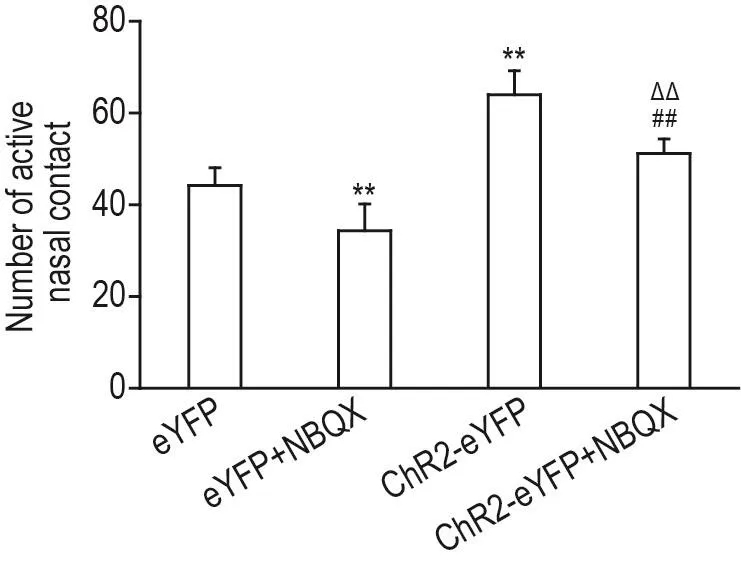
Fig.5 Effect of blue optogenetic stimulation to BLANAc circuit on propofol seeking behavior in propofol addicted rats.See Fig.2 for the rat treatment.±s,n=6.**P<0.01,compared with eYFP group;##P<0.01,compared with eYFP+NBQX group;△△P<0.01,compared with ChR2-eYFP group.
2.4 BLA和NAc区病毒表达鉴定
免疫荧光检测结果(图6)表明,BLA区病毒正确表达(图6A),且可以成功转染到NAc区(图6B)。
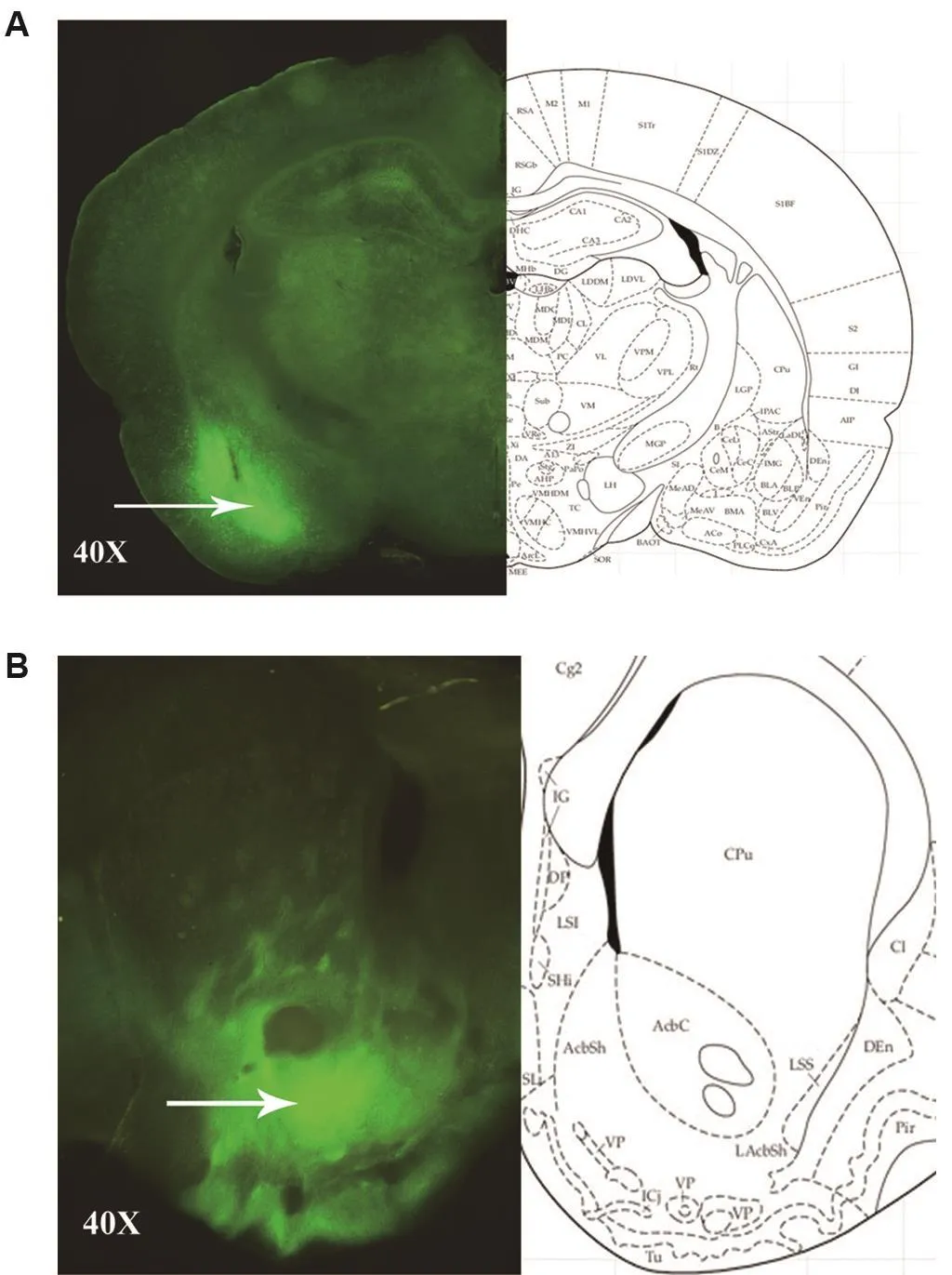
Fig.6 eYFP expressions in BLA(A)and NAc(B)of rats after virus injection by immunofluorescence assay.See Fig.2 for the rat treatment.The arrows show the regions of virus expression.
3 讨论
本研究发现,丙泊酚依赖大鼠NAc区GluA1和GluA2蛋白表达水平增高,拮抗NAc内AMPAR可显著减少大鼠丙泊酚觅药行为,而兴奋BLA-NAc环路可增加大鼠丙泊酚自身给药行为,并改善NAc内注射AMPAR拮抗剂对大鼠觅药行为的抑制作用。
中脑边缘奖赏系统在药物成瘾中起重要作用,已知的脑区主要有中脑腹侧被盖区、NAc、杏仁核、背侧纹状体、黑质、海马、前额叶皮质、岛叶皮质、下丘脑、丘脑底核和腹侧苍白球等,但这些脑区在药物成瘾中的调控机制尚未完全阐明[14]。BLA是NAc上游脑区,主要以Glu能神经元为主,BLA Glu能神经元的异常兴奋可能是诱发和维持药物成瘾的重要原因,而BLA Glu能神经元失活可抑制对成瘾药物的依赖[15-16]。BLA和NAc均可参与调控线索诱发的动机行为,二者不仅有解剖关系还存在功能上的联系。在线索诱发的奖赏行为中,BLA神经元对线索的应答反应会先于NAc神经元,并参与对NAc神经元兴奋性的调控。电刺激BLA区可促进大鼠NAc区Glu能介导的多巴胺释放,引起NAc神经元细胞兴奋,进而诱发药物的奖赏效应[17-18]。自身给药行为模型是目前药物成瘾研究中公认和普遍采用的实验方法[19],本课题组前期研究发现,BLA和NAc均可参与调控线索诱导的大鼠丙泊酚自身给药行为[9],推测BLA-NAc环路可能参与调控大鼠丙泊酚的自身给药行为。免疫荧光结果表明,在BLA区注射携带ChR2的病毒可显示黄绿色荧光,并能成功转染至NAc区。光遗传学技术可以实现瞬间激活或失活神经元上特异性表达的ChR2,即给光时通道蛋白打开,不给光时通道蛋白关闭[20]。本研究中,病毒注射6周后再给予蓝光刺激,以便有足够的时间进行病毒转染和通道蛋白表达。在第15天大鼠自身给药行为测试期间,通过光纤在丙泊酚依赖大鼠NAc区给予蓝光刺激,可使BLA区和NAc区携带ChR2的神经元兴奋,从而实现兴奋BLA-NAc环路的作用。本研究结果表明,兴奋BLA-NAc环路可显著增加大鼠丙泊酚觅药行为。这与文献[11]报道的兴奋BLA-NAc环路可促进小鼠天然奖赏行为的结论相一致。
近年来研究发现,AMPAR在线索诱导的药物成瘾行为中起重要作用[21-22]。AMPAR是离子型谷氨酸受体的一种,其中GluA1和GluA2蛋白是构成AMPAR的重要亚基,并在药物成瘾的调控机制中起关键作用[23]。研究表明,吗啡依赖的大鼠表现为NAc内GluA1蛋白表达水平增高[24]。另外,ip给予糖原合成酶激酶3拮抗剂可促进小鼠酒精自身给药行为,并伴随NAc内GluA2蛋白表达水平增高[25]。本研究发现,丙泊酚依赖大鼠GluA1和GluA2蛋白表达水平显著增高,表明NAc内GluA1和GluA2蛋白可能参与大鼠丙泊酚依赖的调控机制,而具体的调控机制还需要进一步研究。有研究报道,可卡因依赖大鼠NAc区GluA1和GluA2蛋白表达减少[26],这与本研究中丙泊酚依赖大鼠GluA1和GluA2蛋白表达增高的实验结果似乎是矛盾的。另有研究表明,神经元GluA1蛋白增加或GluA2蛋白减少均可诱导NAc内神经元钙渗透性AMPAR表达水平的增高,而钙渗透性AMPAR具有高电导钙渗透性,可诱发长时程增强形成,进而促进药物的滥用和依赖[21]。因此推测,丙泊酚可能主要通过增加NAc区GluA1蛋白表达诱导钙渗透性AMPAR表达水平增高,从而促进大鼠觅药行为;而可卡因可能主要通过减少NAc区GluA2蛋白表达诱导钙渗透性AMPAR表达水平增高,从而促进药物依赖,这可能是产生上述矛盾的原因之一。NAc在长期高频刺激下可引发神经元Ca2+内流增加,激活CaMKⅡ相关通路促进神经元细胞AMPAR表达增加,进而诱发神经元之间长时程增强形成,促使药物滥用和依赖[27-28]。研究表明,在NAc注射AMPAR拮抗剂可减少大鼠线索诱导的可卡因自身给药行为[29],这与本研究发现的NBQX在NAc内给药可显著减少线索诱导的大鼠丙泊酚觅药行为相一致,提示NAc区AMPAR参与丙泊酚精神依赖性的调控机制。此外,NAc区可接收整合来自皮质边缘系统输入的信息。研究报道,这些输入的信息可通过调控NAc内AMPAR水平介导大鼠可卡因觅药行为[28]。本研究结果表明,兴奋BLA-NAc环路可以加剧丙泊酚依赖大鼠的丙泊酚觅药行为,并改善NAc区给予NBQX对丙泊酚依赖大鼠觅药行为的抑制作用,而在ChR2缺失的情况下,仅有eYFP表达不会影响NBQX对大鼠丙泊酚觅药行为的抑制作用。提示BLA-NAc环路在大鼠丙泊酚依赖中起着重要作用,该作用可能由NAc区AMPAR介导。
综上所述,大鼠丙泊酚依赖可能与NAc区GluA1蛋白表达增高有关,并且兴奋BLA-NAc环路可增加大鼠丙泊酚的自身给药行为,其机制可能与NAc区AMPAR的水平有关。本研究主要聚焦在大鼠丙泊酚成瘾的诱发和维持阶段,而丙泊酚复吸行为的机制尚待进一步研究。

