杨梅素通过抑制能量代谢促进5-氟尿嘧啶对人食管癌细胞EC109的抗肿瘤作用
苏 楠,范霞霞,谢娇娇,李亚飞,马永成
(1.河南牧业经济学院食品与生物工程学院,河南 郑州 450011;2.郑州大学华中阜外医院药学部临床药理实验室,河南 郑州 451464)
消化道肿瘤发生率及死亡率较高,严重威胁人类健康,目前治疗上仍然以手术及化疗为主[1]。5-氟尿嘧啶(5-fluorouracil,5-FU)是消化道肿瘤最主要的化疗药物之一,其主要通过抑制胸腺嘧啶合成酶活性,干扰DNA的合成和修复,抑制细胞生长和增殖。然而,5-FU耐药发生率较高,单药有效率不足20%,所以寻找合适的手段增加其化疗敏感性与预防其化疗耐药具有重要意义[2]。杨梅素(myricetin,MYR)又称杨梅树皮素、杨梅黄酮,是一种多羟基黄酮类物质,最早由杨梅树皮和树叶中提取得到,其具有抗微生物、抗神经退化、抗高血压、抗过敏、抗炎、镇痛、降血糖和保肝等多种药理活性。近年来研究发现,MYR也具有较好的抗肿瘤作用,其可通过阻滞细胞周期、诱导线粒体介导的细胞凋亡、抑制肿瘤血管生成等机制,抑制肝癌、胃癌、结肠癌和乳腺癌等多种癌细胞增殖[3]。此外,MYR也可通过下调多药耐药基因1的表达增强紫杉醇抗卵巢癌细胞的作用[4],但MYR是否可增强5-FU的抗肿瘤作用尚需进一步研究。
有氧糖酵解(Warburg效应)被认为是肿瘤代谢的特征,为肿瘤药物研发提供了较多的靶点,为肿瘤治疗带来了新希望。然而,现代肿瘤研究表明,糖酵解并不是肿瘤细胞获取能量的唯一方式,一些肿瘤细胞可根据外在环境,在糖酵解和氧化磷酸化2种代谢模式中灵活切换,从而维持能量供应,保证自身的生长优势。因此,双重抑制糖酵解及氧化磷酸化已成为抗肿瘤药物研发的新策略[5]。本文旨在研究MYR对5-FU的增敏作用,并围绕肿瘤代谢探索其潜在机制,为MYR应用于肿瘤防治提供理论和实验依据。
1 材料与方法
1.1 药物、试剂和主要仪器
MYR,纯度≥98%,北京索莱宝科技有限公司,溶解于二甲亚砜(DMSO),-20℃分装保存;5-FU(0.25 g/10 mL注射液),上海旭东海普药业有限公司;糖酵解及线粒体压力检测试剂盒,美国Seahorse Bioscience公司;荧光染料JC-1,江苏碧云天生物技术研究所;FITC-AnnexinⅤ/PI凋亡检测试剂盒,江苏凯基生物技术有限公司;荧光标记葡萄糖类似物2-NBDG,美国Invitrogen公司;MTT,美国Sigma公司。荧光显微镜,日本Nikon公司;酶标仪,美国Perkinelmer公司;流式细胞仪,美国BD公司;细胞能量分析仪(Seahorse XFp),美国Sea⁃horse Bioscience公司。
1.2 细胞和细胞培养
人食管癌细胞EC109,中国科学院典型培养物保藏委员会细胞库,由本实验室传代培养,液氮保存。使用含有10%胎牛血清、100 g·L-1链霉素和1×108U·L-1青霉素的RPMI 1640培养液,将EC109细胞于37℃,5%CO2条件下培养。
1.3 MTT法检测细胞存活抑制率
①将EC109细胞以密度6×107L-1接种于96孔培养板中,每孔100 μL,培养至贴壁,加入MYR 4.68,9.38,18.75,37.50,75.00,150.00和300.00 μmol·L-1分别作用24,48和72 h后,加入20 μL MTT溶液(终浓度为0.5 g·L-1),培养箱内孵育4 h,移除培养基,每孔加入200 μL DMSO,室温振荡15 min,使得结晶物充分溶解。使用酶标仪于490 nm处测定各孔吸光度(A490nm),利用GraphPad 6.0计算细胞存活抑制率,确定后续联合用药时MYR浓度。细胞存活抑制率(%)=(细胞对照组A490nm-药物组A490nm)/细胞对照组A490nm×100%。②细胞培养同①,加入5-FU 0.8,1.5,3.0,6.0,12.0,24.0和48.0 μmol·L-1、5-FU(0.8~48.0 μmol·L-1)+MYR 75 μmol·L-1,分别作用24,48和72 h,其余同处理①。确定药物联用时间。
1.4 流式细胞仪检测细胞凋亡率
根据MTT法实验结果,细胞分为细胞对照、MYR 75 μmol· L-1、5-FU 12 μmol· L-1及 MYR+5-FU组,药物作用48 h后,按照FITC-AnnexinⅤ/PI试剂盒说明书对细胞进行荧光染色处理,利用流式细胞仪分析细胞凋亡。
1.5 JC-1荧光探针法检测细胞线粒体膜电位
将EC109细胞以密度3×107L-1接种于6孔板,每孔3 mL,培养至贴壁,细胞分组同1.4。弃原培养基,每孔加入1 mL JC-1染色工作液(0.01 g·L-1),置培养箱中孵育30 min后,使用无血清培养基冲洗3遍,利用荧光显微镜观察并采集图像,同时通过流式细胞术定量分析线粒体膜电位(mitochondrial membrane potential,MMP)变化。在 MMP 较高时,JC-1可形成聚合物,在488 nm激光激发下可呈现红色荧光;而在MMP较低时,JC-1以单体形式存在,在488 nm激光激发下则呈现绿色荧光。通过荧光显微镜观察各组荧光颜色的转变来分析MMP的变化;流式细胞术分析MMP时,低MMP的细胞则聚集在流式细胞图的右下方,以低MMP细胞所占整体细胞的百分比表示。
1.6 流式细胞术检测细胞葡萄糖摄取率
将EC109细胞以密度3×107L-1接种于6孔板,每孔3 mL,使用含10%FBS的常规培养基培养,待细胞贴壁后,移除常规培养基,PBS漂洗2次。细胞分组同1.4,加入MYR 75 μmol·L-1、5-FU 12 μmol·L-1或MYR 75 μmol·L-1+5-FU 12 μmol·L-1(均使用含0.5%FBS的RPMI 1640培养基配制)作用EC109细胞6 h(保证细胞存活率>80%),小心移除上述培养基,加入适当体积荧光标记的2-脱氧葡萄糖类似物2-NBDG(使用含0.5%FBS的培养基稀释,终浓度 100 μmol·L-1),孵育 30 min。胰酶消化,离心收集细胞,使用预冷的PBS洗涤细胞2次,去除未被细胞摄取的2-NBDG,使用适量预冷PBS悬浮细胞,并置于冰上待测,用流式细胞仪检测细胞葡萄糖摄取率。2-NBDG在488 nm激光下可发射绿色荧光,当它被细胞快速摄入胞内,通过流式细胞仪检测各组细胞的荧光值,以用药组与细胞对照组荧光值的比值表示葡萄糖摄取率。
1.7 细胞能量分析仪检测细胞氧消耗速率(oxygen consumption rate,OCR)和胞外酸化率(extra⁃cellular acidification rate,ECAR)
将EC109细胞以密度6.5×107L-1接种于线粒体压力/糖酵解检测专用培养板,每孔100 μL,细胞分组为细胞对照组、MYR 75,100 和 200 μmol·L-1组、5-FU 12 μmol·L-1组及 MYR 75 μmol·L-1+5-FU 12 μmol·L-1组。待培养细胞至贴壁后,按照细胞能量分析仪专用试剂说明书去除原培养基,更换为细胞能量分析专用培养液,利用细胞能量分析仪每隔5 min实时检测OCR和ECAR值,检测总时长为150 min。以加药前数值的平均值为基准均值,用加药后各时间点数值与基准均值的比值表示ECAR和OCR。
1.8 统计学分析
2 结果
2.1 MYR和5-FU单用及两药联用对EC109细胞存活的影响
2.1.1 MYR和5-FU单用
如图1A所示,与细胞对照组相比,MYR在75~300 μmol·L-1浓度范围内 EC109 细胞存活抑制率显著升高(P<0.01)。MYR作用细胞48和72 h时浓度≥75 μmol·L-1可显著升高细胞存活抑制率,后续实验选择MYR 浓度为75 μmol·L-1。图1B结果显示,与细胞对照组相比,5-FU在3~48 μmol·L-1浓度范围内作用于细胞48和72 h,亦可显著升高EC109细胞存活抑制率(P<0.05,P<0.01)。
2.1.2 MYR与5-FU联用
图1B结果显示,MYR 75 μmol·L-1可显著增强5-FU对EC109细胞存活的抑制作用(P<0.05,P<0.01)。其中,5-FU12μmol·L-1以及5-FU12μmol·L-1+MYR 75 μmol·L-1作用 48 h,细胞存活抑制率分别为(36±4)%和(55±3)%,二组差异显著(P<0.01)。但在作用 24 h,MYR 75 μmol·L-1对 5-FU 3~48 μmol·L-1的抗肿瘤作用无促进作用,故后续实验采用48 h为药物作用时间。

Fig.1 Effect of myricetin(MYR)and 5-fluorouracil(5-FU)alone or their combination on inhibition of EC109 cells by MTT assay.Cells were treated with MYR 4.68-300.00 μmol·L-1(A)for 24,48 and 72 h,respectively.B:cells were treated with 5-FU 0.8-48.0 μmol· L-1or 5-FU (0.8-48.0 μmol· L-1)+MYR 75 μmol·L-1for 24,48 and 72 h,respectively.±s,n=3.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with 5-FU group at the response concentration and time point.
2.2 MYR与5-FU联用对EC109细胞凋亡率的影响
与细胞对照组相比,MYR 75 μmol·L-1组和 5-FU 12 μmol·L-1组细胞凋亡率显著升高(P<0.05);与单独用药组相比,联用组细胞凋亡率显著升高(P<0.01)(图2)。
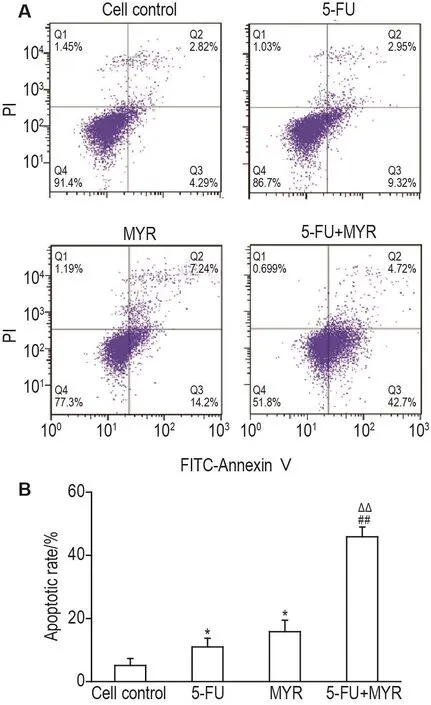
Fig.2 Effect of MYR and 5-FU alone or their combina⁃tion on apoptosis of EC109 cells by flow cytometry.The cells were treated with MYR 75 μmol·L-1,5-FU 12 μmol·L-1 or 5-FU 12 μmol·L-1+MYR 75 μmol·L-1for 48 h.B was the quanti⁃tative result of A.±s,n=3.*P<0.05,compared with cell control group;##P<0.01,compared with 5-FU group;△△P<0.01,compared with MYR group.
2.3 MYR与5-FU联用对EC109细胞线粒体膜电位的影响
荧光显微镜定性分析表明,细胞对照组细胞显示出较强的橙红色荧光,5-FU 12 μmol·L-1及 MYR 75 μmol·L-1作用细胞 48 h 后,橙红色荧光相对减弱,提示MMP有所下降;在相同处理条件下,联用组相较 5-FU 12 μmol·L-1或 MYR 75 μmol·L-1单用组橙红色荧光微弱,绿色荧光强烈,表明MMP降低(图3A)。流式细胞术定量分析发现,在相同处理条件下,MYR 75 μmol·L-1单用组、5-FU 12 μmol·L-1单用组及联用组均可降低MMP(图3B),低MMP细胞比例分别为(24.0±6.2)%、(9.2±3.1)%和(54.6±2.8)%,与细胞对照组(4.8±2.2)%相比,MMP下降显著(P<0.05),联用组与 MYR 75 μmol·L-1或5-FU 12 μmol·L-1单用组之间差异亦显著(P<0.01,图3C)。表明MYR可使MMP下降,同时可加剧5-FU降低MMP的作用,推测MYR抑制线粒体氧化磷酸化可能与其诱导MMP降低有关。
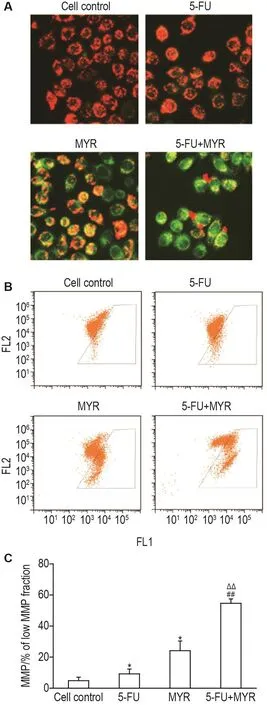
Fig.3 Effect of MYR and 5-FU in combination on mito⁃chondrial membrane potential(MMP)of EC109 cells detected by fluorescence microscopy(A,×200)and flow cytometry(B).See Fig.2 for the cell treatment.C was the quantitative result of B.FL1:JC-1 green fluorescence;FL2:JC-1 red fluorescence.±s,n=3.*P<0.05,compared with cell control group;##P<0.01,compared with 5-FU group;△△P<0.01,compared with MYR group.
2.4 MYR与5-FU联用对EC109细胞葡萄糖摄取的影响
如图4A所示,MYR 75 μmol·L-1组荧光曲线相较细胞对照组明显左移,表明 MYR 75 μmol·L-1可抑制EC109葡萄糖摄取,而5-FU 12 μmol·L-1组效果不明显,二药联用后这种效果显著增强。与细胞对照组相比,MYR 75 μmol·L-1组、5-FU 12 μmol·L-1组和二药联用组EC109细胞的葡萄糖摄取能力分别下降(24±5)%,(4±4)%和(39±5)%,MYR 75 μmol·L-1组和二药联用组显著降低(P<0.01),同时联用组显著低于MYR 75 μmol·L-1组(图4B,P<0.01)。提示MYR可限制肿瘤细胞葡萄糖摄取,与5-FU联用抑制作用进一步增强;MYR糖酵解抑制作用可能与其阻止葡萄糖摄取有关。
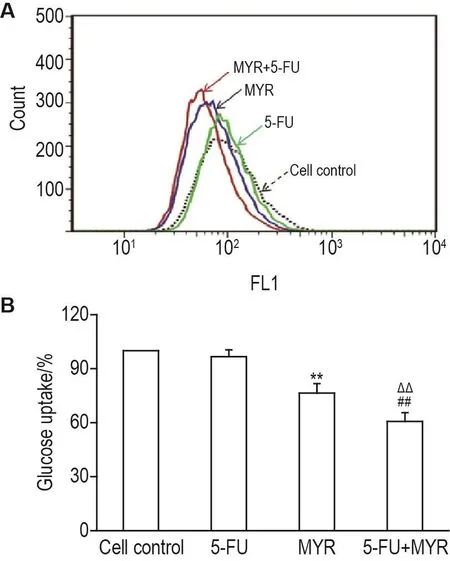
Fig.4 Effect of MYR and 5-Fu in combination on glucose uptake in EC109 cells by flow cytometry.See Fig.2 for the cell treatment.Glucose uptake(%)=Mean fluorescence intensity(MFI)of drug-treated group/MFI of cell control group×100%.B was the quantitative result of A.FL1:2-NBDG green fluorescence.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with 5-FU group;△△P<0.01,compared with MYR group.
2.5 MYR单用及与5-FU联用对EC109细胞OCR和ECAR的影响
如图5A所示,MYR 75,100和200 μmol·L-1组OCR和ECAR均表现为降低趋势。图5B结果显示,5-FU 12 μmol·L-1组 OCR 明显降低(图5B1),但ECAR明显增加(图5B2);与相应时间点的 5-FU 12 μmol·L-1组相比,MYR 75 μmol·L-1+5-FU 12 μmol·L-1组OCR和ECAR均显著降低(P<0.05),表明5-FU可抑制肿瘤细胞的氧化磷酸化,但促进了肿瘤细胞的糖酵解,MYR则可双重抑制糖酵解及线粒体氧化磷酸化,从而增强了5-FU的抗肿瘤作用。

Fig.5 Effect of MYR alone(A)or combined with 5-FU(B)on extracellular acidification rate(ECAR)and oxygen consumption rate(OCR)in EC109 cells.The average value before dosing was taken as the mean baseline value,and the ratio of values at each time point after dosing to the baseline mean value was used to represent the change of ECAR and OCR.Changes in OCR and ECAR were monitored every five min for 150 min by a Seahorse XFp extracellular flux analyzer in real time.±s,n=3.*P<0.05,compared with corresponding 5-FU 12 μmol·L-1group.
3 讨论
本研究结果显示,MYR对食管癌细胞具有明确的增殖抑制作用,同时可以促进5-FU的抗肿瘤作用,与前人报道一致[6]。但不同的是,本研究发现,MYR可以双重抑制食管癌细胞的糖酵解和氧化磷酸化,这可能是MYR促进5-FU抗肿瘤作用的新机制。
肿瘤是一种代谢性疾病,异常的代谢不仅为肿瘤细胞生长提供必要的物质和能量,还可以调控其恶性生物学行为,“能量代谢异常”已经被公认为肿瘤细胞的一个特征性标志物[5]。肿瘤细胞倾向于有氧糖酵解是最早被阐释的肿瘤细胞有别于正常细胞的代谢特征,围绕这一特征,研究者们已获得了多个新型有效抗肿瘤药物。葡萄糖转运体(glucose transporters,GLUT)在肿瘤细胞中高表达,有效阻止其表达可以从源头阻断原料供应,从而成为了研发糖酵解抑制剂的切入点[7-8]。本研究结果表明,MYR可以明显降低EC109细胞糖酵解水平,同时发现其可抑制EC109细胞对葡萄糖的摄取,当与5-FU联用时,这种抑制作用进一步增强。MYR作为糖酵解抑制剂值得进一步研究,目前本课题组正在研究MYR对GLUT表达的影响;此外,MYR对糖酵解过程中关键酶的蛋白表达及活性的影响也值得研究者们进一步探索,如限速酶己糖激酶2(hexokinase2,HK2)和乳酸脱氢酶A等。
现代肿瘤研究表明,虽然有氧糖酵解是肿瘤细胞的主要代谢方式,但是线粒体氧化磷酸化(oxida⁃tive phosphorylation,OXPHOS)对肿瘤能量代谢仍发挥重要作用,在某些肿瘤的生长过程中,OXPHOS甚至发挥着关键作用[9],例如Suganuma等[10]使用糖酵解抑制剂2-DG和OXPHOS抑制剂寡霉素分别研究了多种白血病细胞株,结果发现NB4细胞对2-DG敏感,而THP-1细胞表现为2-DG抵抗,但对寡霉素却极其敏感,因此,NB4细胞被认为是糖酵解依赖的白血病细胞,而THP-1细胞则被认为是OXPHOS依赖的白血病细胞。此外,肿瘤细胞会因环境的压力和生长状态的改变不断发生代谢重编程,在糖酵解和OXPHOS 2种代谢模式中灵活切换,以保持生长优势[9]。因此,双重抑制糖酵解和线粒体OXPHOS有望发现更具开发潜力的新型抗肿瘤药物。本研究则发现,MYR在抑制EC109细胞糖酵解的同时,也明显降低OCR值,说明其对线粒体OXPHOS功能也存在调控作用。此外,本研究结果也表明,MYR有效诱导了EC109细胞MMP的降低,与5-FU联用后,MMP下降更为显著。因此,可推测MYR抑制线粒体OXPHOS可能与其诱导MMP下降有关。当然,MYR抑制线粒体OXPHOS的分子机制有待进一步研究。
此外,MYR属于多酚羟基黄酮,其可通过提供氢质子使得极活泼的自由基转变为非活性或较为稳定的化合物,或者通过提高抗氧化酶活性抑制活性氧(reactive oxygen species,ROS)的积累,因而MYR具有较强的抗氧化能力[11]。但也有研究表明,黄酮类化合物兼具抗氧化和促氧化二重活性,在不同条件下互为转换。例如,随作用时间延长、作用浓度的增加、或者有Cu2+的存在等,黄酮类化合物则由抗氧化活性逐渐转变为促氧化活性[11]。5-FU可通过激活细胞内源性Cu2+,亦可通过抑制超氧化物歧化酶活性,引起ROS过量产生,超出细胞清除能力,然后通过氧化应激反应诱导细胞凋亡[12]。本研究发现,MYR 75 μmol·L-1作用不超过 24 h情况下,并不能促进5-FU的抗肿瘤作用,而是限制了5-FU的细胞毒性,促进细胞存活。该结果印证了MYR的抗氧化能力,与Kan等[13]的研究一致。由于作用时间较短,MYR此时发挥了其抗氧化作用,从而抑制了5-FU的氧化效应。另一方面,黄酮作为抗氧化剂会随着时间不断被氧化为苯氧基自由基、半醌式和醌式结构,而这些结构本身具有促氧化活性,同时在Cu2+存在的条件下,这种氧化活性进一步加强[11]。所以在48和72 h,MYR则展示了其促氧化性质,从而增强了5-FU的抗肿瘤作用。
总之,本研究结果表明,MYR对肿瘤细胞增殖有明确的抑制作用,同时在适当的条件下可促进5-FU的抗肿瘤效果。MYR可以有效抑制肿瘤细胞糖酵解水平和线粒体氧化磷酸化功能,其对肿瘤细胞代谢的调控活性可能与诱导线粒体膜电位下降以及限制葡萄糖摄取有关。

