咖啡因对睡眠剥夺模型大鼠脑电和免疫系统功能的影响
王 川,高 荣,房鑫鑫,常海霞,李云峰,王恒林,张黎明
(1.河北北方学院研究生院,河北张家口 075000;2.解放军总医院第八医学中心麻醉科,北京 100094;军事科学院军事医学研究院3.毒物药物研究所,抗毒药物与毒理学国家重点实验室,4.军事认知与脑科学研究所,北京 100850)
良好的睡眠是维持人类正常学习记忆的重要过程,可以促进大脑有效地获取新信息,巩固以及将新信息整合到现有的记忆结构中[1]。长期睡眠不规律或睡眠不足可损害人体免疫系统,并诱导抑郁、焦虑等精神疾病的发生[2]。而急性睡眠剥夺(sleep deprivation,SD)可导致认知能力损害,包括感知、记忆、执行功能、情绪、注意力和警觉性等降低[3]。
γ振荡是神经元同步发放所产生的、周期性变化的一种神经活动模式,由兴奋性锥体细胞和小清蛋白(parvalbumin,PV)中间神经元之间复杂的突触相互作用而产生[4]。研究表明,γ振荡与兴奋性锥体细胞进行的复杂信息处理过程(如信息的计算、转移、存储和检索等)具有同步效应[5],与大脑高级功能(如感知觉、运动行为、记忆形成、警觉和注意力)联系紧密[6-8]。多项研究发现,阿尔茨海默病、帕金森病、精神分裂症和注意缺陷多动障碍均存在异常γ振荡[9]。最近研究发现,SD可引起δ振荡增强、γ振荡减弱,并伴随前额叶皮质(prefrontal cortex,PFC)锥体神经元树突长度缩短和分支数量减少及环磷腺苷效应元件结合蛋白表达减少[10]。
新近研究发现,SD可诱导中枢神经系统炎症和小胶质细胞活化,激活外周Toll样受体4(Tolllike receptors 4,TLR4)/NF-κB信号通路[11]。进一步研究发现,海马和PFC小胶质细胞异常激活是致SD后记忆和注意力损伤的重要诱因[2,12]。
咖啡因(caffeine,CAF)是广泛使用的精神活性药物,具有兴奋心肌、骨骼肌和中枢神经系统、松弛平滑肌及抗氧化等作用,含CAF的食品(如茶叶、咖啡和可可等)常被用来在睡眠不足情况下保持警惕和提高注意力。文献报道,CAF可同时拮抗腺苷A1和A2A受体,提高学习记忆功能及警觉性[13]。目前,针对CAF影响SD后γ振荡和免疫系统功能的研究报道较少。本研究采用脑电频域分析技术评价CAF对SD模型大鼠脑电特征的影响,并采用Western印迹法和免疫荧光法检测细胞因子和炎症相关蛋白的表达及活化的小胶质细胞数量的变化。
1 材料与方法
1.1 药物、试剂和主要仪器
CAF(TC130184),中国石药集团新诺威制药有限公司;大鼠白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-10 ELISA检测试剂盒,中国武汉云克隆科技有限公司;兔抗大鼠TLR 4单抗、兔抗大鼠NF-κB单抗、鼠源GAPDH单抗、兔抗大鼠离子钙接头蛋白分子1(ionized calcium binding adapter molecule 1,Iba1)单抗和DAPI封固剂,美国Abcam公司;辣根过氧化物酶标记的山羊抗兔IgG和山羊抗大鼠IgG抗体,美国LifeSpan BioSciences公司;脑电遥测植入子(HD-S02),美国DSI公司;跑台式睡眠剥夺仪(ZH-PT),中国北京创博生物科技有限公司;脑立体定位仪及颅骨钻,中国瑞沃德生命科技有限公司;正置显微镜(Eclipse E100),日本NIKON公司;冰冻切片机(CryoStar NX50),美国Thermo公司;凝胶电泳相关器材,美国伯乐公司;Odyssey双色红外荧光成像系统(OSA-0358),美国LI-COR公司;多功能酶标仪(EnVisionTM 2104),美国PerkinElmer公司。
1.2 实验动物和分组
雄性Wistar大鼠,体重170~190 g,斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。大鼠单笼饲养,自由摄食饮水,饲养环境温度20~24℃,湿度40%~60%,光照时间8∶00~20∶00。大鼠适应性饲养5 d后开始实验。将大鼠随机分为正常对照组、SD组和SD+CAF组,每组23只。
1.3 电极植入手术和脑电数据分析
大鼠适应性饲养5 d后进行HD-S02植入手术,术后恢复7 d。大鼠术前禁食12 h,ip给予2%戊巴比妥钠(2 mL·kg-1)麻醉,待大鼠角膜反射和疼痛反射消失后,暴露颅骨,通过脑立体定位仪定位电极植入位置(AP:+2.0 mm;ML:0.0 mm;前囟)和(AP:-3.8 mm;ML:-2.0 mm;人字点),将HD-S02植入子的脑电(electroencephalogram,EEG)电极分别植入定位点,肌电(electromyogram,EMG)电极植入颈部肌肉,分别用于收集大鼠EEG和EMG信号[14]。术后,大鼠单笼饲养,并连续3 d每天im给予青霉素钠抗感染。
使用Ponemah 3.0数据采集软件收集EEG和EMG信号,通过NeuroScore软件自动对信号进行分析、整理,将大鼠睡眠时相分为觉醒(wake)期、非快眼动睡眠(non-rapid eye movement sleep,NREM)期和快眼动睡眠(rapid eye movement sleep,REM)期,并计算各期分布时间。通过傅里叶变换将觉醒期γ振荡(30~80 Hz)信号转换为振荡功率谱密度。用SD前、后γ振荡功率谱密度强度的比值表示γ振荡相对强度。
1.4 实验流程
手术恢复期后第0天(D0)10∶00~D1 10∶00,连续24 h记录EEG和EMG信号作为基线期信号。D1 11∶00~D4 11∶00,持续72 h采用跑台式睡眠剥夺仪制备SD大鼠模型,跑步机速度设定为10 cm·s-1,运行3 s、停止12 s交替进行,期间大鼠自由饮水和摄食。D1~D4,每天13∶00 ig给予CAF 50 mg·kg-1(SD+CAF组)或同体积生理盐水(正常对照组和SD组),给药体积1 mL·kg-1。每组取10只大鼠,D4 11∶00-19∶00记录EEG和EMG信号,并统计末次给药后4 h内大鼠睡眠各时相分布时间及γ振荡功率谱密度;每组取8只大鼠,末次给药后2 h取脾、海马和PFC,-80℃冰箱保存;每组取5只大鼠,末次给药后2 h用2%戊巴比妥钠(2 mL·kg-1)麻醉,用生理盐水和4%多聚甲醛经心脏灌注后取全脑,置4%多聚甲醛中保存(图1)。

Fig.1 Experimental procedures.Rats were randomly divided into the normal control,sleep deprivation(SD)and SD+caffeine(CAF)group.After 5-day adaptive feeding,HD-S02 was implanted into the brain of rats to collect electroencephalogram(EEG)signals.After postoperative recovery(D0 10∶00-D1 10∶00),the EEG baseline was recorded continuously for 24 h.D1 11∶00-D4 11∶00,a 72 h-SD model of rats was established by a treadmill instru⁃ment.Rats were ig given CAF 50 mg·kg-1(SD+CAF group)or saline(normal control and SD group)at 13∶00 once per day.EEG signals were recorded to analyze the sleep time and power spectral density within 4 h of the last administration.The brain,spleen,hippocampus and prefrontal cortex(PFC)of rats were collected 2 h after the last drug administration.
1.5 ELISA检测脾、海马和PFC组织IL-1 β,TNF- α和IL-10含量
取1.4制备的脾、海马和PFC组织,研磨后制成组织匀浆,4℃,1000×g离心15 min取上清,按照ELISA试剂盒说明书步骤测定IL-1β,TNF-α和IL-10含量。
1.6 Western印迹法检测脾组织TLR 4和NF- κB蛋白表达水平
取1.4制备的脾组织,研磨,RIPA裂解后离心取上清液;BCA法测蛋白浓度,每组上样量为20 μg,进行 SDS-PAGE 电泳,转印至 PVDF 膜,BSA封闭后加入对应的一抗〔稀释倍数:TLR 4(1∶1000),NF-κB(1∶1000),GAPDH(1∶5000)〕,4℃孵育过夜,TBST清洗;加入二抗辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶400)和辣根过氧化物酶标记的山羊抗大鼠IgG抗体(1∶100),室温孵育后,采用Odyssey双色红外荧光成像系统观察并拍照,用软件Image J对蛋白条带进行半定量分析,以目标蛋白与内参蛋白条带积分吸光度值的比值反映目标蛋白相对表达水平。
1.7 免疫荧光染色检测海马齿状回(dentate gyrus,DG)及内侧PFC(medial PFC,mPFC)活化的小胶质细胞数
取1.4分组制备的全脑,用4%多聚甲醛固定24 h,用20%和30%蔗糖梯度脱水,固定后连续切片(厚度25 μm)。取DG和mPFC的脑片,PBS漂洗3次,加5%BSA封闭1 h,吸净液体;加入抗Iba 1抗体(1∶200),4℃恒温孵育过夜;用 PBS 漂洗3次;避光加入山羊抗兔IgG抗体(1∶500)孵育1 h;PBS漂洗3次;用DAPI封片后于荧光显微镜下观察并拍照。每只大鼠分别选取2~4张海马DG和mPFC切片,采用Image J软件计数Iba阳性细胞数,取平均值。
1.8 统计学分析
2 结果
2.1 CAF对SD模型大鼠睡眠时相的影响
EEG检测结果(图2)显示,与正常对照组相比,SD组大鼠给药前、后每小时觉醒期均缩短(P<0.05,图2A1),给药前1 h及给药后4 h内每小时NREM期延长(P<0.05,图2A2),每小时REM期无统计学差异(图2A3);而给药后4 h内总觉醒期缩短(P<0.01),总NREM期(P<0.01)和总REM期(P<0.05)延长(图2B)。与SD组相比,SD+CAF组大鼠给药前各睡眠时相持续时间无显著差异,给药后4 h内每小时觉醒期延长(P<0.05,图2A1),NREM期及REM期缩短(P<0.05,图2A2和3),给药后4 h内总觉醒期延长(P<0.01,图2B),总NREM期及总REM期均缩短(P<0.01,图2B)。
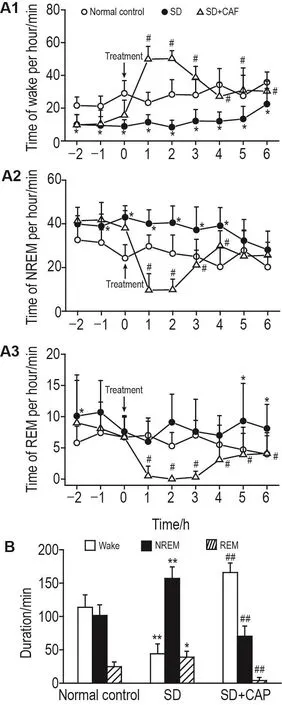
Fig.2 Effect of CAF on sleep phase of SD rats.See Fig.1 for the rat treatment.A1,A2 and A3:the average duration of wake,non-rapid eye movement sleep(NREM)and rapid eye movement sleep(REM)per hour;B:duration of wake,NREM and REM within 4 h of treatment.x± s,n=10. *P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with SD group.
2.2 CAF对SD模型大鼠γ振荡功率谱密度的影响
EEG检测结果(图3)显示,与正常对照组相比,SD组大鼠觉醒期γ振荡功率谱密度在43~62 Hz频段降低(P<0.05);与SD组相比,SD+CAF组大鼠觉醒期γ振荡功率谱密度在35~80 Hz频段均明显增高(P<0.05)。
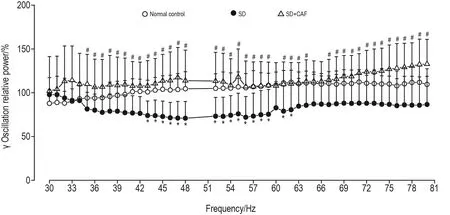
Fig.3 Effect of CAF on γ oscillations(wake)of SD rats.See Fig.1 for the rat treatment.γ Oscillation relative power(%)= γ oscillation frequency power/γ oscillation corresponding frequency power in baseline×100%.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with SD group.
2.3 CAF对SD模型大鼠脾、海马和PFC组织炎症因子IL-1 β,IL-10和TNF- α含量的影响
ELISA结果(图4)显示,与正常对照组相比,SD组大鼠脾和海马组织中IL-1β(P<0.01)和TNF-α(P<0.05)含量显著增高,IL-10含量降低(P<0.01),PFC组织中IL-1β含量升高(P<0.01),IL-10含量降低(P<0.05),TNF-α含量有升高趋势,但无统计学意义。与SD组相比,SD+CAF组大鼠脾和海马中IL-1β和TNF-α含量显著降低(P<0.05),IL-10含量升高(P<0.05,P<0.01);PFC组织中IL-1β含量降低(P<0.05),IL-10含量升高(P<0.05),TNF-α含量有降低趋势,但无统计学意义。
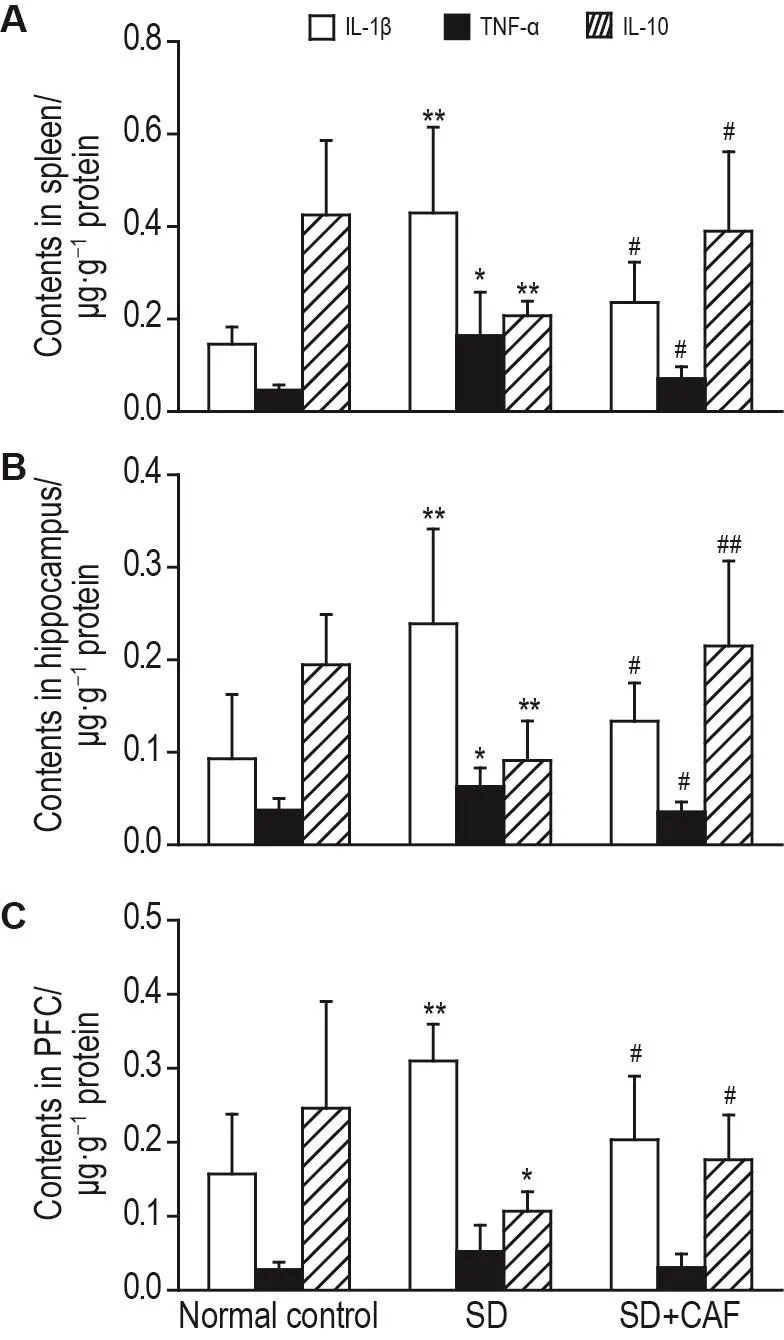
Fig.4 Effect of CAF on contents of inflammatory factors in spleen(A),hippocampus(B)and prefrontal cortex(PFC,C)tissues of SD rats by ELISA.See Fig.1 for the rat treatment.IL-1β:interleukin-1β;TNF-α:tumor neerosis factor-α.±s,n=6-8.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with SD group.
2.4 CAF对SD模型大鼠脾组织TLR4和NF- κB蛋白表达水平的影响
Western印迹结果(图5)显示,与正常对照组相比,SD组大鼠脾组织TLR4和NF-κB蛋白表达水平增高(P<0.05,P<0.01);与SD组相比,SD+CAF组TLR4和NF-κB蛋白表达水平降低(P<0.01)。
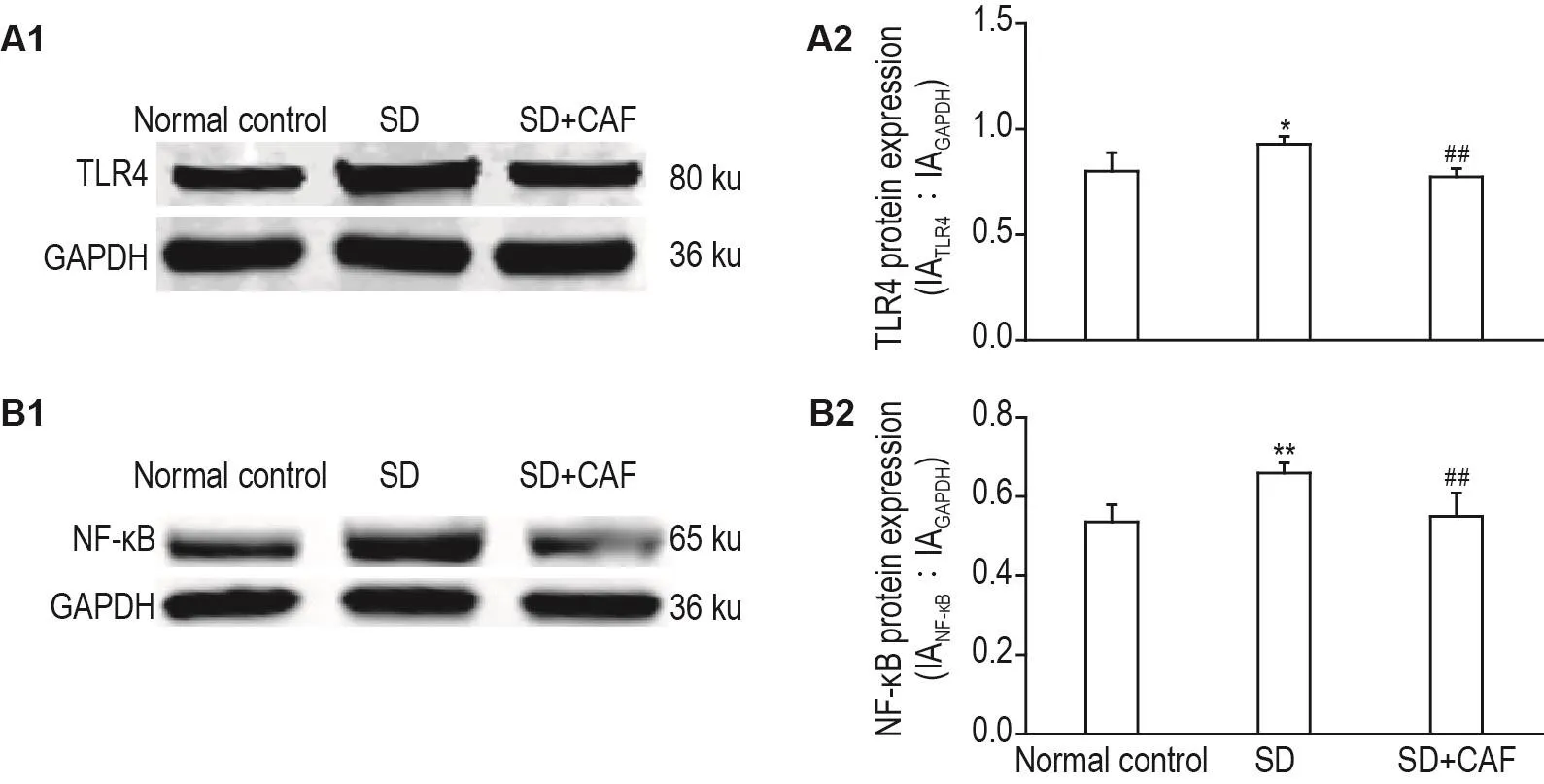
Fig.5 Effect of CAF on expressions of Toll-like receptors 4(TLR4,A)and NF- κB(B)in spleens of SD model rats by Western boltting.See Fig.1 for the rat treatment.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.±s,n=4-5.*P<0.05,**P<0.01,compared with normal control group;##P<0.01,compared with SD group.
2.5 CAF对SD模型大鼠海马DG和mPFC活化的小胶质细胞的影响
免疫荧光结果(图6)显示,在大鼠海马DG和mPFC中,SD组活化的小胶质细胞数均较正常对照组明显增加(P<0.01);SD+CAF组活化的小胶质细胞数较SD组明显减少(P<0.05)。
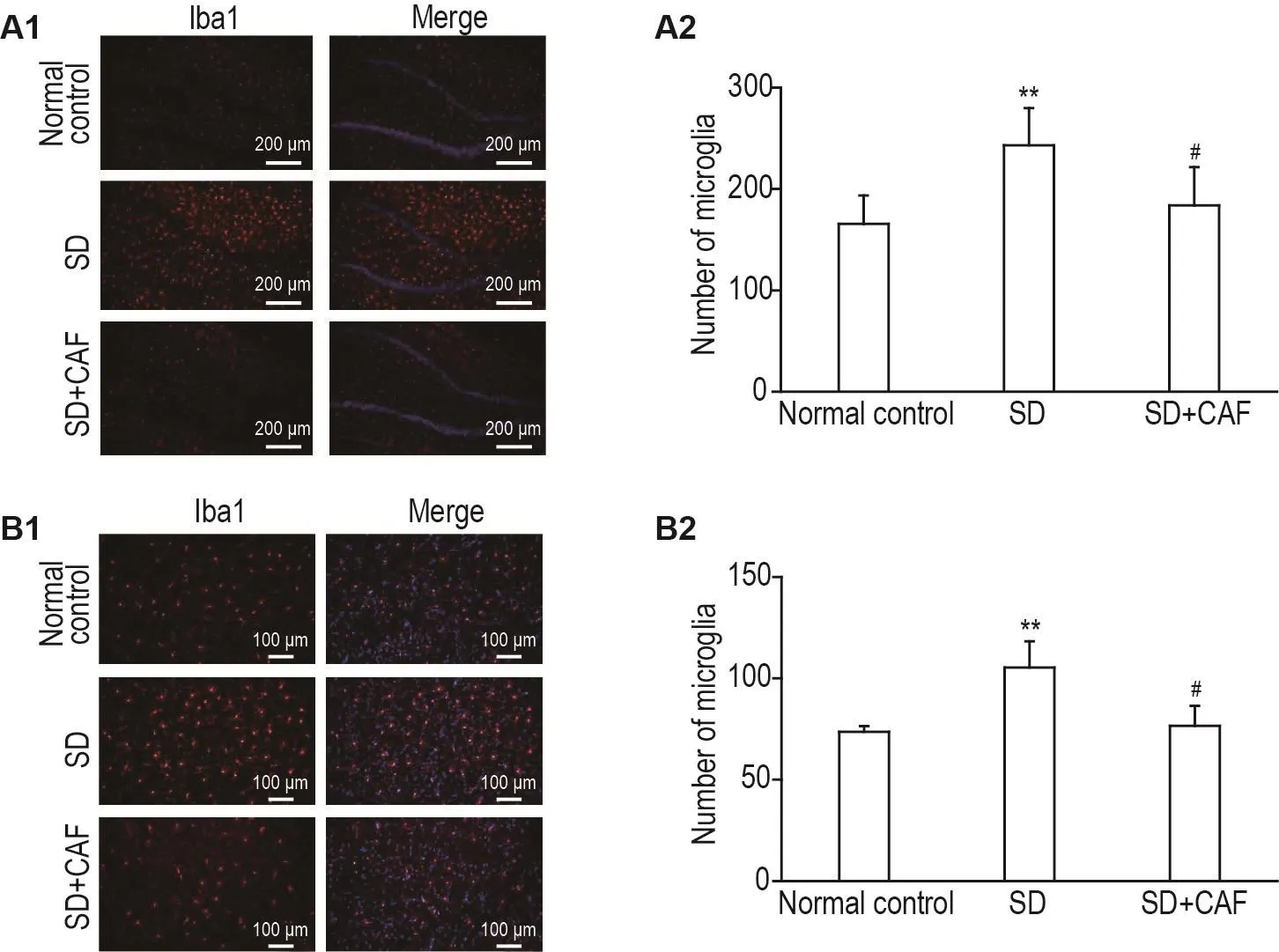
Fig.6 Effect of CAF on numbers of microglia in hippocampal dentate gyrus(A)and medial prefrontal cortex(mPFC,B)of SD model rats by immunofluorescence.See Fig.1 for the rat treatment.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.±s,n=4-5.**P<0.01,compared with normal control group;#P<0.05,compared with SD group.
3 讨论
本研究发现,72 h SD可改变大鼠睡眠结构,导致觉醒时间减少,睡眠时间延长,γ振荡功率下降。而CAF可逆转SD所致的上述变化,增加觉醒时间,缩短睡眠时间,提高γ振荡强度。另外,在SD后,大鼠脾、海马和PFC组织中IL-1β和TNF-α含量升高,IL-10含量降低,并伴随海马和mPFC中活化的小胶质细胞数量增多,而CAF可抑制TLR4/NF-κB通路、炎症因子释放及小胶质细胞激活。
腺苷是一种重要的促睡眠神经递质,随觉醒时间延长,脑内腺苷水平逐渐增高[16]。有研究表明,激活腺苷A1受体可阻断突触前膜钙释放,导致谷氨酸释放减少[17],影响到PV中间神经元及锥体神经元[4],从而导致γ振荡异常。随着SD的延长,脑内腺苷累积[16],大脑皮质电活动减弱,导致睡眠时间延长[18]及γ振荡减弱[10],并伴随学习记忆、警觉性受损[3]。同时,腺苷A1受体可激活钾离子通道,降低细胞内环磷酸腺苷含量,加快神经细胞的超极化速度,从而抑制神经元活动及γ振荡[19]。新近研究表明,通过光遗传技术兴奋PV中间神经元诱发出40 Hz γ振荡,可减少阿尔茨海默病模型大鼠脑内β-淀粉样蛋白的产生,改善认知功能[20]。先前大量研究已证实,咖啡因通过阻断腺苷受体减轻SD后学习记忆和警觉性的降低[21-22]。本研究发现,CAF可逆转SD造成的睡眠时相改变及γ振荡的衰减,尤其在35~55 Hz更为明显,可能与阻断腺苷A1受体有关,这可能是其改善SD后认知障碍的重要机制。
SD与中枢炎症反应、细胞凋亡、钙稳态失衡及神经递质传递改变等有关[23]。有研究表明,SD可激活NF-κB和Toll样受体,增加外周炎症因子的释放[24],而IL-6及TNF-α可损害血管内皮功能并破坏血脑屏障通透性[25]。外周炎症因子通过血脑屏障进入大脑并激活神经胶质细胞,可引起炎症因子进一步升高和神经损伤,从而导致认知、警觉和注意力的下降[26-27]。小胶质细胞在炎症及缺血缺氧情况下被激活,引起突触修剪异常,损害神经可塑性[28]。多项研究发现,小胶质细胞介导的神经炎症与焦虑、注意力下降、记忆损害关系密切[29-30],而腺苷A2A受体拮抗剂可改善小胶质细胞介导的神经炎症,减少炎症因子的释放,发挥神经保护作用[31]。本研究发现,SD可增加激活的小胶质细胞的数量,而CAF治疗可逆转这一现象。进一步研究发现,CAF可抑制TLR4/NF-κB信号通路,抑制小胶质细胞激活,减轻神经炎症。
综上,CAF抗SD后睡眠障碍机制可能与调节睡眠结构和γ振荡、调控小胶质细胞功能和改善神经炎症有关。

