菊淀粉型巴戟天寡糖对慢性应激模型小鼠抑郁、焦虑样行为的改善及对调节性T细胞数量的调节作用
王 轶,郭婷婷,尹勇玉,张黎明,张纪岩,李云峰,
(军事科学院军事医学研究院1.毒物药物研究所,抗毒药物与毒理学国家重点实验室,2.军事认知与脑科学研究所,北京 100850)
抑郁症是以情绪低落、兴趣减退、绝望无助并伴随认知功能受损、睡眠或食欲紊乱等为特征的综合征。据世界卫生组织2019年调查报告显示,抑郁症是患病率最高的精神疾病,是世界范围内致残的主要原因[1-2]。目前临床一线抗抑郁药物主要为选择性5-羟色胺重摄取抑制和5-羟色胺和去甲肾上腺素双重重摄取抑制剂等,但这些药物仅对约1/3患者有效,起效通常存在2~3周延迟,且常伴有认知损害等不良反应[3]。
研究发现,一些中药提取物具有抗抑郁作用,如刺五加苷、金丝桃素和灵芝多糖等[4]。巴戟天为茜草科植物巴戟天(Morinda officinalis How.)的干燥根,具有补肾阳、强筋骨、祛风湿功效。本实验室前期研究发现巴戟天具有抗抑郁作用[5],从中提取出水溶性菊淀粉型低聚寡糖——菊淀粉型巴戟天寡糖(inulin-type oligosaccharides of M.officinalis,IOMO),并证实其为巴戟天抗抑郁作用的主要活性部位[6]。进一步研究表明,IOMO兼具增强免疫[7]和调节睡眠[8]等作用。IOMO结构上属于益生元[9],即一类可在体内产生有益作用,但不能被机体直接消化吸收的物质,其抗抑郁具体机制至今不明。研究发现,IOMO具有改善神经营养和保护神经细胞的作用[10],口服生物利用度低,需要经肠道菌群快速降解,且其水解规律较复杂[11]。IOMO的抗抑郁作用可能是其与肠道菌群相互作用的结果,即依赖于菌群-肠-脑轴[9,12]。神经、免疫和体液三大途径是肠-脑间进行信息沟通的主要通路[13]。巴戟天在中医上的强筋骨、祛风湿功效,以及IOMO增强免疫的作用都提示IOMO可能通过调节机体免疫发挥抗抑郁作用。
近年来,抑郁症与免疫系统功能紊乱之间的关系备受关注,大多数研究主要针对免疫细胞和细胞因子在抑郁症发病和治疗过程中的作用[14]。抑郁症患者血脑屏障通透性增加[15],外周免疫细胞可进入中枢,对中枢神经系统产生重要影响。其中,抑郁症患者外周调节性T(regulatory T,Tr)细胞可能通过下调慢性炎症反应在抑郁症中发挥神经保护作用[16]。研究表明,小鼠全身性耗竭Tr细胞后可表现出抑郁样行为[17],尾静脉注射给予少量Tr细胞刺激剂可改善抑郁样行为[18],因此,Tr细胞可能成为新的抑郁症治疗靶点[19]。肠道和脾是2个重要的免疫器官,菌群-肠-脑轴和脑-脾轴与中枢神经系统和外周免疫系统之间的联系有关,抗抑郁药物可通过靶向肠道和脾的免疫细胞(如Tr细胞)调节机体免疫系统功能,进而改善神经炎症,以发挥抗抑郁作用[4]。
本研究拟采用小鼠慢性不可预知应激(chronic unpredictable stress,CUS)模型,以选择性5-羟色氨重摄取抑制剂氟西汀(fluoxetine,FLX)作为阳性对照药。探究IOMO在发挥抗抑郁作用的同时,对CUS模型小鼠小肠上皮和脾组织中Tr细胞的调节作用,并探索Tr细胞数目与抑郁样行为的相关性,旨在为探索抗抑郁药物的新靶点和新机制提供实验依据。
1 材料与方法
1.1 药品、试剂和仪器
IOMO原料药(批号:20210501),北京同仁堂股份有限公司提供,主要制备过程:巴戟天经水提、活性炭吸附、水洗,乙醇洗脱、浓缩、喷雾干燥得到IOMO成分稳定可靠,经化学及波谱学鉴定[20],IOMO原料药中3~9聚寡糖含量53%~70%,其中5聚糖含量≥6%。FLX原料药(批号:H1929183,纯度>98%),上海阿拉丁生化科技股份有限公司。胎牛血清(fetal bovine serum,FBS),天津康源生物公司;DTT、RPMI-1640培养基、HEPPS和HBSS缓冲液,美国Gibco公司;Permeabilization透化液、Fixation/Perm Diluent固定液和计数微球,美国eBio-science公司;Percoll分离液,美国GE公司;Percp-抗CD45、FITC-抗CD4,APC-抗CD25和PE-抗Foxp3,美国Bio-legend公司。电子分析天平,德国Sartorius公司;小鼠开场实验箱及小鼠强迫游泳实验观察箱,深圳市瑞沃德生命科技有限公司;BD FACSAiraⅡ型流式细胞仪,美国BD公司。
1.2 实验动物
SPF级8周龄雄性C57BL/6J小鼠,体重20~24 g,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。每笼5只饲养,饲养环境温度20~24℃,湿度40%~60%,光照时间8∶00~20∶00,动物自由摄食饮水,适应性饲养7 d后开始实验。本研究经军事医学研究院实验动物伦理委员会批准,符合伦理学以及动物福利要求,实验动物伦理批准号:IACUC-DWZX-2022-523。
1.3 小鼠CUS模型建立
小鼠测定基础蔗糖偏嗜度(详见1.4.1)后,按蔗糖偏嗜度均衡分为4组:正常对照组、CUS模型组、CUS+FLX 10 mg·kg-1组和 CUS+IOMO 50 mg·kg-1组,每组12只。除正常对照组外,其余组连续28 d每天2或3种随机给予以下刺激:夹尾1 min、禁食12 h、禁水12 h、45℃倾斜饲养12 h、通宵照明12 h、潮湿饲养12 h、频闪(100 min-1)加白噪声(110 dB)2 h、强迫游泳(水温15℃)5 min、束缚2 h,应激程序符合不可预测性的特点,并于应激当天(第0天)开始ig给药,每天1次,连续给药28 d。实验流程见图1。

Fig.1 Schedule of treatment and behavioral tests for chronic unpredictable stress(CUS)model in mice.Except for the normal control group,the depression model was prepared by giving CUS stimuli to the remaining groups for 28 consecutive days.Mice were ig given fluoxetine(FLX,10 mg·kg-1),inulin-type oligosaccharides of M.officinalis(IOMO,50 mg·kg-1)or water(control and CUS model groups)from the first day of the CUS procedure once per day for 28 d.SPT:sucrose preference test;OFT:open field test;FST:forced swimming test;NSF:novel inhibition feeding test.
1.4 行为学评价
1.4.1 蔗糖偏嗜实验(sucrose preference test,SPT)
小鼠适应性饲养后进行训练:单笼饲养,同时给予2个装有1%蔗糖水的饮水瓶饲养24 h,再同时给予2个装有纯净水的饮水瓶饲养24 h。训练后正常饲养24 h,再次禁水24 h,然后进行蔗糖偏嗜度测定:同时给予小鼠1%蔗糖水和纯净水各1瓶,检测12 h内蔗糖水和纯净水的饮用量(g),计算蔗糖偏嗜度。蔗糖偏嗜度(%)=蔗糖水饮用量/(蔗糖水饮用量+纯净水饮用量)×100%。初次测量的基础蔗糖偏嗜度作为小鼠均衡分组的依据。于应激第28天再次测定蔗糖偏嗜度,反映小鼠抑郁样行为。
1.4.2 开场实验(open field test,OFT)
于应激第29天进行OFT。小鼠置实验箱(60 cm×60 cm×16 cm,底部等分为16小格)的角落,自由活动5 min,记录小鼠跨格数(四肢全部跨进同一格子)和运动总距离,以反映小鼠的自发活动。同时记录5 min内小鼠进入中央区(中间4格)的累计时间和次数,以反映小鼠的焦虑样行为。
1.4.3 强迫游泳实验(forced swimming test,FST)
于应激第30天进行FST。将小鼠置高20 cm、直径12 cm、水深10 cm的圆形玻璃容器中,水温25℃,观察6 min,记录后4 min的累计不动时间。判定不动的标准是动物在水中停止挣扎,呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面。
1.4.4 新奇抑制摄食实验(novel inhibition feeding test,NSF)
于应激第31天进行NSF。于安静、强光且陌生的环境下,将小鼠置陌生的实验箱一角,箱内底部铺2 cm厚的锯末,中央摆放6个同样大小的食丸。放入小鼠的同时开始计时,记录5 min内开始摄食的潜伏期。摄食的判定标准是动物开始发出啃咬食物的声音,而不是仅仅嗅闻或摆弄食物。摄食潜伏期可作为评价慢性应激模型小鼠抑郁样行为的指标[21]。
1.5 流式细胞术检测小鼠小肠上皮和脾淋巴细胞中Tr细胞的百分比和数目
1.5.1 小肠上皮和脾淋巴细胞悬液的制备
于应激第32天处死小鼠后取小肠和脾。将小肠在保持湿润条件下去除脂肪和淋巴结,在含5%FBS和HEPES 25 mmol·L-1的RPMI洗涤溶液中剖开肠道去除内容物,剪成约1 cm的小段浸入含10%FBS,DTT 1 mmol·L-1和HEPES 25 mmol·L-1的RPMI消化缓冲液中,在37℃振荡20 min。冰上将消化液用70 μm筛网过滤,消化碎片转移到含10%FBS,EDTA 20 mmol·L-1和HEPES 25 mmol·L-1的RPMI的消化缓冲液中,在37℃振荡30 min后再次过滤。将2次过筛后的上清汇合混匀,加入用PMI-1640培养基稀释至44%的Percoll分离液,于24℃、400×g离心20 min得到小肠上皮淋巴细胞悬液。将脾放入100 μm滤网中,于预冷的FACS缓冲洗液(每50 mL 1xPBS缓冲溶液含有1 mL FBS)中挤压,制备脾淋巴细胞悬液。
1.5.2 Tr细胞百分比检测
采用细胞膜表面标志物CD4和CD25及核内标志物Foxp3共染标记Tr细胞。每只小鼠取1x1061.5.1制备的细胞,先加入Percp-抗CD45,FITC-抗CD4和APC-抗CD25抗体各1 μL,进行细胞膜表面染色30 min,再加入Fixation/Perm Diluent固定液固定过夜,用Permeabilization透化液洗涤和透膜后加PE-抗Foxp3抗体1 μL,进行细胞核内染色60 min;用Permeabilization透化液洗涤、固定后4℃保存,而后用流式细胞仪进行分析。各组均设抗体单标管及阴性对照管,细胞检测数为1×105,用FlowJo软件分析Tr细胞在CD4+T细胞中的百分比及CD4+T细胞在CD45+细胞中的百分比。
1.5.3 Tr细胞数目检测
每只小鼠取1.5.1制备的单细胞悬液50 μL,加入200 μL计数微球混合液(含有20 μL计数微球原液、0.1 μL FITC-抗 CD45 抗体和 180 μL FACS 缓冲洗液)混匀,30 min后用流式细胞仪检测CD45+细胞比例,并计算CD45+细胞总数。CD45+细胞总数=(CD45+细胞比例/微球比例)×(每管微球数/样品体积);Tr细胞数目可通过CD45+细胞总数及1.5.2分析得到的CD4+T细胞在CD45+细胞中的百分比和Tr细胞在CD4+细胞中的百分比3项数值相乘得出。
1.6 统计学分析
2 结果
2.1 IOMO对CUS模型小鼠蔗糖偏嗜度的影响
实验结果(图2)显示,应激前各组小鼠蔗糖偏嗜度无明显差异。应激第28天,与正常对照组相比,CUS模型组小鼠蔗糖偏嗜度显著降低(P<0.01),表现出抑郁样行为(快感缺失);与CUS模型组相比,CUS+FLX 10 mg·kg-1组和CUS+IOMO 50 mg·kg-1组小鼠蔗糖偏嗜度均显著升高(P<0.01)。提示IOMO可改善CUS导致的小鼠抑郁样行为。
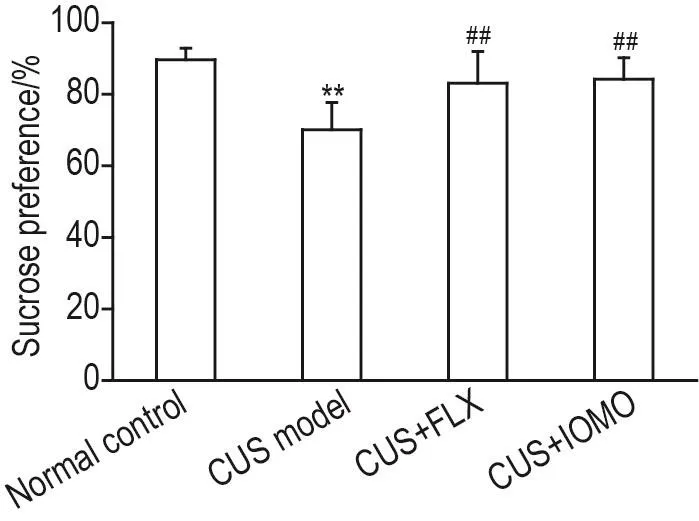
Fig.2 Effect of IOMO on sucrose preference in SPT in CUS mice.See Fig.1 for the mouse treatment.On the 28thday of the CUS procedure,the preference for sucrose was detected.±s,n=12.**P<0.01,compared with normal control group;##P<0.01,compared with CUS model group.
2.2 IOMO对CUS模型小鼠开场行为的影响
OFT结果表明(图3),各组小鼠跨格次数和运动总距离均无显著性差异(图3A),提示IOMO对CUS模型小鼠自发活动无影响。同时,与正常对照组相比,CUS模型组小鼠进入中央区的次数(P<0.01)以及在中央区停留时间(P<0.01)显著减少。与CUS模型组相比,CUS+FLX组和CUS+IOMO小鼠进入中央区次数和累计时间均显著增加(P<0.05)。提示IOMO对CUS引起的小鼠焦虑样行为具有改善作用。
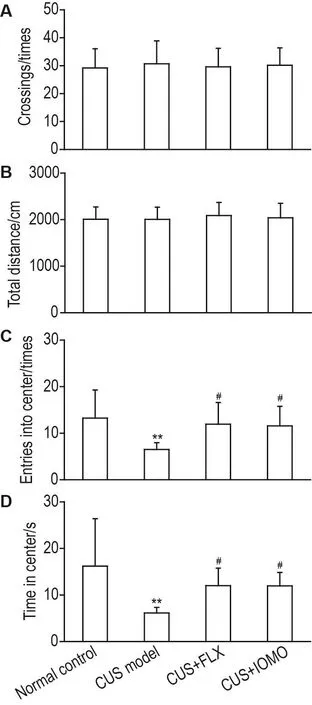
Fig.3 Effect of IOMO on locomotor activity(A and B)and anxiety-like behaviors(C and D)in OFT in CUS model mice.See Fig.1 for the mouse treatment.On the 29st day,the OFT was performed.±s,n=12. **P<0.01,compared with normal control group;#P<0.05,compared with CUS model group.
2.3 IOMO对CUS模型小鼠强迫游泳和新奇抑制摄食行为的影响
FST和NSF实验结果(图4)显示,与正常对照组相比,CUS模型组小鼠强迫游泳不动时间和新奇环境摄食潜伏期均显著延长(P<0.01)。与CUS模型组相比,CUS+FLX组和CUS+IOMO组小鼠强迫游泳不动时间(P<0.05)和新奇环境摄食潜伏期(P<0.01)均显著缩短。提示在FST和NSF实验中,IOMO对CUS小鼠抑郁样行为具有改善作用。
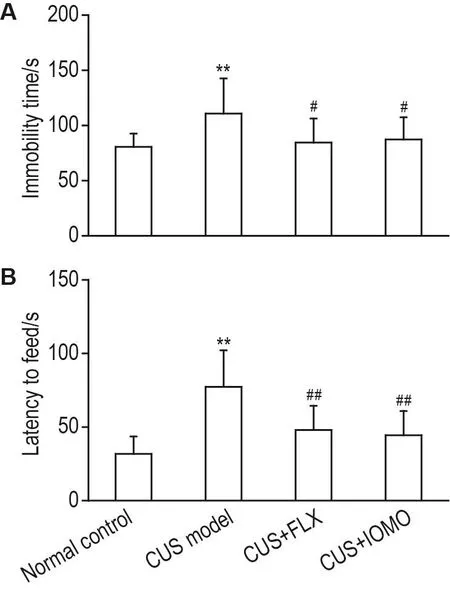
Fig.4 Effect of IOMO on depression-like behavior in FST(A)and NSF(B)in CUS model mice.See Fig.1 for the mouse treatment.On the 30ndand 32thday,the immobility time in FST and the latency to feed in NSF were recorded.±s,n=12.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with CUS model group.
2.4 IOMO对CUS模型小鼠小肠上皮Tr细胞数目的影响
流式细胞术检测结果显示,各组小鼠小肠上皮Tr细胞占总CD4+T细胞比例无显著性差异(图5A和5B)。与正常对照组相比,CUS模型组小鼠小肠上皮Tr细胞数目显著减少(P<0.05);与CUS模型组相比,CUS+FLX组小鼠小肠上皮Tr细胞数目显著增多(P<0.05)。同样,CUS+IOMO组小肠上皮Tr细胞数目也显著增多(P<0.05)(图5C)。
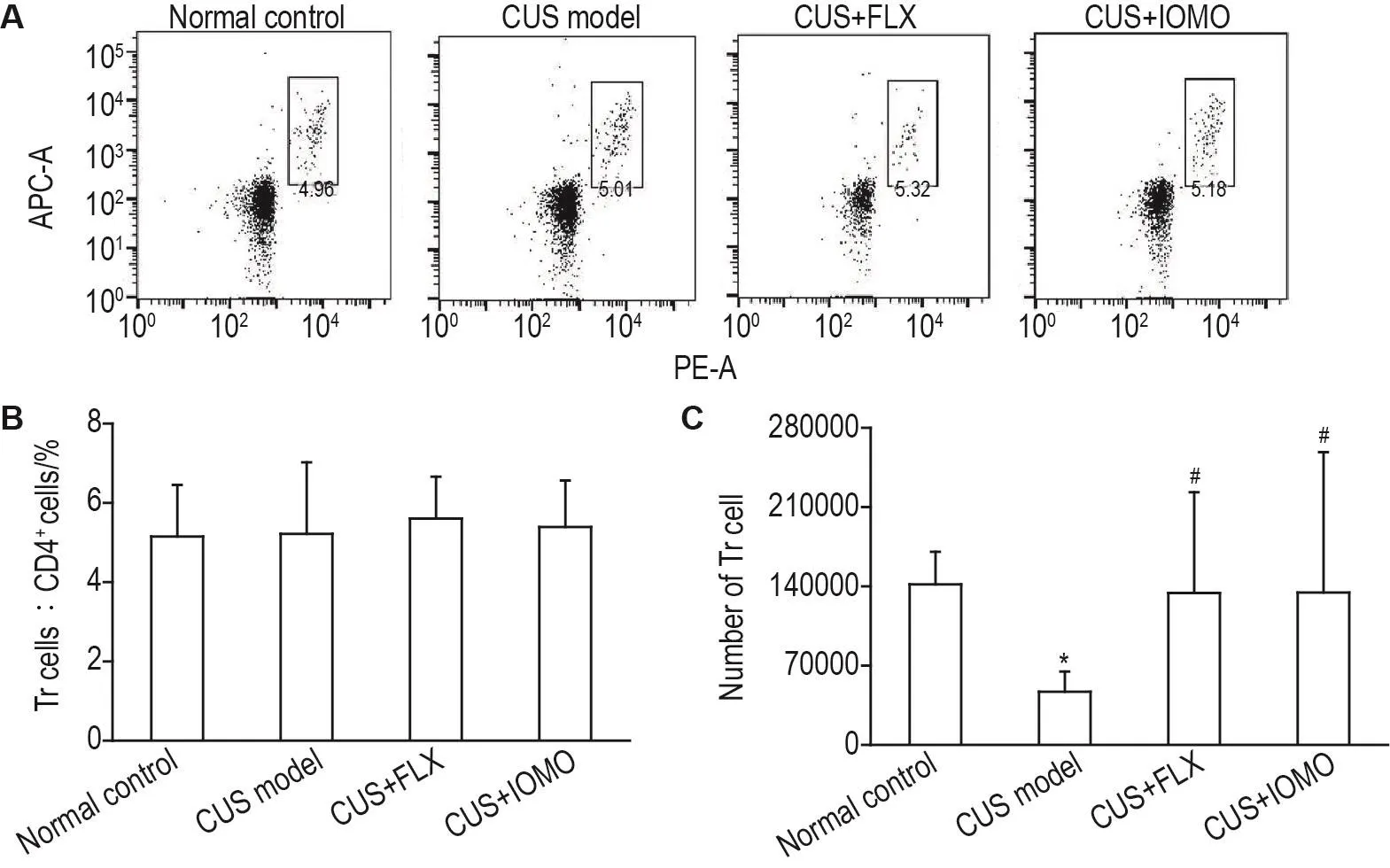
Fig.5 Effect of IOMO on proportion(B)and number(C)of regulatory T(Tr)cells in intestinal epithelial lympho⁃cytes of CUS model mice by flowcytometry.See Fig.1 for the mouse treatment.B was the quantitative analysis results of A.The number of Tr cells was calculated by multiplying the total number of CD45+cells,the percentage of CD4+T cells in CD45+cells and the percentage of Tr cells in CD4+T cells.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with CUS model group.
2.5 IOMO对CUS模型小鼠脾组织中Tr细胞数目的影响
流式细胞术检测结果显示,各组小鼠脾组织中Tr细胞占总CD4+T细胞百分比无显著性差异(图6A和6B)。与正常对照组相比,CUS模型组小鼠脾组织中Tr细胞数目显著减少(P<0.05)。与CUS模型组相比,CUS+FLX组和CUS+IOMO组小鼠脾组织中Tr细胞数目显著增多(P<0.05)(图6C)。
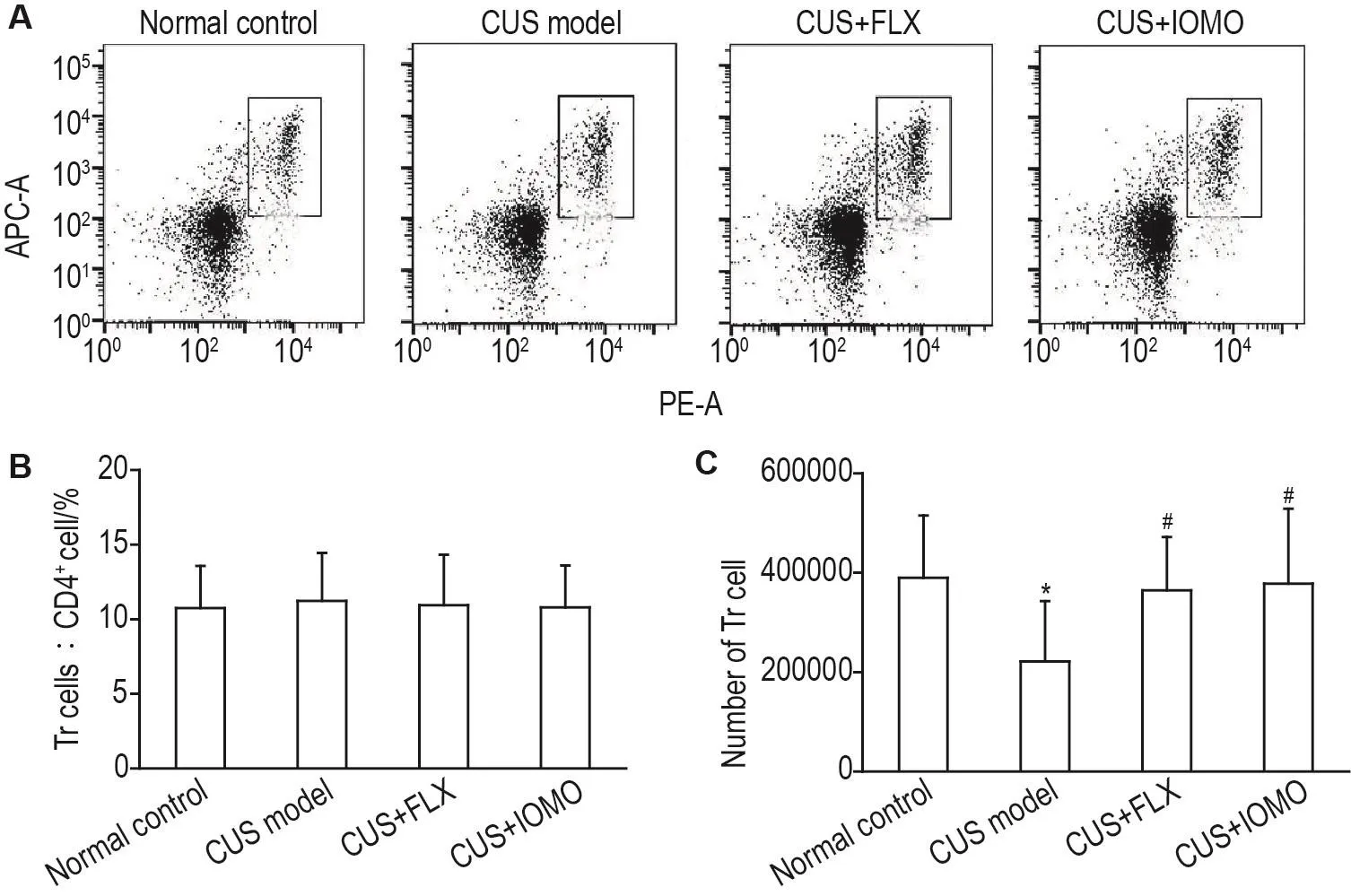
Fig.6 Effect of IOMO on Tr cells in spleens of CUS model mice by flowcytometry.See Fig.1 for the mouse treatment.B and C were the quantitative analysis results of A.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with CUS model group.
2.6 Tr细胞数目与蔗糖偏嗜度的相关性
按照文献[22-23]方法评估Tr细胞数目与抑郁样行为(蔗糖偏嗜度)之间的相关性发现,小肠上皮和脾组织中Tr细胞数目与蔗糖偏嗜度均呈正相关,Pearson相关系数r分别为0.5044和0.7267(P<0.05)。提示小肠上皮和脾组织中Tr细胞数目变化与小鼠抑郁样行为变化显著相关。
3 讨论
本研究结果显示,IOMO可在改善CUS模型小鼠焦虑和抑郁样行为的同时显著增加小肠上皮和脾组织中Tr细胞数量,且Tr细胞数量与抑郁样行为变化程度之间具有显著相关性。
T细胞作为免疫系统的重要组分之一,在机体适应性免疫应答中发挥重要作用。免疫调控使得T细胞分化为不同的亚群,以实现多样的免疫应答模式。根据T细胞膜表面标志物的不同,可分为CD4+T和CD8+T细胞,前者又可分化为Th1,Th2,Th17和Tr细胞等。T细胞的发育和分化失衡与抑郁症病因学密切相关,如抑郁症患者血液循环内T细胞凋亡增加[24]、CD4+/CD8+比值降低[25]以及Th1/Th2比值显著升高[26]等。Tr细胞是CD4+T细胞的重要亚群之一,近年来的研究越来越关注Tr细胞分化失衡与抑郁症的关系。研究表明,Tr细胞分化失衡引起了包括中枢小胶质细胞在内的全身巨噬细胞的激活,引发炎症细胞因子的过度分泌,诱发神经炎症,这可能是其诱发抑郁的机制之一[27]。
文献报道,CUS模型小鼠体内Tr细胞水平显著下降,在全身性耗竭Tr细胞后,模型小鼠表现出抑郁样行为[18],这与本研究结果一致。临床相关研究也表明,抑郁症患者外周血Tr细胞水平显著下降[17]。近期研究显示,部分新型冠状病毒肺炎患者治愈后表现出焦虑、抑郁症状,其外周血内Tr细胞水平亦显著下降[28]。本课题组前期研究表明,在大鼠获得性无助抑郁模型上,IOMO 50 mg·kg-1具有抗抑郁效应[5]。本研究结果发现,IOMO在该剂量下显著增加CUS模型小鼠小肠上皮和脾组织中Tr细胞数量,提示增加小肠上皮和脾组织中Tr细胞可能是其抗抑郁作用的机制之一。
小肠上皮淋巴细胞是散在分布在肠道上皮细胞之间的免疫细胞,能直接接触肠道菌群及其代谢产物。由于IOMO须经肠道菌群代谢,因此与之直接接触的小肠上皮淋巴细胞更早受到IOMO及其代谢产物的影响。本研究结果表明,IOMO可改善CUS模型小鼠小肠上皮Tr细胞数目的减少,提示IOMO及其肠道菌群代谢产物可能改善了CUS引起的Tr细胞减少。作者所在团队前期研究发现,IOMO可增加小鼠肠道内容物短链脂肪酸(short chain fatty acids,SCFA)产量(待发表)。同时相关研究表明,SCFA可显著促进初始CD4+T细胞向Tr细胞的分化[29],提示IOMO增加Tr细胞数目可能与其代谢产物SCFA促进Tr细胞产生有关。另有研究显示,抑郁症患者及抑郁模型动物血液循环的Tr细胞水平显著降低,慢性社交挫败小鼠肠道淋巴结内Tr细胞显著下降[30],益生元和益生菌共同作用可在改善小鼠抑郁样行为的同时增加小鼠回肠固有层中Tr细胞的水平[31],其机制与肠道某些固有淋巴细胞亚群有关[32]。
本研究发现,IOMO可改善CUS模型小鼠脾组织中Tr细胞数目的减少,提示IOMO代谢产物进入血液循环后不但可作用于直接接触的小肠上皮淋巴细胞,还可作用于全身性器官。文献报道,社交挫败抑郁模型小鼠脾Tr细胞水平显著下降,抑郁易感小鼠Tr细胞分化受到抑制[33],与本研究结果一致,提示Tr细胞分化失衡可能是抑郁症发病的重要机制。
本研究进一步发现,小肠上皮和脾组织中Tr细胞数目与蔗糖偏嗜度呈显著正相关,表明小肠上皮和脾组织中Tr细胞数目与抑郁样行为显著相关,提示增加小肠上皮和脾组织中Tr细胞数量可能是IOMO抗抑郁作用机制之一。
前期研究已证实,ig给予IOMO 25~50 mg·kg-1具有明确的抗抑郁效应[34-35],因此本研究采用50 mg·kg-1剂量,阳性药FLX也同样采用文献报道的小鼠模型评价抗抑郁效应的有效剂量10 mg·kg-1[36]。需要注意的是,本研究采用了伴随给药方式探讨IOMO治疗作用,其主要原因一是CUS模型耗时较长,伴随给药可适当缩短研究周期,二是抗抑郁药物通常存在约2周的起效延迟期,使得伴随给药成为研究抗抑郁药物治疗效果的常用给药方式。
综上,在小鼠CUS抑郁模型中,IOMO对焦虑样和抑郁样行为具有改善作用,并可调节小肠上皮淋巴细胞和脾组织中Tr细胞的数量,且小肠上皮和脾组织中Tr细胞数目变化和行为变化之间具有显著相关性。本研究为天然来源的抗抑郁药物对免疫系统的影响提供了新的实验依据,其具体调节机制有待深入研究。

