Hsa_circ_0087354通过hsa-miR-199-3p/SLC7A11调节MG-63细胞增殖及氧化还原状态
郑宝莲, 何嘉轩, 梁珮琪, 李 丹, 刘小川, 张静莹
(广东医科大学附属东莞第一医院,口腔医学3D打印技术重点实验室, 广东东莞 523710)
氧化应激(oxidative stress)是指机体在遭受各种有害刺激时,体内活性氧自由基产生增多并超出了抗氧化酶的清除能力,造成氧化系统和抗氧化系统失衡,引起中性粒细胞炎性浸润和蛋白酶分泌增加,同时产生大量活性氧自由基,严重阻碍细胞增殖和分化,进而引起生物损伤的一种反应[1]。严重的氧化应激不仅会损伤细胞和组织,造成多种疾病的发生;同时也调控组织(骨、软骨、软组织)的再生,影响疾病的治疗和预后[2]。研究发现,高血压、糖尿病、牙周病等慢性疾病的患者,牙种植体失败率显著高于正常人[3]。软组织愈合和骨组织修复时间比健康人更长[4]。
细胞的氧化还原状态,受到多种基因及生物学行为调控,针对单一基因的治疗通常不能达到满意效果。近年研究发现,非编码RNA在转录、翻译、蛋白质修饰等多个层面调控多个下游基因的表达,在氧化还原反应中发挥重要作用[5]。环状RNA (circular RNA,circRNA)作为一种环状结构的长非编码RNA,是一类不具有5′末端帽子和3′末端poly(A)尾巴,并以共价键形成环形结构的非编码RNA分子。大部分circRNA是由外显子序列构成,在不同物种间高度保守;其在细胞浆中富集,丰度有时甚至比相应的线性RNA高10余倍;其对核酸酶具有高耐受性,在表观遗传、转录及转录后基因表达中发挥重要调控作用[6]。CircRNA具有理想生物标志物(biomarker)的特征优势:取材无损伤、检测稳定性高、组织特异性好、灵敏度高、具有半衰期长、稳定性强的典型优势,具有较好的临床转化价值[7]。
CircRNA可作为吸附microRNA (miRNA)的海绵体,通过“circRNA-miRNA-mRNA”网络调节途径,发挥关键的基因调控功能[8],已有研究证实,circRNA参与氧化应激反应过程[9]。Hsa_circ_0087354是本课题组在牙髓干细胞中发现的与氧化应激密切相关的一个新的circRNA[10],但其发挥作用的机制尚待进一步阐明。本研究将通过脂质体瞬时转染的方式,在MG-63细胞中过表达hsa_circ_0087354,通过检测氧化应激的成骨细胞内溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、活性氧1(reactive oxygen species1,ROS1)及超氧化物歧化酶1(surperoxide dismutase1,SOD1)等氧化应激相关基因的表达和氧化应激细胞增殖能力,以及GSH(glutathione)浓度及ROS、SOD等氧化还原酶的活性,明确hsa_circ_0087354调控成骨细胞增殖和氧化还原状态的作用及其作用途径。有望为hsa_circ_0087354在氧化应激相关疾病中的靶向治疗提供理论依据,并为临床上促进高血压、糖尿病、牙周炎等慢性疾病患者牙种植体骨结合,提高种植体成功提供理论基础。
1 材料与方法
1.1 材料与设备
MG-63细胞 (human osteosarcoma cells)来源于南方医科大学黄文华课题组;胎牛血清、LipofectamineTM2000 CD Reagent、高糖DMEM粉末、青链霉素、胎牛血清(FBS)、NanoDrop2000和胰蛋白酶购自赛默飞世尔科技有限公司;PBS粉末、3%双氧水(H2O2)、还原型谷胱甘肽(glutathione,GSH)试剂盒购于北京索莱宝科技有限公司;总超氧化物歧化酶(surperoxide dismutase,SOD)活性检测试剂盒(NBT法)、活性氧(reactive oxygen species,ROS)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)检测试剂盒、双荧光素酶报告基因检测(double luciferase reporter gene assay)试剂盒和总RNA抽提试剂(Trizol)购买于上海碧云天生物技术有限公司;Cell Counting Kit-8 (CCK-8)试剂盒购于北京兰杰柯科技有限公司;RT-PCR试剂盒购自宝生物工程(大连)有限公司;载体和引物由上海吉玛制药技术有限公司合成;hsa-miR-199a-3p mimics、hsa-miR-199b-3p mimics及hsa-NC-mimics由汉恒生物科技(上海)有限公司合成;质粒小/中量提取纯化试剂盒(Plasmid Mini/Midiprep Kit)购于Axygen;野生型(WT)SLC7A11、突变型(MUT)SLC7A11、野生型(WT)hsa_circ_0087354以及突变型(MUT)hsa_circ_0087354载体由酸谈(上海)信息科技有限公司构建合成。
1.2 细胞培养及转染
从-80 ℃低温冰箱中取出MG-63细胞,复苏后用完全培养基(10%FBS+1%青链霉素 +DMEM)培养。当细胞生长密度达70% ~ 80%时,用胰蛋白酶消化,获得细胞悬液,以2×105细胞/mL 接种到24孔细胞培养板中,培养24 h。转染前1 h更换为0.5 mL DMEM培养基。参照LipofectamineTM2000 CD Reagent说明书进行转染,将孔板置于37 ℃,5% CO2培养箱中培养6 h,更换为完全培养基继续培养。24 h后进行RT-PCR检测,30 h后进行氧化应激相关试剂盒检测。
1.3 氧化应激细胞模型构建
MG-63细胞 (2×105细胞/mL) 接种于24孔细胞培养板中(n= 3),每孔1 mL,置于37 ℃,5% CO2培养箱中培养24 h。以3% H2O2溶于DMEM稀释成0.3 mmol/L的工作液,加入细胞中培养24 h,用于检测细胞内ROS、GPx和SOD活性。
1.4 谷胱甘肽浓度检测
MG-63细胞(2 × 105细胞/mL)接种于24孔培养板中(n= 3),每孔1 mL,按上述细胞转染方法转染,培养30 h,用胰蛋白酶消化收集,计数后的细胞置于1.5 mL无菌离心管中,每管加入100 μL谷胱甘肽过氧化物酶检测试剂盒中的试剂一。加入适量液氮,冻融3次。4 ℃ ,8 000 g离心10 min,每组每孔加入20 μL上清液,140 μL试剂二,40 μL试剂三。充分混匀后,将96孔板置于全波段荧光酶标仪(BioTek Synergy2,BioTek,德国)上,412 nm波长处检测吸光值,计算出应激后的细胞内GSH浓度。
1.5 总超氧化物歧化酶活性检测
MG-63细胞(2 × 105细胞/mL)接种于24孔培养板中(n= 3)。每孔1 mL,按上述细胞转染和氧化应激方法处理细胞。用胰蛋白酶消化收集后的细胞于1.5 mL离心管中,每管加入SOD检测缓冲液300 μL,用适量液氮冻融3次。4 ℃,12 000 g离心3 min,获取上清液。按说明书操作,制备NBT/酶工作液和反应启动工作液。并将上述两者和上清液按量加入到96孔板,充分混合后,于全波段荧光酶标仪(BioTek Synergy2,BioTek,德国)560 nm波长处检测吸光度,通过计算其抑制百分率,最后得出SOD活性。
1.6 活性氧的活性检测
MG-63细胞(2 × 105细胞/mL)接种于24孔培养板中(n= 3),每孔1 mL,按上述细胞转染和氧化应激方法处理细胞。去除0.3 mmol/L H2O2刺激后的氧化应激细胞培养液(n= 3),用1×PBS洗涤3次,加入提前配置好的DCFH-DA,置于37 ℃,5% CO2培养箱内孵化20 min,用1×PBS清洗氧化应激细胞3次去除染料。在全波段荧光酶标仪(BioTek Synergy2,BioTek,德国)488 nm激发波长和525 nm发射波长下,计算ROS活性。
1.7 谷胱甘肽过氧化物酶活性检测
MG-63细胞(2 × 105细胞/mL)接种于24孔培养板中(n= 3),每孔1 mL,按上述细胞转染和氧化应激方法处理细胞。向各孔加入1 mL预冷的1×PBS后,置-20 ℃冰箱孵化30 min,用1 mL 移液枪轻轻吹打混匀获得细胞悬液,1 000 r/min离心3 min,收集细胞沉淀。加入100 μL 1×PBS混匀,用液氮冻融3次,4 ℃,12 000 g离心3 min,获得上清液。按说明书操作,将相应的试剂按量加入96孔板后,25 ℃全波段荧光酶标仪(BioTek Synergy2,BioTek,德国)340 nm波长处检测吸光度,计算GPx活性。
1.8 RNA提取和RT-qPCR
采用Trizol试剂盒提取氧化应激细胞总RNA,具体方法参考说明书。利用PrimeScript RT reagent Kit with gDNA Eraser 试剂盒反转录成 cDNA,合成的cDNA置于-80 ℃冰箱中保存备用。RT-PCR总体系为20 μL包括引物(10 μmol/L,上下游引物 1∶1 混合)2 μL,cDNA 4 μL,2 × SYBR Premix Ex Taq 10 μL,RNAase Free ddH2O补至 20 μL。反应条件如下:预变性95 ℃ 5 s;PCR定量分析95 ℃ 15 s,60 ℃ 1 min 40个循环;溶解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 min;降温50 ℃ 30 s。在实时定量PCR仪(LightCycle 480, 上海罗氏有限公司, 中国)上检测基因相对表达。以U6和β-actin分别作为miRNA和其他基因的内参,采用2-△△Ct法计算hsa_circ_0087354、hsa-miR-199a-3p、hsa-miR-199b-3p、Nrf2、SOD1、ROS1和SLC7A11相对表达水平(n=3)。各基因的引物序列见Table 1。
2000级曼巴扎仓第一届医学生久麦多杰,32岁,梳着一个略显花白的小辫子,他在共和县开了一家藏医诊所,当曼巴扎仓的病人太多时他就回来分担活佛压力。他回顾10年的学医生涯时说:

Table 1 RT-qPCRprimer sequence
1.9 CCK-8法细胞增殖检测
MG-63细胞(2 × 104细胞/mL)接种于96孔培养板中(n= 3),每孔100 μL,置于37 ℃,5% CO2培养箱中培养24 h。按上述法进行细胞转染,6 h,更换为完全培养基,分别在转染后1 d、2 d、3 d和4 d,在相对应的孔内加入CCK-8试剂10 μL/孔,培养3 h后取出。在全波段荧光酶标仪(BioTek Synergy2,BioTek,德国)上490 nm波长处检测各孔吸光度值。
1.10 双荧光素酶活性验证靶向关系
取对数生长期的MG-63细胞(2×105细胞/mL)接种于24孔培养板(n= 5),每孔1 mL。继续培养24 h,转染前1 h更换为0.5 mL空白培养基。参照LipofectamineTM2000 CD Reagent说明书,将构建的荧光素酶报告基因野生型质粒、突变型质粒及合成的hsa-miR-199-3p及hsa-miR-NC共转染到细胞;转染 48 h ,将细胞用1×PBS 洗涤3次;每孔加入200 μL细胞裂解液,室温孵化10 min,10 000 r/min离心5 min,获得应激后的细胞裂解液上清液;取100 μL上清液加入96孔板中,上机测其发光值;再加入100 μL萤火虫荧光素酶检测工作液,吹吸混匀,上机测发光值;以萤火虫荧光素酶活性值与海肾荧光素酶活性值的比值作为相对荧光素酶活性,并与阴性对照比较。
1.11 生物信息学分析
通过Starbase(http://starbase.sysu.edu.cn/)[11]、circBank(http://www.circbank.cn/index.html)[12]和circAtlas 2.0(http://circatlas.biols.ac.cn/)[13]3个数据库,预测与hsa_circ_0087354相互作用的miRNA,获得3个数据库共交集靶向预测miRNA;随后,采用miRNA靶基因的预测数据库miRDB(http://mirdb.org/)[14]、Starbase(http://starbase.sysu.edu.cn/)及DIANA TOOLS(http://carolina.imis.athena-innovation.gr/diana_tools/web/index.php?r=tarbasev8/index)[15],预测上述交集获得的miRNA的靶基因,获得3个数据库共交集的mRNA。最后,利用cytoscape 3.7.1构建“circRNA-miRNA-mRNA”互作网络。
1.12 统计学方法
所有数据均采用均值±标准差(Mean±SD) 表示,采用GraphPad Prism 8.0.2(263)软件进行两组间配对t检验分析,分析各组之间是否存在显著差异。
2 结果
2.1 Hsa_circ_0087354降低MG-63细胞氧化应激
为研究hsa_circ_0087354对细胞氧化应激的作用,以0.3 mmol/L H2O2刺激细胞,构建氧化应激模型。活性检测表明,相比于NC组的ROS(87.67±2.62)和SOD(0.42±0.02)及GPx(10.03±0.59)的活性,0.3 mmol/L H2O2组的ROS(148.67±8.38)活性显著上升(P<0.001),SOD(0.28±0.001)及GPx(6.21±0.51)活性显著下降(P<0.001, Fig. 1A),表明0.3 mmol/L H2O2成功构建氧化应激细胞模型。与NC组(0.50±0.03)相比,hsa_circ_0087354(1.00±0.09)在氧化应激状态下的基因表达显著提高(P<0.01),提示hsa_circ_0087354可能参与调控细胞的氧化还原反应。
为进一步明确hsa_circ_0087354调控细胞氧化还原作用,构建ctrl质粒和hsa_circ_0087354质粒过表达载体,采用LipofectamineTM2000瞬时转染MG-63细胞。24 h后,使用倒置荧光显微镜(OLYMPUS IX73, Olympus Corporation,日本)对转染的细胞进行实时荧光拍摄及相关基因表达检测。RT-qPCR结果显示,相对于ctrl组hsa_circ_0087354(0.56±0.22)和SOD(1.00±0.01)及ROS1(1.78±0.07)的基因表达量,hsa_circ_0087354组的hsa_circ_0087354(8.88±1.13)和SOD1(1.23±0.14)基因表达量显著上调(P<0.05),而ROS1(1.30±0.07)基因表达量显著下调(P<0.01)。表明hsa_circ_0087354成功转入氧化应激的细胞内,而且具有抗氧化作用(Fig. 1B)。通过氧化应激相关试剂盒活性分析发现,在hsa_circ_0087354组氧化应激的细胞内,GSH浓度(53.22±0.41)及SOD(1.94±0.10)和GPx活性(23.11±2.35)显著高于ctrl组的GSH浓度(43.53±0.47)以及SOD(0.51±0.05)和GPx活性(10.10±1.21)(P<0.01,Fig. 1C)。在功能层面证实了hsa_circ_0087354具有抗氧化作用。CCK-8结果表明,hsa_circ_0087354具有促进氧化应激细胞增殖的作用(P<0.05, Fig. 1D)。
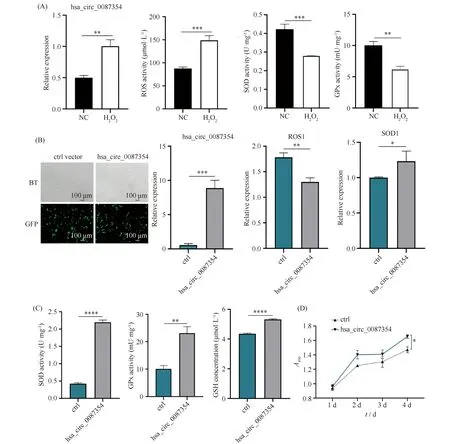
Fig.1 Hsa_circ_0087354 regulated cellular redox state (A) After MG-63 cells were stimulated with 0.3 mmol/L H2O2, the relative expression of hsa_circ_0087354 and the activities of SOD and GPx were increased, while the activities of ROS was decreased compared with normal cells. (B) The fluorescence pictures showed the hsa_circ_008735 group was transfected in MG-63 cells by LipofectamieTM 2000. After transfected with hsa_circ_0087354, the mRNA expressions of hsa_circ_0087354, ROS1 and SOD1 were changed by RT-qPCR. (C) The activities of GSH, SOD and GPx were improved after overexpression of hsa_circ_0087354 in MG-63 cells. (D) The CCK-8 assay was used to evaluate the proliferation of MG-63 cells with hsa_circ_0087354 overexpression at 1, 2, 3, 4days after transfection. Values are the mean ±SD of three determinations from separate experiments.* means P<0.05;**means P<0.01;*** means P<0.001;**** means P<0.0001
2.2 生物信息学分析预测hsa_circ_0087354/hsa-miR-199-3p/SLC7A11之间靶向调控关系
通过Starbase预测发现,hsa_circ_0087354的3′ UTR与hsa-miR-199a-3p和hsa-miR-199b-3p之间存在靶向结合。通过miRNA的靶基因预测软件,发现在众多的哺乳动物中,均存在SLC7A11的3′UTR与hsa-miR-199a-3p和hsa-miR-199b-3p的靶向结合。因此,可能存在hsa_circ_0087354/hsa-miR-199-3p/SLC7A11信号通路调节网络(Fig. 2B)。
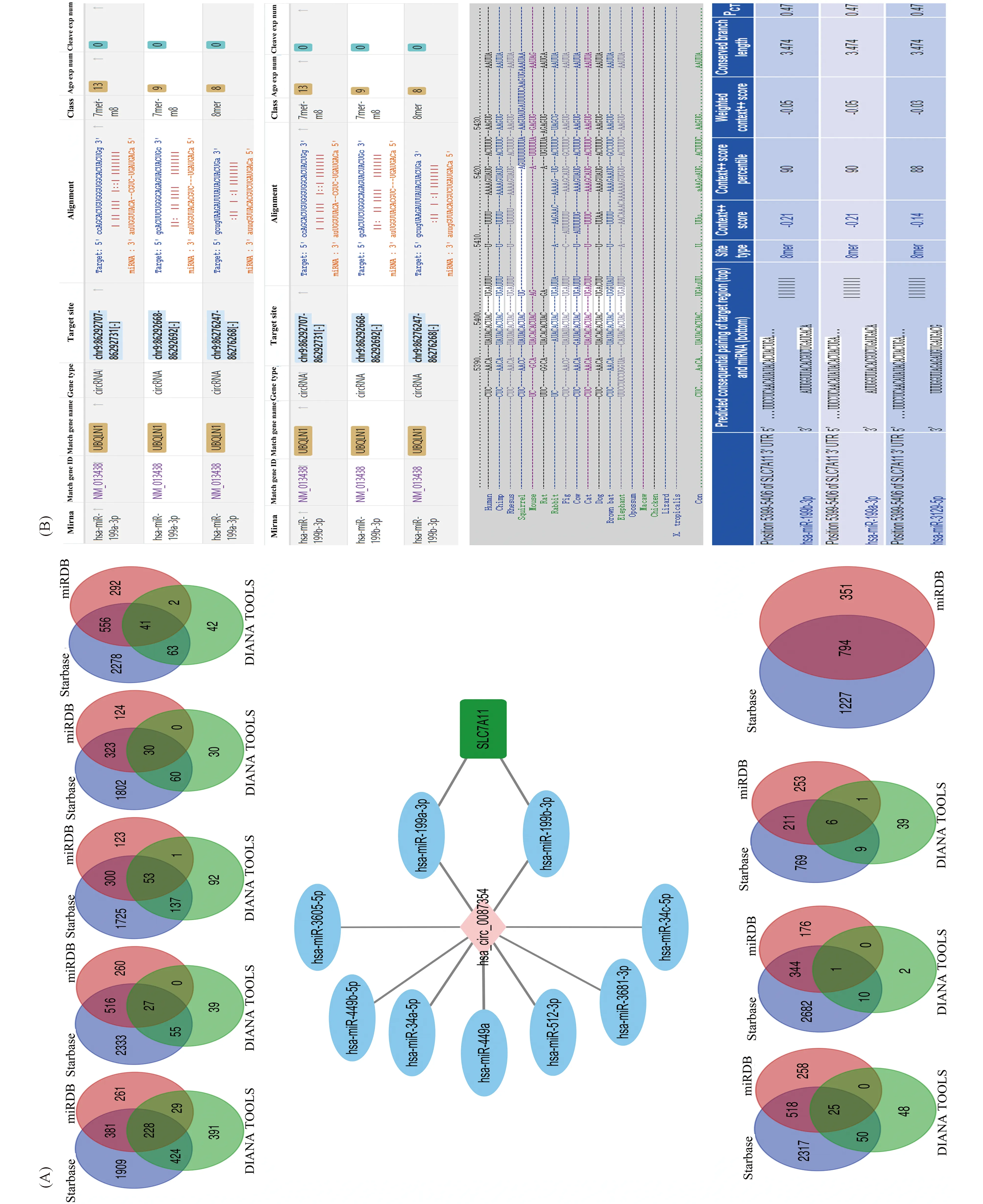
Fig.2 Bioinformatics analysis and prediction of target genes (A) The target genes from Starbase, miRDB and DIANA TOOLS were integrated into the Cytoscape 3.7.1 and exported "hsa_circ_0087354/hsa-miR-199-3p/SLC7A11" interaction network. (B) Starbase showed the predicted binding sites of hsa_circ_0087354 with hsa-miR-199-3p and Targetscan showed the predicted binding sites of SLC7A11 with hsa-miR-199-3p
2.3 hsa_circ_0087354靶向抑制hsa-miR-199-3p,促进SLC7A11表达显著上调
circRNA可以在表观遗传、转录和转录后调控的不同水平进行功能调控。为了明确hsa_circ_0087354调控细胞氧化还原状态的作用机制,本研究采用LipofectamineTM2000将ctrl质粒和hsa_circ_0087354质粒瞬时转染MG-63细胞,24 h后进行下游基因的RT-qPCR检测。结果显示,相对于ctrl 组的Nrf2(3.11±0.12)和SLC7A11(1.00±0.08)以及hsa-miR-199a-3p(1.11±0.38)和hsa-miR-199b-3p(1.49±0.39)的基因表达,hsa_circ_0087354组的Nrf2(22.43±2.16)和SLC7A11(1.22±0.06)表达显著上调(P<0.05);而hsa-miR-199a-3p(0.01±0.00)和hsa-miR-199b-3p(0.01±0.00)的表达量均显著下调(P<0.01)。表明hsa_circ_0087354可能吸附hsa-miR-199-3p,调节SLC7A11基因表达(Fig. 3A)。

Fig.3 Hsa-circ-0087354 promoted expression of SLC7A11 by sponging hsa-miR-199-3p (A) After hsa_circ_0087354 transiently transfected in MG-63 cells, the mRNA expressions of hsa-miR-199a-3p, hsa-miR-199b-3p, Nrf2 and SLC7A11 were detected by RT-qPCR. (B) Groups by hsa_circ_0087354-WT+hsa-miR-NC mimics, hsa_circ_0087354-WT+hsa-miR-199-3p mimics, hsa_circ_0087354-MUT+hsa-miR-NC mimics and hsa_circ_0087354-MUT+hsa-miR-199-3p mimics were used for cotransfection and luciferase activity was detected. Values are the mean ±SD of three determinations from separate experiments.* means P<0.05;**means P<0.01; *** means P<0.001
为了进一步确认基因的靶向调控关系,进行双荧光素酶报告检测,在萤火虫荧光素酶后面插入hsa_circ_0087354的3′ UTR序列,构建hsa_circ_0087354野生型和突变型载体,合成hsa-miR-199-3p和hsa-miR-NC mimics,按hsa_circ_0087354-WT+hsa-miR-NC mimics、hsa_circ_0087354-WT+hsa-miR-199-3p mimics、hsa_circ_0087354-MUT+hsa-miR-NC mimics及hsa_circ_0087354-MUT+hsa-miR-199-3p mimics分组进行共转染实验。由于hsa_circ_0087354中的结合序列对荧光值的影响较大,导致在hsa_circ_0087354-MUT型中两组荧光素酶活性比在hsa_circ_0087354-WT型中均显著升高。但是在hsa_circ_0087354-WT型中,hsa-miR-199-3p组(6.39±0.44)的荧光素酶活性明显比hsa-miR-NC组(7.44±0.16)降低(P<0.01),而在hsa_circ_0087354-MUT型中,hsa-miR-199-3p组(8.32±0.39)和hsa-miR-NC组(8.72±0.05)荧光素酶活性无明显差异(P>0.05)(Fig. 3B),证实hsa_circ_0087354与hsa-miR-199-3p之间存在靶向调节关系。
2.4 hsa-miR-199-3p靶向抑制SLC7A11的表达
为验证hsa-miR-199-3p的功能及作用机制,合成hsa-miR-199a-3p、hsa-miR-199b-3p mimics和hsa-miR-NC mimics,瞬时转染进入MG-63细胞内。RT-qPCR结果表明,hsa-miR-199a-3p mimics组中SLC7A11(1.33±0.15)和Nrf2(0.60±0.04)的相对表达量比hsa-miR-NC mimics组的SLC7A11(2.66±0.10)和Nrf2(0.80±0.04)的相对表达量均显著降低(P<0.01)。SLC7A11的表达在hsa-miR-199b-3p mimics组(1.27±0.10)比hsa-miR-NC mimics组(8.04±0.62)显著下调(P<0.0001),而Nrf2表达在hsa-miR-199b-3p mimics组(0.78±0.054)与hsa-miR-NC mimics组(8.04±0.62)相比无显著差异(P>0.05, Fig. 4A)。另外,发现细胞瞬时转染hsa-miR-199-3p mimics时,相比于hsa-miR-NC mimics组的GSH浓度(5.31±0.10)以及SOD(2.28±0.02)和GPx活性(29.51±0.39),在hsa-miR-199a-3p mimics组中,氧化应激的细胞内GSH浓度(3.02±0.27)以及SOD(1.82±0.06)和GPx活性(27.86±0.10)和hsa-miR-199b-3p mimics组中的应激后的细胞内GSH浓度(4.43±0.05)以及SOD(1.62±0.02)和GPx活性(25.44±0.19)均显著降低(P<0.01, Fig. 4B)。CCK-8试验表明,过表达hsa-miR-199a-3p和hsa-miR-199b-3p后,细胞增殖能力降低(P<0.05, Fig. 4C)。结果表明,hsa-miR-199-3p可能通过SLC7A11调控氧化应激细胞增殖及氧化还原状态。
为验证hsa-miR-199-3p与SLC7A11之间的靶向调控关系,在萤火虫荧光素酶的后面插入SLC7A11的3′ UTR序列,构建SLC7A11野生型和突变型载体,合成hsa-miR-199-3p和hsa-miR-NC mimics,以SLC7A11-WT+hsa-miR-NC mimics、SLC7A11-WT+hsa-miR-199-3p mimics、SLC7A11-MUT+hsa-miR-NC mimics及SLC7A11-MUT+hsa-miR-199-3p mimics分组,进行共转染实验。由于SLC7A11中的结合序列对荧光值的影响较大,导致在SLC7A11-MUT型中两组荧光素酶活性比在SLC7A11-WT型中均明显降低,但是在SLC7A11-WT型中,hsa-miR-199-3p组(6.26±0.74)的荧光素酶活性明显比hsa-miR-NC组(8.04±0.62)降低(P<0.01),而在SLC7A11-MUT型中,hsa-miR-199-3p组(6.41±0.39)的荧光素酶活性明显比hsa-miR-NC组(4.47±0.24)高(P<0.001, Fig. 4D),证实hsa-miR-199-3p与SLC7A11之间存在靶向调控关系。
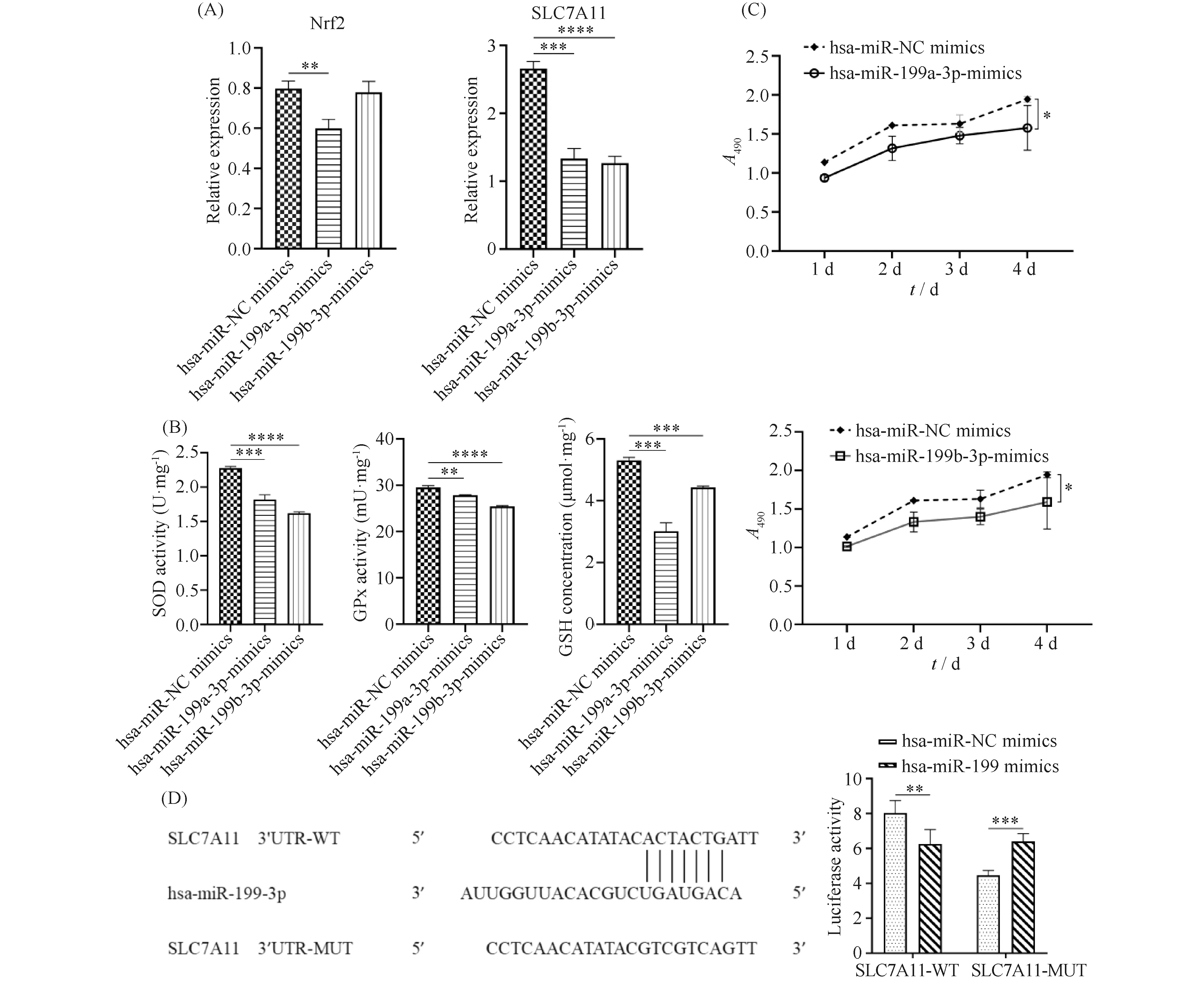
Fig.4 Function and mechanism of hsa-miR-199-3p (A) After hsa-miR-199a-3p or hsa-miR-199b-3p were transiently transfected in MG-63 cells, the mRNA expressions of Nrf2 and SLC7A11 were detected by RT-qPCR. (B) After overexpression of hsa-miR-199a-3p and hsa-miR-199b-3p in MG-63 cells, the expression levels of GSH, SOD and GPx were detected. (C) The CCK-8 assay was used to evaluate the proliferation of MG-63 cells with hsa-miR-199a-3p, hsa-miR-199b-3p overexpression 24-96 hours post transfection. (D) Groups by SLC7A11-WT+hsa-miR-NC mimics, SLC7A11-WT+hsa-miR-199-3p mimic, SLC7A11-MUT+hsa-miR-NC mimics and SLC7A11-MUT+hsa-miR-199-3p mimics were used for cotransfection and luciferase activity was detected. Values are the mean ±SD of three determinations from separate experiments.* means P<0.05,** means P<0.01,*** means P<0.001,**** means P<0.0001
3 讨论
研究报道,circRNA产生于细胞核,经过特定的剪切修饰形成环状RNA出核,在胞质中参与细胞生长、分化以及衰老等过程[16],在表观遗传、转录和转录后水平发挥调控作用[17]。circRNA可作为竞争内源性RNA (competing endogenous RNAs, ceRNA)与miRNA结合形成海绵吸附体,影响后者调控靶基因的表达,抑制翻译或mRNA降解[18]。近年来,越来越多的研究表明,circRNA与氧化应激密切相关。例如,circNCX1、circNFIX、circRNA_000203及circRNA_010567在缺血性心肌病中的研究[19-22],circHIPK3和cZNF609在调节血管内皮功能的作用[23, 24],circ-PRKCB在肠缺血再灌注损伤中的作用[25]、circPRKCI在氧化应激下的神经元损伤作用[26]以及circRSU1通过调节氧化应激在骨关节炎进展中的新作用[27]等。SLC7A11是胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11,也称xCT,近年来受到学者广泛关注,但是对于调控SLC7A11的circRNA相关研究较为少见。
本研究以0.3 mmol/L H2O2构建氧化应激细胞模型,发现hsa_circ_0087354与细胞氧化还原状态密切相关。通过转染hsa_circ_0087354后,检测氧化应激的MG-63细胞内ROS1与SOD1基因表达、GPx和SOD酶活性以及GSH浓度,证实了hsa_circ_0087354具有降低细胞氧化应激作用。Starbase生物信息预测表明,hsa_circ_00087354的3′UTR存在hsa-miR-199-3p的结合位点。MiR-199是一个高度保守的miRNA家族,由miR-199a和miR-199b组成,成熟的miR-199在维持正常稳态和调节疾病发病机制中发挥关键作用[28]。此外,Targetscan预测提示,在SLC7A11的3′UTR存在hsa-miR-199-3p的结合位点[29-32]。SLC7A11主要参与氧化还原状态、铁死亡和细胞内信号转导调节。主要功能是介导细胞摄取胱氨酸,维持细胞内GSH水平;同时具有维持细胞胱氨酸和半胱氨酸的氧化还原平衡[33]。最后,通过双荧光素酶试验证实了hsa-miR-199-3p与hsa_circ_00087354和SLC7A11之间靶向调控关系。Hsa_circ_0087354作为ceRNA,与hsa-miR-199-3p形成海绵吸附体,调控靶基因SLC7A11的转录,促进SLC7A11的转录和翻译过程,使细胞内GSH生成增多(Fig. 5),从而消除细胞内积聚的ROS,降低MG-63细胞的氧化应激。
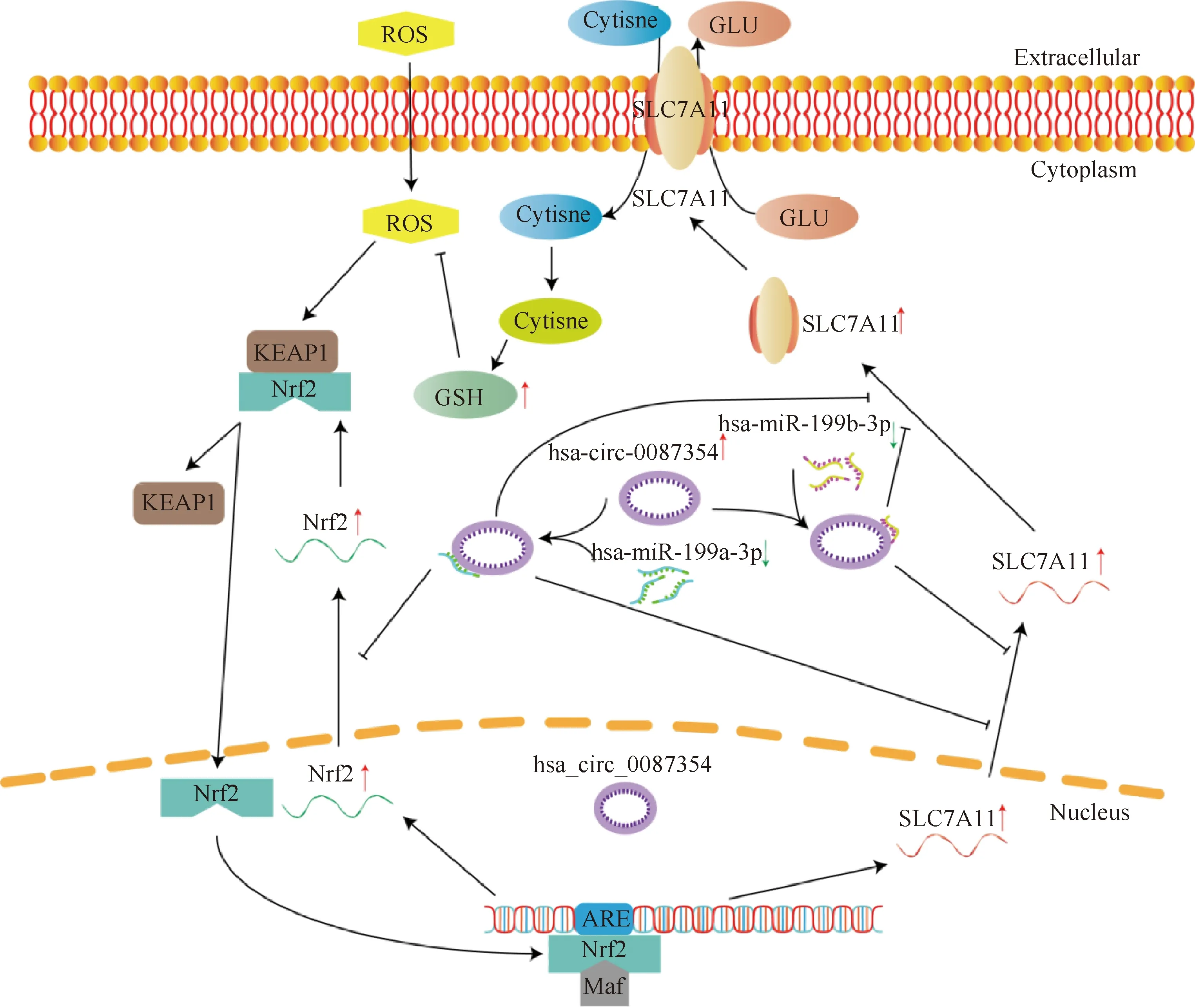
Fig.5 Graphical abstract of how hsa_circ_00087354 regulates redox state via SLC7A11 by sponging hsa-miR-199-3p in MG-63 cells The excessive ROS induced high expression of hsa_circ_0087354 in the nucleus. Hsa_circ_0087354 inhibited the transcription and translation of SLC7A11 by sponging hsa-miR-199-3p in cells, resulting in an increase in intracellular GSH concentration, eliminating excess ROS produced by the cell, and alleviating oxidative stress state of cells
此外,有证据表明,Nrf2是介导抗氧化反应的主要转录因子,调节SLC7A11的表达,进而影响GSH代谢[34]。氧化应激可诱导Kelch样ECH相关蛋白1(Kelch-like ECH-related protein 1,KEAP1)的半胱氨酸残基的氧化,降低KEAP1-Cullin3泛素连接酶复合物对Nrf2的降解;而后稳定的Nrf2转位到细胞核,与基因启动子区域的抗氧化反应元件(antioxidant response elements,ARE)结合,并调节一系列与抗氧化反应和细胞氧化还原维持相关的靶基因的转录,包括SLC7A11和SOD等相关基因[35, 36]。本研究发现,过表达hsa_circ_0087354和hsa-miR-199-3p后,SLC7A11的表达显著改变,同时在过表达hsa_circ_0087354和hsa-miR-199a-3p后,Nrf2的基因表达显著改变。但是,在过表达hsa-miR-199b-3p后,Nrf2的基因表达无明显变化,表明hsa-miR-199-3p的两种基因分型对Nrf2的调节可能存在更复杂的机制,这还有待进一步探究。
随着牙种植技术的不断进步及人们对牙体缺损修复要求的不断提高,牙种植修复已经成为目前临床上修复牙列缺失和牙体缺失首选的治疗方法之一。牙种植修复更加符合牙齿的生理形态与功能标准,达到更加舒适与美观的效果[37]。骨结合是牙种植修复成功的关键[38],因此足够的三维骨量以及适宜的骨密度,能够为种植体的短期成骨及远期成功率提供保障和支持。当前,种植修复的适应症在不断扩大,老年人、高血压、糖尿病、牙周炎患者已经不是牙种植手术的绝对禁忌症;而且其种植需求也在不断增加。但是这类患者体内处于氧化应激状态,导致其种植手术有更高的风险。已有研究表明,机体氧化还原状态与种植体骨结合密切相关[39]。也有研究发现,早期种植失败通常归因于创伤愈合不良,阻碍或阻止骨结合;晚期种植失败通常是由于咬合(生物力学)过载或种植体周围炎[40]。因此,氧化应激对于牙种植体的成功有重要影响。
本文的前期研究发现,在MG-63细胞氧化应激状态中,对可能发挥关键作用的hsa_circ_00087354进行了深入研究,通过构建过表达hsa_circ_0087354质粒和ctrl质粒脂质体瞬时转染的方法,明确hsa_circ_00087354在MG-63细胞中对于氧化应激相关基因及对细胞氧化还原功能的作用,并且通过RT-PCR以及双荧光素酶实验验证了hsa_circ_00087354通过与hsa-miR-199-3p竞争结合,作用于靶基因SLC7A11的作用途径。circRNA通过在转录、翻译、蛋白质修饰等多个层面调控多个下游基因的表达,抑制氧化应激的级联瀑布效应。本研究发现证实的hsa_circ_00087354对于MG-63细胞的作用及机制,有望通过精准靶向治疗以及牙种植体的表面修饰,促进种植体早期骨结合,提高氧化应激状态下种植体的短期成功率及远期效果,为牙种植体的广泛应用奠定理论基础。

