一种快速提取组织外泌体的分离富集方法
王建立, 张子怡, 秦伟伟, 王程程, 杨 瑞*
(1)农业应用新技术北京市重点实验室,北京农学院植物科学技术学院, 北京 102206;2)北京恩泽康泰生物科技有限公司, 北京 102206)
胞外囊泡是由不同细胞释放的脂质双层膜包被的颗粒,主要包括外泌体、微囊泡和凋亡小体[1,2]。外泌体大小30~150 nm,它们可以包裹和传递RNA和蛋白质等分子[3,4],作为细胞间通信的信使参与多种生理和病理途径[5]。目前,外泌体已成功地从血液[6,7]、尿液[8]、唾液[9]、卵泡液[10]和精液[11]等体液中分离,并已有较标准的鉴定方法,但是从组织细胞间隙中分离到外泌体的相关研究较少[12,13]。组织间隙的外泌体提取分离关键环节是剪切和酶解获得细胞悬液。这个过程会造成一定程度细胞结构的破坏,破裂的细胞会释放大量的脂质体、蛋白质复合体、DNA、RNA、细胞器或细胞碎片等,与体液相比极大地增加了外泌体纯化难度,而常规的体液外泌体分离方法,例如标准的超离很难得到高纯度的外泌体。
目前,采用的分离组织外泌体技术,例如免疫捕获法利用特异性抗体识别并分离外泌体,特异性高,但其价格昂贵,容易丢失抗原表达偏低的囊泡,且不适合处理大体积样本;蔗糖密度梯度离心法在消除细胞污染物方面非常有效,但该方法相对冗余耗时,需要技术人员熟练掌握密度梯度离心操作过程,不同批次或不同操作人员间提取富集的外泌体存在差异,造成提取的外泌体质量不稳定[14]。国内也有少量关于组织外泌体的研究。李冬等[15]公开了一种组织来源外泌体的提取方法,基于酶裂解组织后直接进行外泌体提取,但需要使用聚乙二醇过夜沉降,提取外泌体最少需要1.5 d,耗时较长,而且提取的外泌体中可能存在大量蛋白质杂质;乔鞠等[16]公开了一种软组织胞外囊泡的提取方法,软组织需要另外培养1~96 h后再进行胞外囊泡的提取,过程繁琐且耗时长。因此,亟需建立一种快速提取组织胞外囊泡的分离富集方法。
1 材料与方法
1.1 材料
试验材料包括小鼠心、肝、肾组织、人结肠癌组织、人乳腺癌组织和动脉粥样硬化组织。
所用试剂包括木瓜蛋白酶(Worthington-biochemical,LK003178),Earle’s平衡盐溶液(EBSS缓冲液),Hibernate E培养基,胶原蛋白酶D(上海罗氏制药有限公司,货号为11088858001),DNase I(上海罗氏制药有限公司,货号为4536282001),消化酶H、消化酶R和消化酶A的混合酶(天旎生物技术有限公司,货号为130-095-929),蛋白酶和磷酸酶抑制剂(赛默飞生物科技有限公司),PBS缓冲液,排阻色谱柱(北京恩泽康泰生物科技有限公司),Pierce BCA 蛋白质定量分析试剂盒(赛默飞生物科技有限公司,货号为23-225)。
1.2 组织解离方法的比较分析
分别使用木瓜蛋白酶,胶原蛋白酶+DNase I以及组织消化酶进行小鼠心组织的解离。通过检测外泌体粒度和钙连蛋白(calnexin)含量,评价外泌体提取质量。钙连蛋白是内质网膜上的一种蛋白质,其功能主要作为分子伴侣参与蛋白质新生肽链的折叠和加工等。使用其作为外泌体Western印迹分析的阴性蛋白质标志物,可用来鉴定细胞来源蛋白质污染程度。钙连蛋白含量越少说明细胞来源蛋白质污染程度越小。
1.2.1 木瓜蛋白酶解离实验 将木瓜蛋白酶用Earle’s平衡盐溶液(EBSS缓冲液)溶解,用量为15~30 U,再添加Hibernate E 培养基获得。其中,Earle’s平衡盐溶液与Hibernate E培养基的体积比为1∶3,木瓜蛋白酶溶液的用量为3 mL。
1.2.2 胶原蛋白酶D和DNase I解离实验 胶原蛋白酶D和DNase I用Earle’s平衡盐溶液(EBSS缓冲液)溶解,再添加Hibernate E培养基,Earle’s平衡盐溶液与Hibernate E培养基的体积比为1∶3,胶原蛋白酶D终浓度为24 mg/mL,用量为0.5 mL,DNase I 终浓度为2 000 U/mL,用量为0.2 mL。
1.2.3 组织消化酶解离实验 组织消化酶是消化酶H、消化酶R和消化酶A的混合酶。将消化酶H、消化酶R和消化酶A分别按照说明书中的方法用DMEM平衡盐溶液溶解,再将消化酶H、R和A的DMEM平衡盐溶液按体积4∶2∶1体积比混合。
1.3 不同组织外泌体富集方法
本文对小鼠心、肝和肾组织,人结肠癌组织、乳腺癌组织和动脉粥样硬化组织外泌体的富集方法进行研究。因不同组织结构特性的差异,其步骤差异如Table 1。
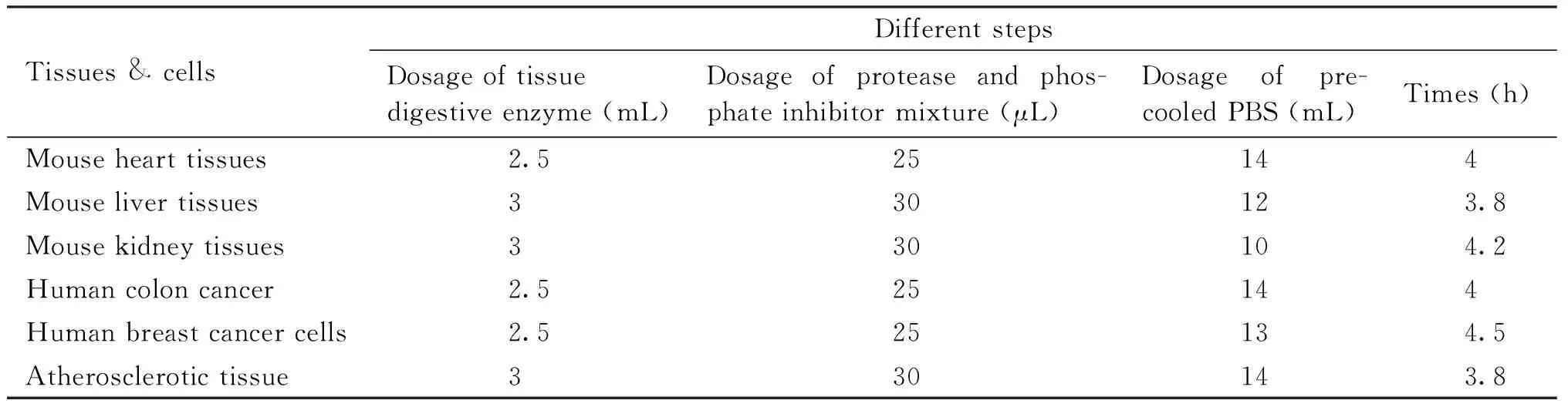
Table 1 Comparison of various tissue samples
本研究构建的外泌体富集提取法主要步骤包括:将低温冷冻(-80 ℃)的组织,用刀片切成1~2 mm3大小的组织切片,并转移到含有1.5~4 mL(优选2~3 mL)组织消化酶解离液的离心管中。其中,组织消化酶的配制同1.2.3;将上述混合物放入37 ℃水浴,每隔5 min混合1次,解离时间为30 min。再用70 μm滤膜过滤上述组织解离液到新的离心管中,获得组织细胞悬液,继而添加20~40 μL蛋白酶和磷酸酶抑制剂混合物。于4 ℃,300~600 g离心10 min,收集上清液,并将其转移到新的离心管中。4 ℃,2 000~3 000 g离心10 min。收集上清液,继续将其转移到新的离心管中。4 ℃,10 000~12 000 g离心10 min,收集上清液,用0.22 μm滤膜过滤到超离管中,加入预冷的PBS至总体积10~18 mL。2~8 ℃,100 000~150 000 g超离1.5~2.5 h(优选4 ℃超离2 h)。将超离管中的沉淀用1 mL PBS溶解,获得初步纯化的组织外泌体悬液;之后,将所得外泌体悬液加入到排阻柱中,待液体流尽,加入2.5 mL PBS。与此同时,开始收集流出液,将流出液转移到超滤管中。4 ℃,3 000~5 000 g离心1~5 min,留取截留液200~500 μL,即为高纯度外泌体。
1.4 蛋白质质量检测、透射电子显微镜观察、纳米粒径和蛋白质印迹分析
1.4.1 蛋白质质量检测 将10 μL样品加入到96孔板中,并加入200 μL BCA溶液。在37 ℃下,孵育30 min。设置平板阅读器吸光度562 nm,用标准曲线测量每个待测样品的蛋白质浓度。不同稀释倍数的样品溶液重复3次。
1.4.2 透射电子显微镜观察 将10 μL外泌体悬液滴至铜网中。室温下,孵育10 min后,用无菌蒸馏水清洗。然后,用醋酸双氧铀负染1 min,并在白炽灯下干燥2 min。最后,用透射电子显微镜(H7650)进行观察并拍照。
1.4.3 纳米粒径分析 通过纳米颗粒追踪分析仪(Zeta View PMX 110)对1×107/mL至1×109/mL颗粒浓度的外泌体溶液进行尺寸和颗粒浓度检测。在波长为405 nm的激发光波下,以30帧/s的帧速率拍摄一段60 s的视频,并使用NTA软件(Zeta View 8.02.28)分析粒子运动轨迹,从而获得外泌体的尺寸和浓度。
1.4.4 Western印迹 分析通过特异性抗体对凝胶电泳处理过的小鼠肝组织外泌体样本进行着色。在自动化学发光图像分析系统(Tanon4600)中对蛋白质检测结果进行可视化,并分析着色的位置和深度获得外泌体的阳性蛋白质标志物CD9、TSG101、ALIX和CD63和外泌体阴性蛋白质标志物钙连蛋白的表达情况。CD9和CD63是外泌体跨膜蛋白家族成员,直接参与了外泌体的分泌,TSG101(Tumor Susceptibility 101)是与外泌体释放结构ESCRT复合体有关的蛋白质,ALG2相互作用蛋白ALIX,涉及到了泡膜在形成过程中切割脱离质膜形成独立膜结构的过程,它们均可以作为外泌体Western印迹分析的阳性蛋白质标志物,可用来评价外泌体的纯度和质量。
2 结果
2.1 组织消化酶解离提取的外泌体质量更佳
小鼠心组织的质量和BCA蛋白质总量见Table 2。表中显示,优化后的酶解方法提取蛋白质含量更多。通常,外泌体粒径范围介于30~150 nm之间,在此范围内的外泌体质量较好。通过不同相关酶对小鼠心组织进行解离,所得到的外泌体粒径范围为30~150 nm,并可以明显观察到组织消化酶(Fig.1C)提取的外泌体粒径主峰范围在80~150 nm之间,外泌体质量较好,而木瓜蛋白酶和胶原蛋白酶D和DNase I(Fig.1A,B)提取外泌体的粒径主峰范围在100~300 nm之间,多数为非外泌体,因此外泌体质量相对较差。

Table 2 The BCA protein of exosomes of enzymes related to the optimization of enzymatic hydrolysis process
CK为小鼠细胞裂解物,通过不同相关酶对小鼠心组织进行解离,所得到的外泌体污染程度有所不同,组织消化酶提取的外泌体中的钙连蛋白几乎检测不到(Fig.2C),因此组织消化酶的细胞来源蛋白质污染程度相对较小,其次是木瓜蛋白酶的外泌体钙连蛋白依稀可见,胶原蛋白酶D和DNase I(Fig.1A,B)提取的外泌体钙连蛋白污染程度最大。
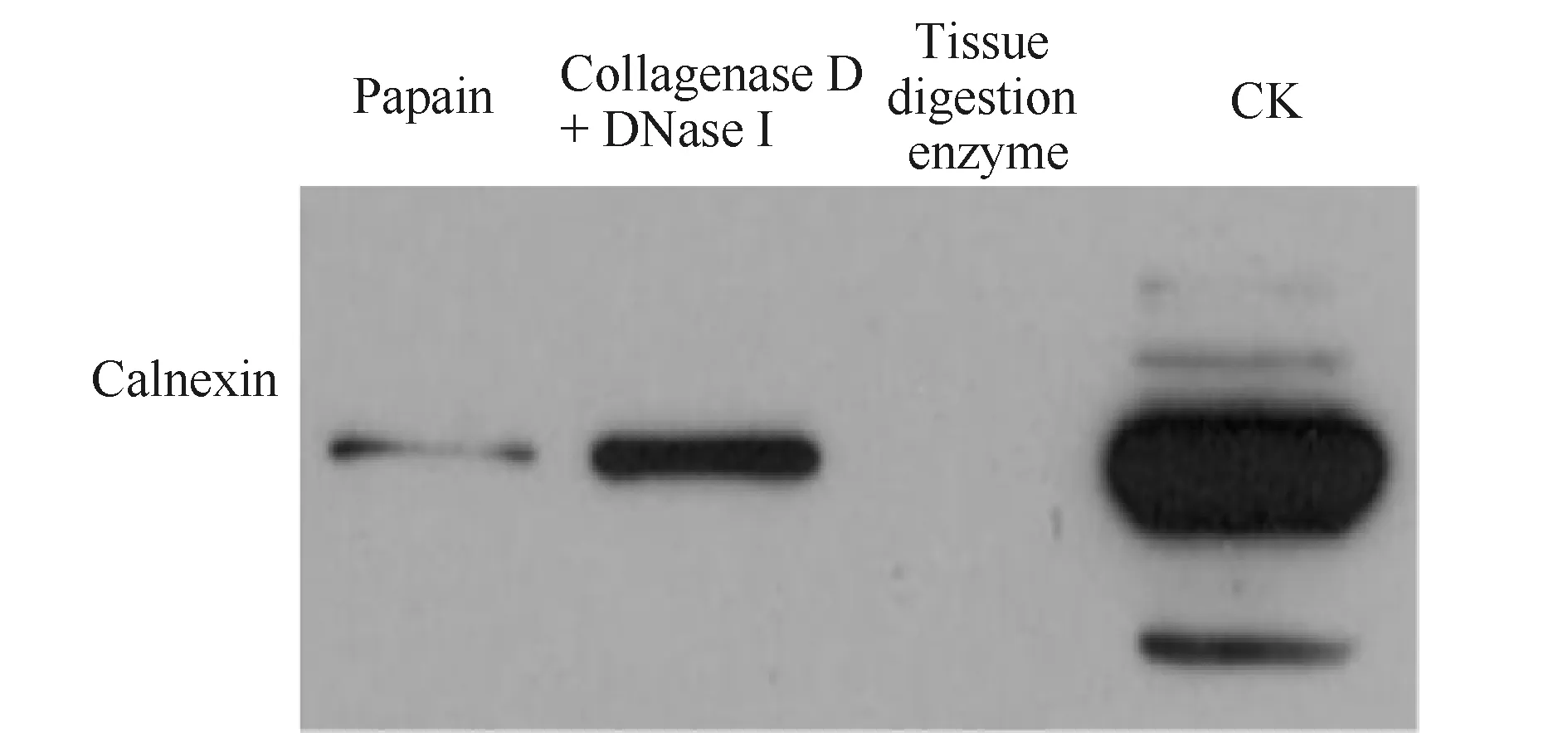
Fig.2 Proteomic expression on basis of Western blot depicted negative expression Calnexin of exosome that isolated through various tissue dissociation techniques (A) Calnexin expression after papain. (B) Calnexin expression after collagenase D and DNase I extraction. (C) Calnexin expression after enzymatic treatment for extraction
2.2 采用本方法富集的不同组织的外泌体质量更高
2.2.1 不同组织外泌体粒径均在外泌体粒径范围内 将不同组织外泌体的NTA数据汇总在Table 3 中。显示这些外泌体的粒径均介于30~150 nm之间,符合外泌体正常的粒径范围,属于质量较好的外泌体。
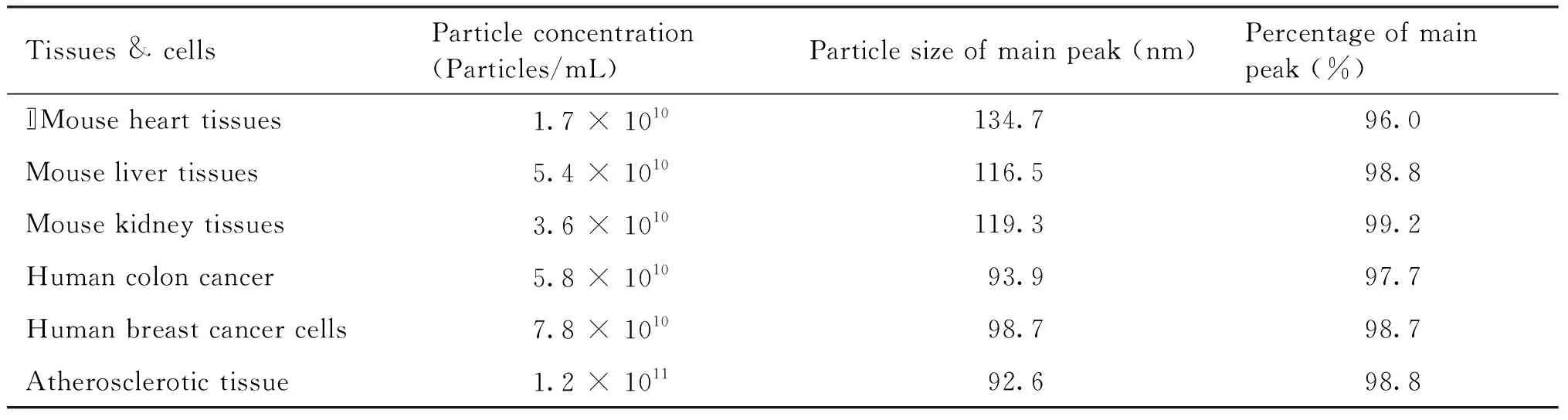
Table 3 NTA results of exosomes from various tissues
2.2.2 不同组织外泌体结构均清晰 透射电子显微镜下观察结果(见Fig.4)显示,各组织外泌体呈茶托状结构,均清晰可见,粒径均与NTA结果吻合,颗粒直径在100 nm左右。同时,在可观察的视野中,各组织之间所提取的外泌体数量无明显差异,结果趋于一致,说明该提取方法满足了大多数组织所提取的外泌体的后续实验。
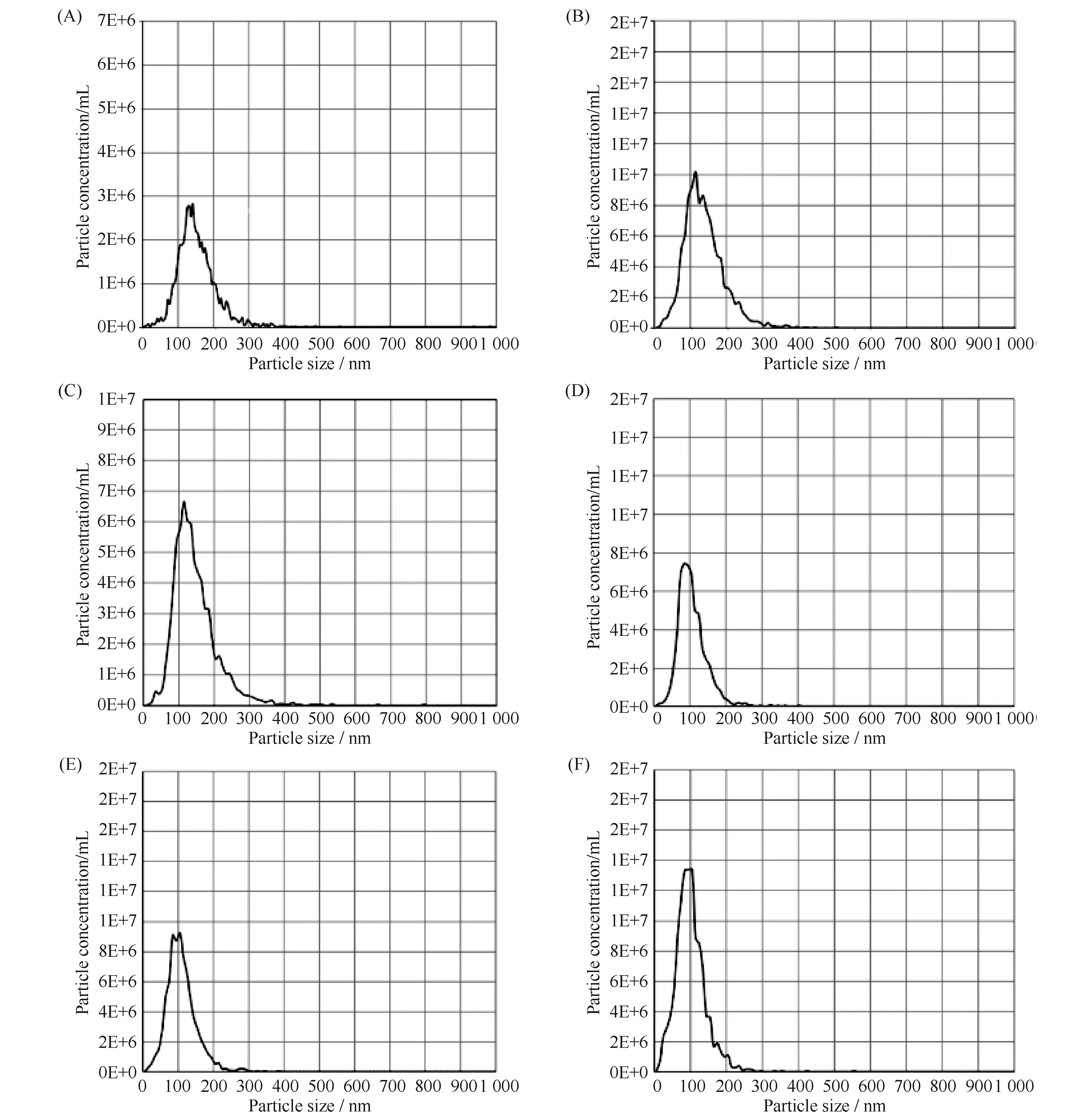
Fig.3 Exosome particle size distribution in various tissues samples (A ) Exosome particle size distribution in mouse cardiac tissues. (B) Exosome particle size distribution in mouse liver tissues. (C) Exosome particle size distribution in mouse kidney tissues. (D) Exosome particle size distribution in human colon cancerous tissue. (E) Exosome particle size distribution in human breast cancer cells. (F) Exosome particle size distribution in atherosclerotic tissue. Typical range of exosome particle sizes from 30 nm to 150 nm. The higher the concentration of exosomes in this range, the better the quality
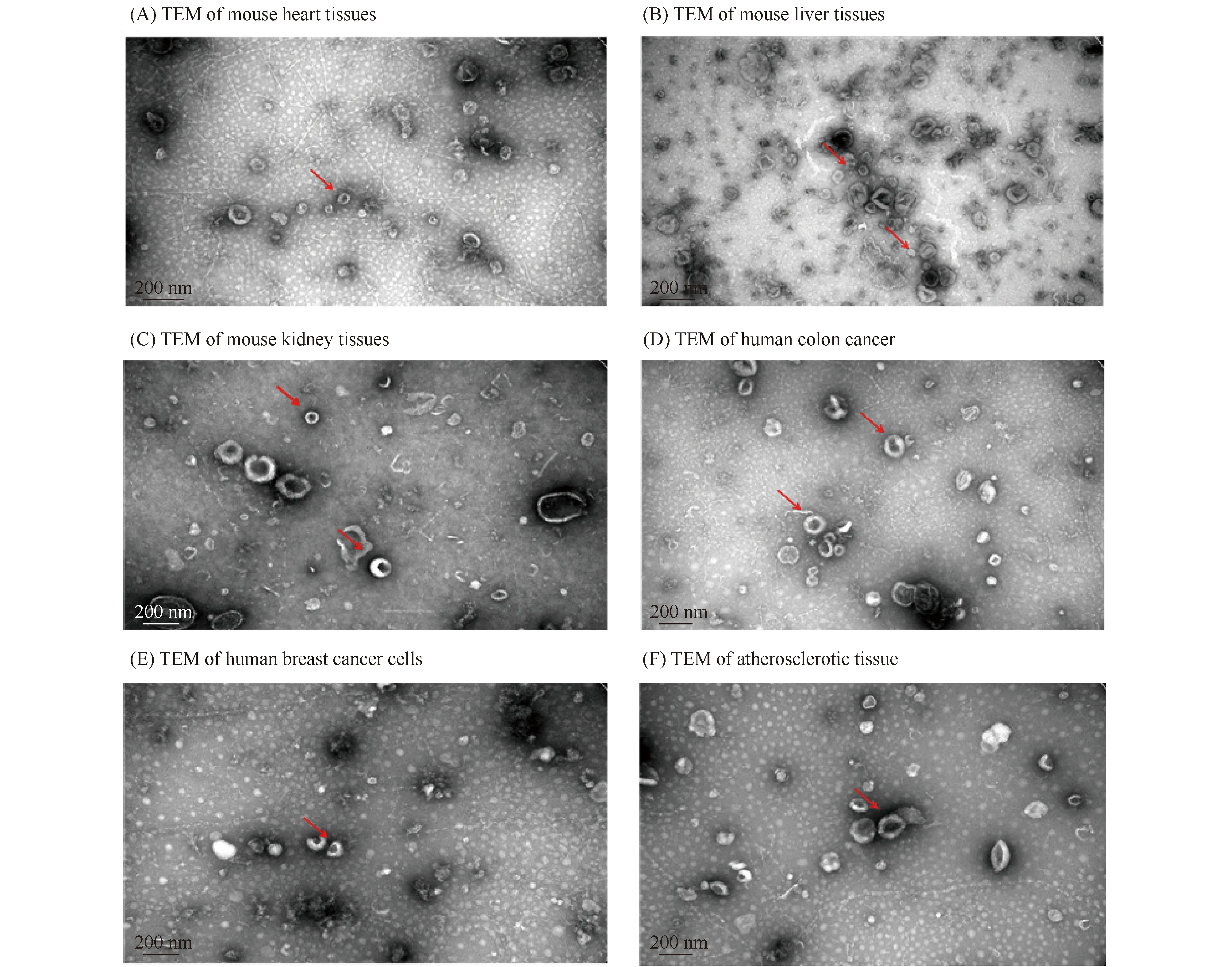
Fig.4 TEM images of exosomes from diverse tissues TEM pictures of exosomes from various tissue depicted complete structure of exosome that are clearly evident, scale bar is 200 nm
2.2.3 小鼠肝组织外泌体无污染 小鼠肝组织外泌体的Western 印迹检测结果(见Fig.5)表明,图中清晰可见阳性蛋白质标志物CD9、ALIX和CD63的表达,TSG101弱表达,阴性蛋白质标志物钙连蛋白无表达,富集得到的小鼠肝组织外泌体无污染,质量高。
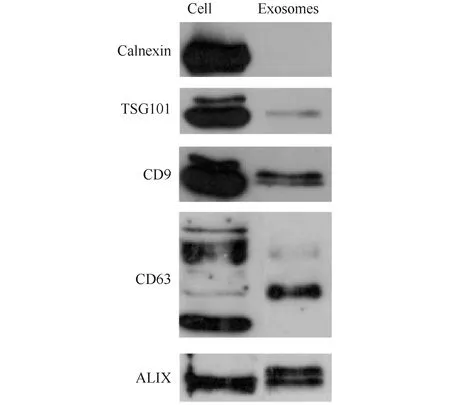
Fig.5 Proteomic expression exosomes in mouse liver The expression of positive and negative protein markers were analyzed with Western blotting in mouse liver exosomes. The weak expression of negative protein and high expression of positive protein indicated the high quality of exosomes. The higher the concentration of exosomes in this range, the better the quality
3 讨论
近年来,国内外众多学者越来越重视对外泌体的研究。组织细胞悬液的获得是快速富集外泌体的基础。根据酶解工艺优化实验结果中可得出,本文提供的组织消化酶的酶解方案能获得的外泌体,质量好且结构更加清晰,大多数粒径范围符合外泌体的特征。目前,通常使用超速离心法、蔗糖梯度离心法、超滤法、尺寸排阻液相色谱法、免疫亲和珠分离法、ExoQuick提取法等实现对外泌体的富集[17],也有采用微流芯片等新技术成功分离并检测出外泌体[18]。但研究多基于血液、唾液和尿液等体液中。组织间隙中外泌体的分离更容易受到杂质的影响。
邱金戈等[19]对比指出了以上几种方法的缺点,例如超速离心法可能会破坏外泌体结构,ExoQuick提取法耗时长、且易污染等。本文提供了一种新的方法,即将差速离心、超离、SEC排阻和超滤几种方法依次使用。在透射电镜观察中,均能看出外泌体茶托状结构,且结构清晰无损伤;NTA粒径分析,几种组织的粒径完全符合外泌体的生物学特性,且与透射电镜观察结果吻合;对小鼠肝组织进行Western印迹结果分析,发现外泌体标记蛋白质CD9、ALIX、CD63、TSG101等[20],均有不同程度的表达,提取物中外泌体的含量高,而为内质网蛋白标志物钙连蛋白无表达,表明提取物中杂质含量少。而且几种组织的外泌体富集实验时间都在4.5 h之内,操作简单方便,使用微量组织样本富集的外泌体即可满足后续NTA、Western印迹、电镜和转录物组等分析。同时,组织外泌体分离富集可用于筛选疾病标志物或进行细胞增殖、凋亡侵袭、转移等后续研究,进一步挖掘疾病的信号通路机制,对疾病的鉴别诊断、预后复发监控、靶向载药治疗等具有重要意义。

