常见致病菌糖基转移酶的结构与功能
牛静丽, 张楠楠, 葛宏华
(安徽大学生命科学学院生物制药系,安徽大学物质科学与信息技术研究院健康科学与技术研究所, 合肥 230601)
致病菌广泛存在于自然界的土壤、空气和水源中,人接触到受污染的环境很容易被感染。致病菌通过类似于真核生物的翻译后修饰,例如泛素化、磷酸化、甲基化和糖基化等来调控宿主细胞[1]。其中,糖基转移酶催化的糖基化这类翻译后修饰与病原菌的毒力和侵染能力密切相关,已成为近10年来研究的热点。糖基转移酶(glycosyltransferases,GTs)将糖基从活化的供体上转移到糖、脂、蛋白质和核酸等受体上,在所有生物体中行使着重要的生物功能。糖基转移酶对蛋白质的糖基化是最常见的翻译后修饰(post-translational modifications,PTMs)之一,致病菌中糖基转移酶对蛋白质的糖基化与其毒力密切相关[2]。目前,已在铜绿假单胞菌(Pseudomonasaeruginosa)、脑膜炎奈瑟菌(Neisseriameningitides)、流感嗜血杆菌(Haemophilusinfluenzae)、空肠弯曲杆菌(Campylobacterjejuni)、结核分枝杆菌(Mycobacteriumtuberculosis)、副血链球菌(Streptococcusparasanguis)、弥散黏附性大肠杆菌(diffusely adheringEscherichiacoli,DAEC)和产肠毒素大肠杆菌(enterotoxigenicE.coli,ETEC)中发现具有毒力作用的糖基转移酶[3],它们可以促进致病菌黏附宿主细胞,或糖基化宿主蛋白质影响宿主的基因转录翻译、信号转导和免疫应答等重要的生物学功能。
碳水化合物活性酶数据库(carbohydrate-active enzyme,CAZy)(http://www.cazy.org)根据氨基酸序列相似性,将70多万个糖基转移酶分为110多个家族以GTx表示,例如GT1,还有接近2万个糖基转移酶未被分类。同时,该数据库将以核苷单磷酸糖(例如CMP-N-乙酰神经氨酸)、核苷二磷酸糖(例如UDP-半乳糖,GDP-甘露糖)等磷酸糖类作为活化糖基供体的糖基转移酶编号为EC 2.4.1.x。由于糖基受体种类的复杂性,目前分类已从EC 2.4.1.1到EC 2.4.1.374。虽然糖基转移酶数量庞大、种类繁多、分布广泛和功能多样,但其结构具有保守性。目前,已鉴定的糖基转移酶,根据其蛋白质三维结构特征分为GT-A、GT-B和GT-C三种类型,其中常见的是GT-A和GT-B型[4]。本文将简述糖基转移酶三种折叠类型的结构特点,以及常见致病菌中具有毒力作用糖基转移酶的致病机制,这将为预防致病菌感染和致病菌感染后的靶向治疗提供新思路。由于综述的重点和篇幅所限,本文详细介绍了具有确切功能且表征良好的糖基化系统。
1 糖基转移酶结构
目前,CAZy数据库有300多个糖基转移酶结构。其中,200多个属于GTx家族,5个目前未被分类,该数据库仍在不断更新中。根据结构折叠类型,将其分为GT-A、GT-B和GT-C三种。
GT-A类型的结构以β-折叠(β-sheet)为核心,由2个大小不同紧密关联的β/α/β Rossmann结构域形成,具有底物核苷酸结合位点和受体结合位点。其发挥活性需要二价阳离子(Mn2+、Mg2+)。这些离子的存在能中和核苷酸磷酸的表面负电荷,辅助UDP与糖分子之间的键断裂后离开活性中心,结合二价阳离子为保守DXD(X是任意氨基酸)基序中的天冬氨酸。值得注意的是,许多序列具有DXD特征但不是糖基转移酶[5,6]。最先解析属于GT-A型的结构为枯草芽孢杆菌(Bacillussubtilus)中糖基转移酶SpsA[7](Fig.1A)。
GT-B类型的结构由2个独立面对面的β/α/β Rossmann结构域组成,其活性位点位于2个Rossmann结构域之间的沟槽中。与GT-A相比,GT-B折叠活性不依赖金属离子,未见类似DXD保守的氨基酸序列,主要依靠环形(loop)区的谷氨酸和甘氨酸与核苷酸供体的核糖和磷酸相互作用。GT-B型的结构C-端核苷酸结合结构域有极好的保守性,N-端活性位点结构域多变,有助于识别不同的受体[8]。第1个确定为GT-B型的结构为T4噬菌体β-葡萄糖基转移酶[9](Fig.1B)。
GT-C类型的糖基转移酶以脂质磷酸活化的糖为供体底物,位于内质网或质膜上,由8至13个螺旋的跨膜结构域和周质结构域(periplasmic domain)组成,其活性位点位于周质空间结构域中[10]。在CAZy数据库中,有10个家族为GT-C型,目前解析了15个结构,对GT-C折叠8个家族的糖基转移酶进行序列分析,发现GT-C第1个跨膜结构后的环形区具有与GT-A中DXD(X是任意氨基酸)基序同源性较高的EXD、DXE、DDX或DEX特征序列[8]。将GT-C中保守DXD基序的天冬氨酸突变为丙氨酸其糖基转移酶活性消失,但目前仍不清楚GT-C中的DXD基序是否结合金属离子,与GT-A中的DXD基序是否为共起源[11]。Campylobacterlari的PglB是致病菌中目前唯一获得GT-C型的全长蛋白质结构,包含13个跨膜螺旋[12](Fig.1C)。

Fig.1 Overall folds observed for glycosyltransferase enzymes (A) The GT-A fold is represented by the inverting enzyme SpsA from Bacillus subtilus, Protein Data Bank (PDB) code 1QGQ, and (B) the GT-B fold, bybacteriophage T4 β-glucosyltransferase, PBD code 1JG7,(C) the GT-C fold, by Campylobacter lari, PBD code 3RCE
2 糖基转移酶介导致病菌黏附宿主细胞
介导致病菌黏附宿主细胞这一感染初始过程的糖基转移酶为GT-B或GT-C型,黏附是致病菌向宿主分泌效应蛋白质,发挥毒力作用的关键。
常见的侵入性致病菌不可分型流感嗜血杆菌(nontypeableH.influenzae,NTHi),感染宿主可引发中耳炎、慢性支气管炎和获得性肺炎等[13,14],这种感染主要依靠NTHi中2种糖基化的高分子量(high molecular weight,HMW)黏附蛋白HMW1和HMW2靶向黏附于呼吸道上皮细胞[15]。HMW1/2在细胞质合成后由糖基转移酶HMW1C/2C将其糖基化,然后由位于外膜上的HMW1B/HMW2B转运至NTHi表面(Table1),这种由2个蛋白质参与的分泌系统称为双伴侣分泌(two-partner-secretion,TPS)系统[16]。HMW1C不仅可以催化单己糖或二己糖与黏附蛋白HMW1 Asn-X-Ser/Thr(X为除Pro外的任意氨基酸)序列中的天冬酰胺之间形成N-糖苷键,还能催化连接的2个己糖之间形成O-糖苷键[17]。NTHi糖基化的HMW黏附蛋白介导致病菌与宿主相互作用这一类发病机制,还存在于ETEC、耶尔森氏菌(Yersinia)和伯克霍尔德氏菌(Burkholderiaspp)。它们具有属于TPS系统且与HMW1C序列同源的糖基转移酶,例如ETEC中的糖基转移酶EtpC糖基化黏附素EtpA,促进ETEC黏附于肠上皮细胞[18]。另一类与HMW1C序列同源但不属于TPS系统的糖基转移酶被称为HMW1C-like,可以糖基化细菌表面蛋白质,例如胸膜肺炎放线杆菌(Actinobacilluspleuropneumonia)中结构为GT-B型的ApHMW1C,它可以糖基化细菌表面蛋白质和外膜蛋白质[19]。HMW1C-like如何发挥活性以及怎样介导致病菌与宿主的相互作用是未来研究的热点。
除了TPS系统分泌黏附蛋白质外,一些革兰氏阳性共生细菌中发现了另外一类细菌表面保守的黏附蛋白家族-富丝氨酸重复蛋白质(serine-rich repeat proteins,SRRPs)。糖基化的该蛋白质是细菌聚集和生物膜形成的关键[20,21]。SRRP由N-端信号肽区、非重复区(non-repeat region,NR)、2个富丝氨酸区(serine-rich region1/2,SRR1/2)和C-端细胞壁锚定区组成[22]。SRRP的生物合成由多基因组成的基因簇或致病岛调控,其编码2个高度保守的糖基转移酶Gtfl/2形成四聚体复合物,使SRR1/2的丝氨酸完成第一次关键的糖基化修饰,Gtfl/2四聚体活性位点位于结构为GT-B型的Gtf1中,Gtf2提供底物结合位点[23]。糖基化的SRRP由其他糖基转移酶对其糖链进行修饰和延伸,成熟的SRRP被转运至细菌细胞壁上,穿过荚膜暴露于细菌表面[24],促进致病菌黏附宿主细胞发挥毒力作用。第1个鉴定出来的SRRP是副血链球菌FW213(S.parasanguinisFW213)中的黏附蛋白Fap1(fimbriae-associated protein 1),介导副血链球菌定殖于牙齿表面,为其他口腔链球菌的附着提供基础,形成复杂的生物膜牙菌斑[25]。位于fap1基因座下游基因簇编码的糖基转移酶Gtf1/2复合物使Fap1完成第,1次糖基化[26],之后结构为GT-B型的Gtf3(Table1)第2次糖基化Fap1。编码糖基转移酶的基因突变不能产生成熟的Fap1,影响其定位和生物功能的发挥[27]。此外,糖基化的SRRPs促进多种致病菌感染宿主,例如B组链球菌(group BStreptococcus)糖基化的SRRP,有助于其黏附、侵入人脑微血管内皮细胞和穿透血脑屏障引发脑膜炎[28]。富含丝氨酸的糖蛋白SrpA介导血链球菌(Streptococcussanguinis)与人血小板的结合,引起感染性心内膜炎[29]。越来越多的致病菌中鉴定出SRRPs糖蛋白质,SRRP的NR结构域从致病菌表面突出,介导其黏附和聚集,但SRR糖基化的确切功能未知[30],这也是未来研究的重点。对糖基化SRRP的相关糖基转移酶结构和功能的研究,有望为预防和治疗革兰氏阳性致病菌感染疫苗和新型药物的开发提供理论基础。
一类广泛存在于革兰氏阴性致病菌的细菌自转运蛋白庚糖基转移酶(bacterial autotransporter heptosyltransferase,BAHT),以脂多糖(lipopolysaccharide,LPS)生物合成途径中产生的ADP庚糖为糖供体糖基化自转运蛋白质。糖基化的自转运蛋白质转运至细菌表面黏附宿主细胞,表现出毒力功能[31]。在致病菌同一操纵子中编码BAHT的基因先于其底物自转运蛋白质基因的表达,自转运蛋白质由N-端信号肽、具有生理功能糖基化的乘客区域和C-端结构域组成[32]。最早鉴定出的自转运蛋白质为DAEC 2787中的AIDA-I和ETEC H10407中的TibA,分别被BAHT家族的AAH和TibC庚糖基化[33,34]。BAHT的结构由N-端β-桶状结构域、催化结构域、β-发夹结构和1个独特的铁指基序组成。其中,催化结构域与GT-B型类似,只是插入了β-发夹结构和铁指基序[35]。2个铁指基序以背对背的方式形成二聚体,6个对称二聚体通过β-发夹结构连接在一起,形成环状的十二聚体复合物。在TibC12-TibA6酶-底物复合物结构中,2个背靠背的TibC二聚体分子与环内部的1个TibA结合(Table1),十二聚体的TibC可以同时使6个TibA进行高效超糖基化[36]。啮齿类柠檬酸杆菌(Citrobacterrodentium)有与TibA相似的自转运蛋白质CARC,其乘客结构域的丝氨酸被BAHT庚糖基化,使柠檬酸杆菌定殖于小鼠肠上皮细胞促进感染[37]。致病菌糖基转移酶靶向其自身毒力因子,特别是自转运蛋白质涉及的生化机制和相关蛋白质的结构是值得研究的。
上述介绍的参与致病菌黏附宿主细胞的糖基转移酶结构均为GT-B型。结构为GT-C型的糖基转移酶也可以促进细菌黏附宿主细胞,例如空肠弯曲杆菌的PglB。空肠弯曲杆菌是全世界细菌性胃肠炎的主要病因,其发病率甚至超过沙门氏菌(Salmonella)和志贺氏菌(Shigella)感染[38]。空肠弯曲杆菌毒力因子属于独特的N-连接的蛋白质糖基化(protein glycosylation,pgl)系统[39]。该系统催化七糖链偶联到自身靶蛋白质保守Asn-X-Ser/Thr(X为除Pro外的任意氨基酸)序列中的天冬酰胺[40],将空肠弯曲杆菌超过60种质膜和膜结合蛋白质糖基化发挥毒力作用。pgl基因座包含12个开放阅读框(open reading frames,ORFs),这12个ORFs编码的糖生物合成酶和糖基转移酶共同作用,将合成的七糖连接到脂质载体上。七糖一旦穿过细菌内膜进入周质,就会被糖基转移酶PglB转移到靶蛋白质的天冬酰胺上[41]。PglB结构为GT-C型,N-端11个次跨膜螺旋位于质膜上,第1个跨膜结构后的环形区具有XXD基序结合金属离子,XXD基序中的天冬氨酸突变其活性几乎完全丧失[42]。pgl基因座中pglB突变破坏了蛋白质糖基化,使空肠弯曲杆菌的黏附作用下降,在小鼠和鸡的肠道定植显著减少,对人上皮细胞的侵袭能力减弱。蛋白质糖基化系统介导的表面蛋白质糖基化,使其不被肠道蛋白酶消化,并促进致病菌在宿主环境的适应性[43]。弯曲杆菌属中的pgl系统已经成为研究N-连接糖基化在致病菌与其宿主相互作用的原型。
3 糖基转移酶修饰宿主蛋白质发挥作用
致病菌分泌的糖基转移酶进入宿主细胞,糖基化宿主蛋白质,使该蛋白质原本功能丧失,影响宿主信号传导、基因转录和免疫应答等功能。
艰难梭菌(Clostridiumdifficile)为革兰氏阳性厌氧芽孢杆菌,是医院获得性感染腹泻和假膜性结肠炎的主要病因。艰难梭菌的主要毒力因子是2个同源且功能相似的细胞毒素:毒素A(TcdA)和毒素B(TcdB)[44-46]。TcdA/B的N-端为糖基转移酶功能结构域,其结构为典型的GT-A型(Table1),具有结合金属离子Mn2+的DXD基序[47]。TcdA/B由内吞作用进入宿主细胞,之后自剪切将糖基转移酶结构域释放到细胞质中[48]。TcdA/B以UDP-葡萄糖为底物,将葡萄糖基转移至Rho GTPases,例如RhoA 37位、Cdc42和Rac(Rac1-3)35位的苏氨酸,Rho GTPases的糖基化使鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factors,GEFs)失活、与下游效应子解偶联、胞浆-膜循环受阻,这使细胞形态变圆、体积缩小、胞质出现大小不等的颗粒,最终导致宿主细胞死亡[49]。TcdA/B是大型梭菌糖基转移酶毒素的代表,此外索氏梭状芽胞杆菌(Clostridiumsordellii)致死毒素(TcsL)和出血毒素(TcsH)[50]、产气荚膜梭菌(Clostridiumperfringens)细胞毒素TpeL[51],均可以糖基化修饰Rho GTPases的苏氨酸使其失活。昆虫致病性非共生发光杆菌(Photorhabdusasymbiotica)中类似于TcdA/B的毒素PaTox,糖基化修饰RhoA中32位的酪氨酸,使Rho GTPase信号转导失活[52],这一发现强调了致病菌发病机制中靶向小GTPases糖基化的共通性和多样性。TcdA/B毒力活性可以通过宿主巨噬细胞固有免疫中的炎性小体途径检测。炎症小体识别TcdA/B信号激活胱天蛋白酶1(caspase-1),使白细胞介素1β(interleukin, IL-1β)和IL-18等促炎症细胞因子成熟释放,诱导细胞的程序性死亡即细胞焦亡[53]。这一发病机制说明,致病菌糖基化宿主蛋白质与宿主先天免疫系统的激活存在紧密联系。
嗜肺军团菌(Legionellapneumophila)为革兰氏阴性致病菌,可感染人肺泡巨噬细胞和上皮细胞,引起严重肺炎致人死亡。该菌主要通过II型和Dot/Icm IV型2个关键的分泌系统分泌毒力因子发挥致病性,特别是Dot/Icm分泌包括糖基转移酶在内的300多种效应蛋白质[54]。这些效应子可以诱导正常吞噬过程发生改变,破坏宿主细胞完整的细胞周期,成功逃避宿主免疫防御带来的杀伤作用,为自身营造适宜的生存环境[55]。嗜肺军团菌糖基转移酶(L.pneumphilaglycosyltransferase,Lgt)分为Lgt1至Lgt3三个家族,Lgt1的结构为GT-A型(Table1),DXD基序结合金属离子Mg2+[56]。Lgt1以UDP-葡萄糖为底物,糖基化真核延伸因子1A(eukaryotic elongation factor 1A,eEF1A)53位的丝氨酸[57]。eEF1A为GTPase是蛋白质合成延伸复合物的组成部分,对氨酰-tRNA传递到核糖体A位点发挥关键作用。53位Ser位于eEF1A的GTPase结构域内,糖基化阻止了GTPase结构域的构象变化,使eEF1A失活导致宿主蛋白质翻译过程受阻[58]。Lgt1可以使eEF1A的十肽糖基化,但对氨酰-tRNA、GTP和eEF1A三元复合物糖基化的效率更高[59]。对Lgts的研究表明,致病菌可以通过糖基化抑制宿主蛋白质合成发挥毒力作用。
除了上述介绍的嗜肺军团菌外,有些革兰氏阴性致病菌III型分泌系统能分泌另外一类糖基转移酶,它可调控宿主细胞信号转导通路,帮助病原菌逃避免疫防御。2个独立小组发现致病性大肠杆菌(enteropathogenicE.coli,EPEC)的效应蛋白NleB,在阻断宿主死亡受体信号传导和抑制炎症反应中发挥关键作用[60,61]。NleB将N-乙酰葡糖胺(N-acetylglucosamine,GlcNAc)转移至肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)和其下游效应子TNF受体相关的死亡结构域蛋白(TNF receptor-associated death domain,TRADD)、FAS相关的死亡结构域蛋白(FAS-associated death domain protein,FADD)和受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)死亡结构域(death domains,DDs)的精氨酸残基上[62]。NleB的结构为GT-A型(Table1),插入了1个独特的螺旋来固定特异的DDs有利于其糖基化。糖基化的DDs失去了相互作用的能力,阻止TRADD、FADD和RIPK1之间同型/异型DD-DD相互作用形成死亡诱导信号复合物(death-inducing signaling complex,DISC)[63]。NleB抑制宿主细胞DISC的组装,阻断了核因子кB(nuclear factor kappa-B,NF-кB)介导的炎症反应,阻止了宿主细胞的死亡。致病菌感染伴有的宿主细胞死亡,有助于限制感染起到防御作用[64]。因此,病原体已经进化出复杂的策略来调节宿主细胞中的死亡信号。啮齿类柠檬酸杆菌是一种类似EPEC的小鼠黏膜病原体,具有NleB效应子。小鼠感染中,柠檬酸杆菌野生型与△nleB的突变体相比,胱天蛋白酶8裂解和活化明显减少,NleB阳性柠檬酸杆菌感染时,Fas缺陷小鼠会发生更严重的腹泻和组织损伤,NleB的糖基转移酶活性被破坏,柠檬酸杆菌在小鼠肠道的定殖严重减少[60,65]。NleB同源效应子也存在于沙门氏菌和志贺氏菌中,精氨酸N-乙酰葡糖胺糖基化修饰(GlcNAcylation)是否普遍参与调节原核真核生物的细胞过程,需要我们去发现。
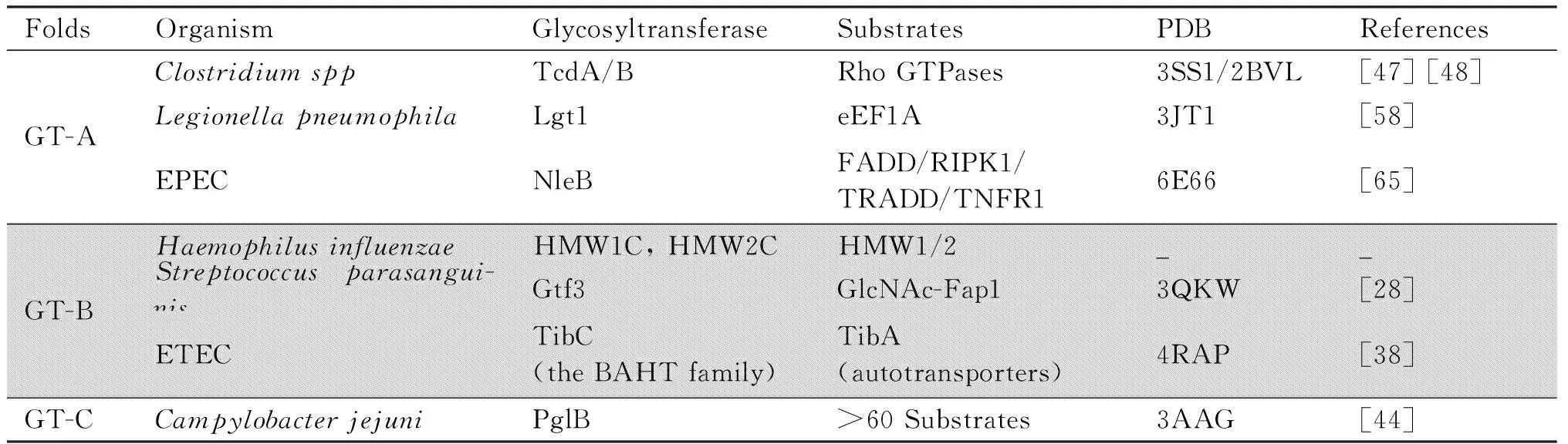
Table 1 Bacterial glycosylation systems discussed in this review
4 问题与展望
CAZy数据库中每个GTx家族成员具有识别不同底物和受体的特异性,已解析的GT结构只是GTx家族中的63个,仅代表110多个家族中的小部分。近几年随着真核表达系统的发展,越来越多的真核糖基转移酶的结构被解析。随着膜蛋白技术和低温电子显微镜的发展,在未来10年糖基转移酶的结构能够得到更有效地扩展,特别是一些具有挑战性的GT-C型酶。迄今为止,致病菌感染仍然是人类面临的一大难题,致病菌毒力因子糖基转移酶除了文中介绍的通过糖基化自身的黏附蛋白质充当武器捕获病原体,糖基化宿主蛋白质改变其构象,影响宿主蛋白质活性和功能引起疾病外,仍有许多问题等待我们去解决,例如:HMW1C-like在其他细菌中如何发挥功能;PglB如何选择性修饰超过60种空肠弯曲杆菌蛋白质,以及哪种糖蛋白质在发病机制中发挥关键作用;SRRP糖基化在细菌感染中除了黏附外的其他作用;BAHT还可以修饰哪些黏附素或宿主细胞受体;细菌或其他系统是否存在精氨酸GlcNAcylation蛋白。随着对微生物基因组高通量测序,已预测出大量的候选糖基转移酶,预示在未来致病菌与宿主相互作用的研究中会发现更多新形式的蛋白质糖基化系统,这也将为预防致病菌的感染、疾病的治疗及疫苗开发等提供更多的理论支持。

