mESC衍生内皮祖细胞定向分化为血管内皮细胞促伤口愈合
陈凤娇, 左朝艳, 吕佳荟, 杨 影, 彭 倩,杨 柳, 陆 莹, 丁 洁*
(1)贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,山地生态与农业生物工程协同创新中心, 贵阳 550025;2)中国科学院上海营养与健康研究所, 上海 200031;3)贵州中医药大学基础医学院解剖学教研室, 贵阳 550025)
皮肤是哺乳动物感知外界刺激的第一道防线,也是最容易受伤的器官[1]。烧伤、烫伤和机械损伤等原因造成的皮肤伤口若未得到及时有效的治疗,通常引起感染[2]、休克[3]、脂肪栓塞综合征[4]、应激性溃疡[5]、凝血功能障碍和器官功能障碍[6]等创伤并发症,从而导致社会经济负担增加和生活质量下降。因此,关注皮肤创伤修复的组织完整性和功能适应性具有重要意义。
伤口的愈合在很大程度上取决于皮肤组织的血管是否被完整修复,足够的血流量可以向创伤处运输促炎因子和氧气[7],有效的炎性细胞募集和炎症介质释放有助于创周处血管生成启动[8, 9]。炎症和血管新生协同调节伤口愈合。两者重塑不足都会导致组织纤维化,而纤维化反向促进免疫细胞向脂肪库迁移,阻碍血管内皮细胞进一步再生[10, 11]。血管内皮细胞以紧密排列的方式形成血管内壁光滑面,便于血管内外的液体、气体和大分子物质代谢交换;血管内皮细胞的前体细胞即内皮祖细胞,主要存在于脐血和外周血,其促血管生成功能在多种组织修复模型中已得到证实[12, 13]。然而,严重缺血的患者外周血细胞数量少,内皮祖细胞取材有限,其血管生成能力弱[14]。胚胎干细胞是血管生物学中研究血管生成和皮肤血管化的成熟干细胞库,具有库量充足,增殖能力强和免疫原性低等优点[15]。利用胚胎干细胞衍生血管内皮细胞进行创伤修复治疗手段具有较大的应用价值,但衍生过程中内皮祖细胞的形成周期未见报道。
本文采用血管内皮细胞因子 (vascular endothelial growth factor, VEGF) 进行体外诱导小鼠胚胎干细胞分化为血管内皮细胞,先筛选出具高表达的CD133和CD34内皮祖细胞,再将该内皮祖细胞进一步诱导为具有成管和迁移功能的血管内皮细胞,并观察内皮祖细胞及其诱导的血管内皮细胞在小鼠创面模型中促愈合情况,在内皮祖细胞的衍生方面寻找新的思路,为组织工程皮肤研究提供理论参考依据。
1 材料与方法
1.1 材料
细胞株:小鼠胚胎干细胞(品系:RW.4)购于中国科学院干细胞库。
主要试剂:胎牛血清(Gbico),MEM 非必需氨基酸(Gbico),L-谷氨酰胺(Gbico),青-链霉素(solarbio),β-巯基乙醇(Sigma),DMEM基础培养基(Gbico),胰酶(Gbico),Acctuse酶(Gbico),Matrigel基质胶(BD Biosciences),CD31(BD Pharmingen),CD144(Santa Cruz Biotechnology),LAMA5(Novus Biologicals),4%多聚甲醛(Biosharp),CCK-8试剂盒(Dojindo),Laminnin(Gbico)。
1.2 体外诱导分化内皮祖细胞和血管内皮细胞
1.2.1 EPC体外诱导、培养和形态观察 加入0.05%含EDTA的胰酶消化mESC,当mESC逐渐脱落培养皿底时,用2倍胰酶体积mESC培养液终止消化,轻轻晃动使mESC与MEF完全分离,转移至15 mL离心管,离心800 r/min,3 min,弃上清。用1 mL VEC培养液重悬细胞,并接入预铺明胶6 cm培养皿中,贴壁40 min,弃上清,沿壁加入4 mL VEC培养液,并加入10 ng/mL VEGF和5 ng/mL bFGF进行诱导,置于37 ℃培养箱,在相差显微镜下观察并记录0 ~ 5 d诱导EPC (mESC + VEGF + bFGF) 形态。
1.2.2 CCK-8细胞增殖测定 以5×104个/mL的密度将mESC和诱导的EPC的细胞悬液分别接入96孔培养板,100 μL/孔,37 ℃培养箱里培养过夜,在培养液中加入10 μL CCK-8溶液,充分混合,37 ℃培养箱里孵育4 h,酶标仪分析450 nm时的吸光值,计算0 ~ 5 d细胞的增殖活力。
1.2.3 定量实时聚合酶链反应检测EPC基因表达量 采用Trizol提取mESC和诱导0 ~ 5 d EPC的总RNA,逆转录后进行qRT-PCR扩增,总体系20 μL,包括PowerupUp SYBR Greeen Master Mix 10 μL,上下游引物各1.4 μL,cDNA 0.5 μL,ddH2O 6.7 μL。以GAPDH为内参,根据2-Δct进行相对定量,分析0 ~ 5 d的mESC和诱导EPC的祖细胞标志基因CD133 和CD34的表达情况,筛选出EPC的最佳诱导时间。其引物序列见Table 1。
1.2.4 VEC的体外诱导和形态鉴定 用acctuse酶消化EPC 1 ~ 2 min,用2倍 acctuse酶体积的VEC培养液终止消化。反复轻柔吹打皿底,使诱导的EPC完全脱落,收集至15 μL离心管,离心800 r/min,3 min,弃上清,用1 mL VEC培养液重悬细胞,以5×104个/孔的细胞密度接种在经Laminin基质铺板的24孔培养板中,用含50 ng/mL VEGF和25 ng/mL bFGF的分化培养液进行诱导。每天换液,在倒置显微镜下观察并记录0 ~ 7 d的细胞形态变化。
1.2.5 RT-PCR检测mESC、EPC和VEC的标志基因表达水平 分别提取mESC、诱导后EPC和诱导后VEC的总RNA并逆转录,以cDNA为模板,采用Table 1所列引物进行PCR检测。PCR产物在1.2%琼脂糖凝胶上电泳,90 V,40 min,在紫外光下观察染色条带并记录。

Table 1 Primer sequences
1.3 免疫荧光检测标志蛋白质表达率
将分化细胞培养在24孔培养板中细胞爬片上,分化培养7 d后,4%多聚甲醛固定细胞15 min,用含0.25% TritonX-100的PBS通透细胞10 min,含1%BSA的PBST封闭细胞30 min,一抗(CD31、CD144、LAMA5)4 ℃孵育过夜,二抗室温避光孵育1 h,DAPI染核2 min,在载玻片上加入10 μL 抗淬灭剂,指甲油封片。使用荧光共聚焦显微镜观察,并记录 CD31、CD144、LAMA5的表达水平。
1.4 Western 印迹检测标志蛋白质表达量
冰上裂解细胞,提取总蛋白质,BCA法检测蛋白质浓度,将蛋白质变性并进行SDS-PAGE 1 h ,转膜2 h,5%脱脂奶粉封闭1 h,一抗(CD31、CD144、LAMA5)4 ℃孵育过夜,二抗室温避光孵育1 h,TBST洗涤3次。随后,进行化学发光显色并拍照,采用ImageJ 8.0凝胶图像分析CD31、CD144、LAMA 5的相对表达量。
1.5 体外管腔形成情况
Matrigel胶在4 ℃冰箱中解冻过夜。实验前,将200 μL移液枪、200 μL枪头和24孔培养板在4 ℃冰箱中预冷30 min。在冰上将Matrigel胶以50 μL/cm2均匀接到24孔培养板中,置于培养箱中30 min,使其成胶。收集EPC和诱导7 d的VEC,将2×105个/孔的细胞量接种到铺有Matrigel胶的24孔培养板,每组实验设置5个重复孔,37 ℃培养,12 h后观察管腔形成情况。
1.6 迁移能力检测
收集预先消化的EPC和诱导7 d的VEC,将4×106个/孔的细胞量接入6孔培养板中,37 ℃培养过夜,用10 μL移液枪在单层融合的细胞上划痕,分别在0 h和24 h记录细胞迁移情况。每组实验至少重复5次,采用ImageJ 8.0测量迁移距离,并计算迁移率。
1.7 透射电镜观察细胞形态、W-P小体
根据形态学观察,将诱导后VEC放入2.5%戊二醛中固定,4 ℃过夜,PBS漂洗3次,1%锇酸固定,4℃1 h,超纯水漂洗3次,2%乙酸铀酰固定,梯度丙酮依次脱水,浸润、包埋、聚合后切片,枸橼酸铅和醋酸双氧铀进行双染色,透射电镜下观察分化细胞的超微结构。
1.8 体内功能修复检测
1.8.1 创面模型制作和创周注射治疗 造模前3 h禁水禁食,将24只8周龄(33~37 g)ICR雄性小鼠分成3组:A组:PBS;B组:EPC;C组:VEC(诱导7 d的EPC),每组8只。小鼠经腹腔注射1%戊巴比妥麻醉后,剃除背部毛发,用0.9%氯化钠清洗皮肤,碘伏消毒预处理皮肤区域,用尖镊子夹住皮肤,眼科剪减去皮肤全层,以形成1个直径1.5 cm创面,碘伏消毒创周,不包扎,并在创周处注射200 μL细胞悬液(2×106个)或PBS,待动物自然清醒后单笼喂养,每d观察创面变化。
1.8.2 伤口面积分析 分别在术后0、3、5、7、9、11和14 d记录创面愈合情况,使用ImageJ 8.0计算
1.8.3 组织学评价 麻醉小鼠后,取新生皮肤组织和远离伤口处组织,石蜡包埋,切片,苏木精-伊红染色,中性树胶封片后,在光镜下观察皮肤组织病理变化。每张切片采集5个视野的图像。
1.8.4 炎症细胞差异分析 在光学显微镜下观察病理切片,随机取5个视野,计算每个视野的炎症细胞(巨噬细胞、单核细胞、中性粒细胞等)数量,比较各组创周组织和正常组织的炎症反应情况。
1.9 统计学方法
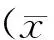
2 结果
2.1 分化第 3 d的祖细胞被鉴定为内皮祖细胞
mESC在经丝裂霉素C处理的小鼠胚胎成纤维细胞 (mouse embryonic fibroblasts, MEF) 上呈集落状生长,形成圆形或椭圆形的克隆。细胞排列紧密,表面光滑,边缘清晰(见Fig.1A)。mESC通过胰酶消化后被接入6 cm培养皿中,并在10 ng/mLVEGF和5 ng/mL bFGF的诱导条件下生长。3 d后,细胞体积增大,呈现梭形,增殖速度加快,镶嵌融合生长,未见细胞重叠现象。密集生长部分呈现内皮祖细胞典型的三角形、梭形或“铺路石”样状态,形态圆润,折光性好(见Fig.1B)。
针对Fig.1中细胞明显的形态变化,以mESC为对照,检测0~5 d的祖细胞CCK-8细胞活性-增殖能力。结果显示,mESC增殖能力相对较低,经VEGF和bFGF诱导后细胞的活力在0~4 d内逐渐增加。其中,第3 d EPC的OD值(1.44 ± 0.07)在对数生长期(Fig.2A);同时,EPC的标志基因CD133(相对表达量0.88 ± 0.04)和CD34(相对表达量2.12 ± 0.02)在第3 d的表达量最高(Fig.2C),与mESC组相比,具有显著性差异 (P< 0.01)。

Fig.1 Morphological detection of mESCs and EPCs (A) mESCs were typically round or oval clones, scale bar 100 μm. (B) Cells on day 3 of EPC differentiation showed spindle, triangular, and irregular polygonal mosaic patterns, scale bar 100 μm

Fig.2 Proliferation capacity and gene expression of EPC (A, B) The proliferative capacity and viability of mESC progenitor cell differentiation within 5 days. mESCs were used as controls. O.D. values were presented as the mean ± SD (n = 5).** P < 0.01, 0.01<*P < 0.05. (C) qRT-PCR analyses for the expression of markers specific for CD34 and CD133 of EPC within 5 days. Expression values were relative to those of GAPDH and are presented as the mean ± SD (n = 5).** P < 0.01
上述研究结果显示:诱导3 d的祖细胞的活性高、增殖能力强、标志基因高表达。因此,选择该阶段的细胞作为内皮祖细胞进行后续实验。
2.2 内皮祖细胞体外诱导分化为血管内皮细胞
2.2.1 EPC在分化7 d后具有VEC的形态 EPC通过50 ng/mL VEGF和25 ng/mL bFGF体外诱导7 d的细胞形态见Fig.3A所示。细胞贴壁生长后,细胞汇集成单层细胞,有接触抑制现象,未见重叠生长,细胞集落出现,呈现短梭状、椭圆状、三角状及鹅卵石状,细胞立体程度增加,折光性强,细胞质饱满,核明显。结果正如Fig.3B所示,中间部分细胞密集程度大,呈现扁平状,“铺路石”样显著,边缘细胞呈现多角状、三角形、梭形等不规则形态,有微绒毛突起,这些表征符合血管内皮细胞形态特征。

Fig.3 Morphological detection of EPC on day 7 of endothelial differentiation (A) EPCs induced by VEGF and bFGF on days 7 were "paving stones" and chromatin was markedly increased, with the morphological characteristics of VECs, scale bar 100 μm. (B) Microvilli on the cell membrane were commonly seen, scale bar 100 μm
2.2.2 EPC在分化7 d后高表达VEC的标记物 采用免疫荧光染色分别检测mESC、EPC和诱导后VEC的内皮细胞特异性抗原表达,结果如Fig.4所示。诱导获得的VEC的内皮谱系标志抗原CD31、CD144阳性高表达,双标率为80.33 ± 1.45%,而EPC阳性弱表达(双标率1.91 ± 0.50%),mESC阴性表达;同时,VEC的血管生成相关标志物LAMA5阳性高表达,CD31和LAMA5双标率为83.33 ± 1.20%,而EPC阳性弱表达(双标率3.88 ± 0.79%),mESC阴性表达。由此,诱导获得的VEC具有较高标记物阳性率。结果表明,EPC具有深度内皮化潜能。
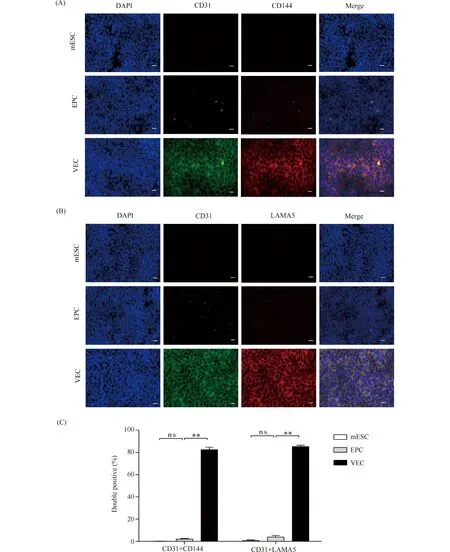
Fig.4 Immunofluorescence staining (A) Co-expression of VEC-specific antigen CD31 (green) and CD144 (red) in each group, scale bar 20 μm. (B) Co-expression of VEC-specific antigen CD31 (green) and LAMA5 (red) in each group, scale bar 20 μm. (C) The percentage of CD31 + CD144 or CD31 + LAMA5 double-positive cells in the total cell population of VECs was much higher than mESCs and EPCs. VEC: EPC on day 7 of endothelial differentiation. Expression values were presented as the mean ± SD (n = 5).** P < 0.01
通过RT-PCR检测mESC、EPC和诱导获得的VEC的标志基因,并通过Western印迹检测VEC特异性抗原的表达。结果显示,mESC和EPC均表达干性基因Sox2、Klf4、Nanog和Oct4,mESC的表达水平明显高于EPC,诱导获得的VEC高表达VEC标志基因CD31、CD144、LAMA5、vWF、Tek和KDR(Fig.5A)。同时,mESC和EPC表达VEC标志基因CD31和LAMA5,但无相应的蛋白质表达(Fig.5B),VEC的标志蛋白质CD31、CD144和LAMA5仅在诱导获得的VEC中高表达,相对表达量分别为CD31(1.07 ± 0.032)、CD144(0.60 ± 0.02)和LAMA5(0.70 ± 0.02)(Fig.5C),结果均有显著性差异。因此,相比mESC和EPC,诱导获得的VEC高表达VEC标志基因和蛋白质。
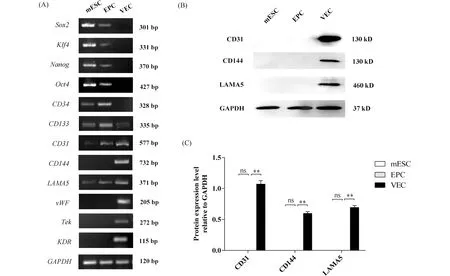
Fig.5 Analysis of specific genes and protein expression (A) RT-PCR analyses for the expression of markers specific for the mESC (Sox2、Klf4、Nanog and Oct4), EPC (CD133 and CD34) and VEC (CD31, CD144, LAMA5, vWF, Tek and KDR). VEC: EPC on day 7 of endothelial differentiation. (B, C) The expression of CD31, CD144, LAMA5 in each group examined by Western blotting. VEC: EPC on day 7 of endothelial differentiation. Expression values were relative to those of GAPDH and are presented as the mean ± SD (n = 5).** P < 0.01
2.2.3 EPC在分化7 d后具有较好的成管、迁移和W-P小体形成能力 将不同浓度(2×105个/孔、3×105个/孔、4×105个/孔)的诱导获得的VEC悬液接种到铺有Matrigel胶的24孔培养板内,在接板12 h后,诱导获得的VEC具有良好的管腔形成能力(Fig.6A),且接种浓度为3×105个/孔实验组血管总分支长度(1.14×104± 0.13)和分支节点数(174.70 ± 3.71)均大于2×105个/孔和4×105个/孔的2个实验组(Fig.6B),以3×105个/孔的密度接种可获得较大的管腔形成率;为了进一步确认诱导前后细胞的管腔形成能力变化,以EPC为对照,接种3×105个/孔密度的EPC和诱导获得的VEC到Matrigel胶上。从Fig.6C可知,EPC呈单细胞状分布,极少量细胞连接成短线状,无管腔形成能力;诱导获得的VEC可见明显的交叉点与管腔,呈现出相对完整的管状网络结构。
Fig.6 Comparison of lumen formation (A, B) Different total segment lengths and numbers of branch junctions were formed by different density of EPCs on days 7 of endothelial differentiation (VECs), scale bar 100 μm. Expression values were presented as the mean ± SD (n = 5).** P < 0.01. (C) EPC on days 7 of endothelial differentiation (VEC) showed good tubulogenesis, but EPC did not, scale bar 100 μm
内皮细胞的定向迁移在血管生成的开始发挥重要的作用。在确认诱导后的细胞具有较好的管腔形成能力前提下,本文以EPC为对照,通过划痕检测诱导获得的VEC的迁移能力,结果正如Fig.7A所示,划痕24 h后,诱导获得的VEC具有较好的迁移功能,细胞内皮化诱导7 d后的迁移能力(迁移率55.22 ± 193.30%)显著地大于EPC(迁移率14.65 ± 45.44%),该结果具有统计学意义(P< 0.01)。

Fig.7 Comparison of migration capacity (A, B) The mobility of EPC on days 7 of endothelial differentiation (VEC) was significantly higher than that EPC after 24 hours of scratch, scale bar 100 μm. Expression values were presented as the mean ± SD (n = 5).** P < 0.01
确定诱导后VEC的表型功能后,进一步通过透射电镜检测该细胞的内部结构,结果正如Fig.8所示。诱导获得的VEC呈现出内皮样细胞的结构特点,细胞膜表面存在少量微绒毛,细胞基质中存在大量的线粒体、高尔基复合体和吞饮小泡,基底膜及细胞顶端存在大量小泡,胞浆中可见小运输泡,粗面内质网及多聚核糖体散在分布于胞质中,在高尔基复合体附近的细胞质核周区域能清晰可见具有储存vWF功能的W-P小体。
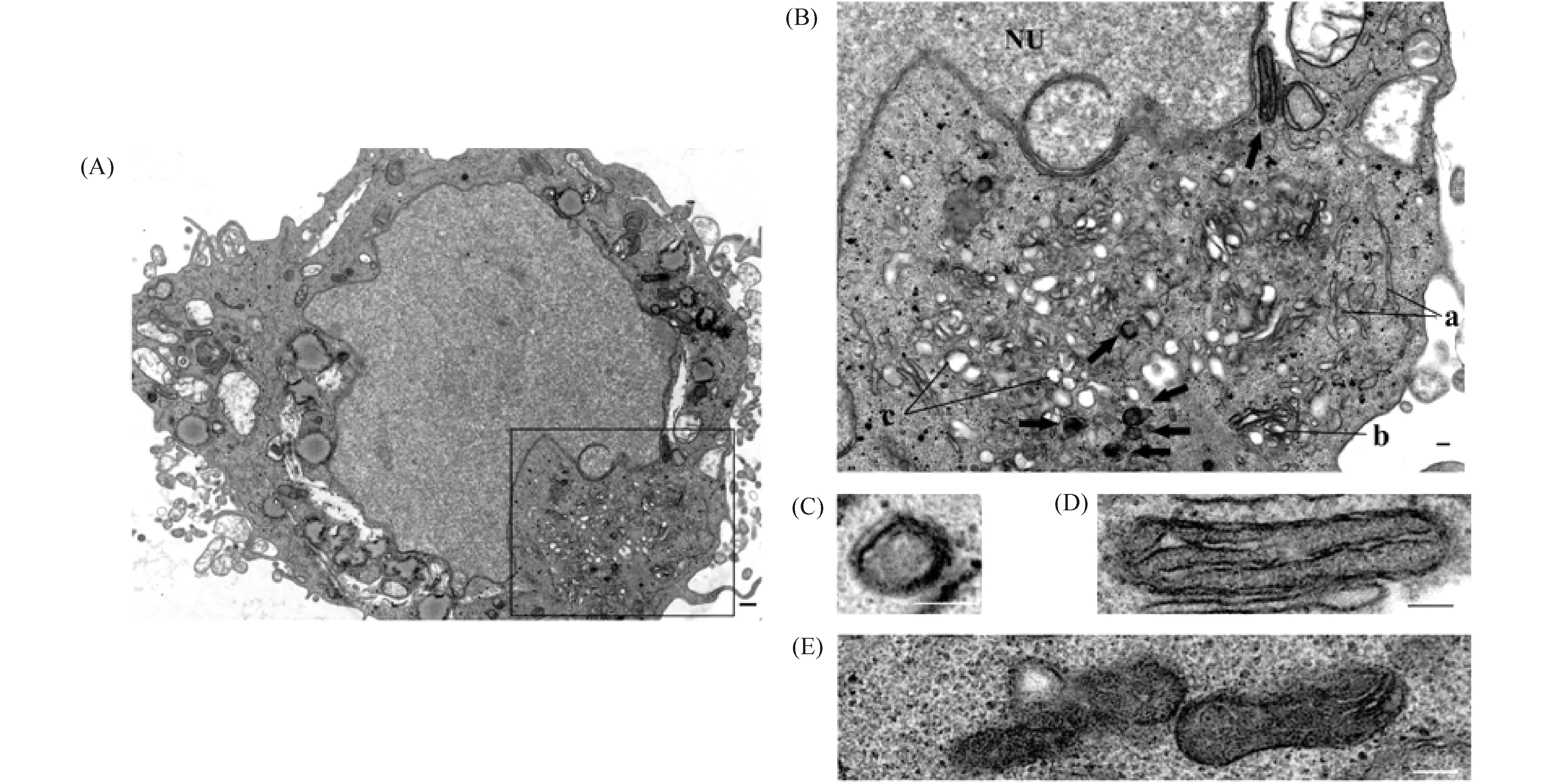
Fig.8 Intracellular structures of EPC on days 7 of endothelial differentiation (A) Complete intracellular structures, scale bar 5.0 μm. (B) Localized intracellular structures, a: rough endoplasmic reticulum, b: Golgi complex, c: swallowing vesicle, NU: nucleus, black arrow: W-P body, scale bar 1.0 μm. (C) Cross-section of the W-P body, scale bar 2.0 μm. (D) Longitudinal section of the W-P body, scale bar 1.0 um. (E) W-P bodies, scale bar 1.0 μm
综上所述,本文采取体外两步诱导法,先将小鼠胚胎干细胞定向诱导为内皮祖细胞,筛选出诱导率最好的时间,将内皮祖细胞进行重接板和深度内皮化诱导。研究结果表明,mESC-EPC在50 ng/mL VEGF和25 ng/mL bFGF的条件下,诱导7 d可获得血管内皮样细胞,且该细胞的血管生成程序被激活,促血管生成能力在后续体内实验中得到验证。
2.3 诱导后的血管内皮样细胞促进小鼠皮肤伤口愈合
2.3.1 VEC可促进伤口愈合和血管生成 为了验证体外诱导的细胞是否具有促血管生成及皮肤修复实效,本文进行了活体小鼠模型体内检测。分别用PBS、EPC和VEC治疗伤口边缘,结果正如Fig.9A所示。术后第5 d,3个组的伤口均有结痂现象并开始愈合;第9 d时,VEC干预伤口的表皮层几乎愈合(相对愈合率97.43 ± 127.70%);第14 d时,EPC干预的愈合率达到95.57 ± 83.73%。同时,VEC组的伤口完全愈合(相对愈合率100.00 ± 0.00%),说明EPC和VEC均能显著促进伤口愈合。从解剖学角度看,VEC组新生皮肤处有大量的微血管生成(红色),而EPC组不明显。由Fig.9B可知,VEC组的创面愈合率在各个时间点均明显高于PBS组和EPC组,差异具有统计学意义(P< 0.01)。

Fig.9 Skin wound healing after surgery at different time points (A) Compared with PBS, both EPC and VEC can promote wound healing after 14 days. VEC promoted extensive angiogenesis at the perioperative stage. (B) The degree of relative wound healing varied with different treatment conditions: VEC > EPC > PBS. Expression values were presented as the mean ± SD (n = 5).** P < 0.01
2.3.2 VEC促进皮肤创面的组织再生 为了进一步研究PBS、EPC和VEC对小鼠创口愈合程度的影响,本文对小鼠创伤治疗14 d后的病理切片进行HE染色,观察各组的病理学变化。结果正如Fig.10所示,PBS对照组、EPC组和VEC组均有愈合的标志出现,但愈合情况有差异,PBS创周组:组织结构松散,炎性细胞浸润现象和血管生成较少(Fig.10A);EPC创周组:组织结构较为致密,有数量较多的炎性细胞浸润,可见少量新生肉芽组织(Fig.10B);VEC创周组:胶原纤维排列紧密且有方向性,成纤维细胞数目多,大量新生毛囊和新生血管增多,且血管较粗大,不同种类的炎性细胞大量浸润(Fig.10C);而3个远离创周组仅有少量炎性细胞和血管生成(Fig.10A1、B1、C1)。
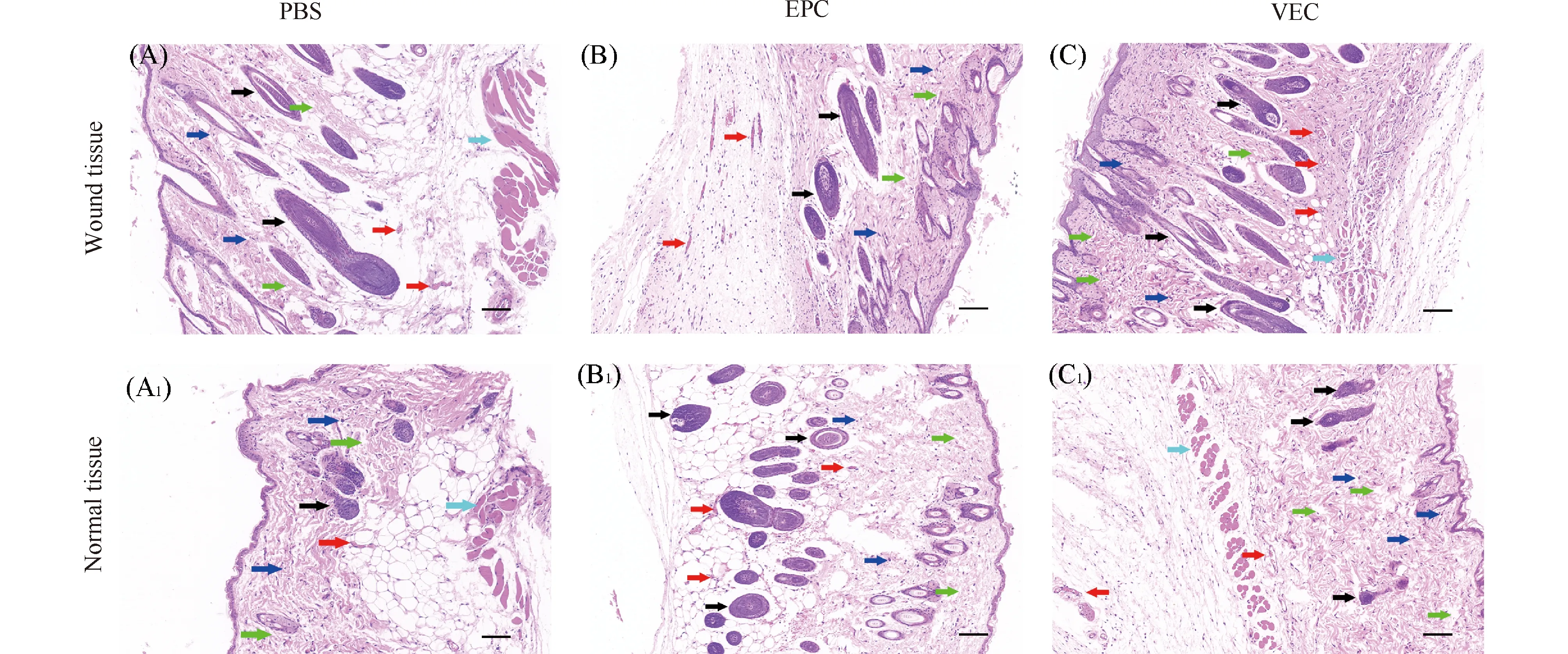
Fig.10 Pathological observation of trauma treatment after 14 days The abundance of new cells in wound tissues was higher than that in normal tissues in each group, scale bar 100 μm. Note: Black arrow = hair follicle cell; Red arrow = new blood vessel; Dark blue arrow = inflammatory cell; Green arrow = collagen fiber; Light blue arrow = muscle tissue
由Table 2可知,VEC创周组的血管生成数为50.67 ± 1.20,显著高于EPC创周组 (血管生成数32.33 ± 1.45) 和PBS创周组 (血管生成数17.67 ± 0.88);3个远离创周组的血管生成数均低于创周处,且组间差异无统计学意义(P> 0.05),故VEC可提高创伤组织的血管生成率。

Table 2 Comparison of the number of angiogenesis in different treatment groups
2.3.3 VEC促进皮肤创面的炎性细胞生成 在HE染色的基础上,通过对小鼠创伤治疗14 d后的组织学观察,本文进行了各组的炎症反应评估。从Fig.11中能清楚地观察到各组创周处的炎性细胞的个数不同,差异趋势为PBS < EPC < VEC,与PBS组创周处相比,EPC组(细胞数184.30 ± 10.48)和VEC组(细胞数391.30 ± 7.69)创周处炎性细胞的数目明显增多,均有显著性差异(P< 0.01)。结果阐明,EPC和VEC均能促进炎症细胞(巨噬细胞、单核细胞、中性粒细胞等)的生成,且VEC促炎作用更大。此外,PBS组、EPC组和VEC组3组远离创周处炎性细胞数目差异不大,且炎性细胞的数量明显均少于对应创周处的数量。由此可见,EPC、VEC均起到促进创周处的炎症反应的作用,加速了伤口愈合。
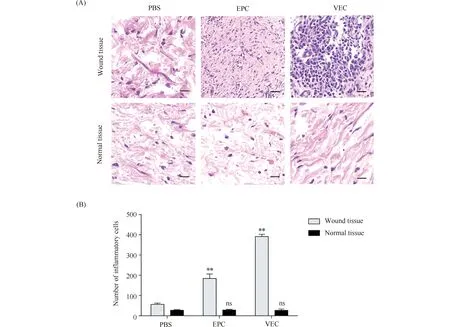
Fig.11 Inflammatory cell formation of trauma treatment after 14 days (A, B) The number of new inflammatory cells of the wound tissues increased sequentially: PBS < EPC < VEC, but the rate of inflammatory cell generation in the normal tissues is not significant different, scale bar 20 μm. Expression values were presented as the mean ± SD (n = 5).** P < 0.01
3 讨论
伤口愈合是通过连续和协同的重塑阶段进行的,包括止血、收缩、炎症、上皮化、毛囊再生和肌底恢复等[16, 17],这一系列过程受生长因子和细胞因子的复杂环境调控[18, 19]。在伤口更新和修复的生理病理过程中,血管生成是皮肤早期上皮化的关键步骤,而血管的再生依赖于多种炎症因子、血管生长因子和其他细胞因子的表达[20-22],促炎因子增加血管通透性,从而促进免疫细胞向受损组织外渗[23]。
本文证实了可在体外诱导小鼠胚胎干细胞分化为活力处于对数生长期且高表达CD34和CD133的内皮祖细胞,并进一步诱导分化为典型铺路石样和良好折光度的血管内皮样细胞,EPC诱导7 d后的细胞表达VEC标志基因和蛋白质;同时,在内皮再生的功能性方面,维持血管管腔的完整度和血管的迁移张力是至关重要的。本文通过体外诱导获得的血管内皮样细胞具有较好的迁移和成管能力,透射电镜下观察到的W-P小体进一步验证了其具备VEC的结构完整性和功能性。本文结果得出通过两步诱导法,成功获得了血管内皮样细胞。值得注意的是,适当浓度的血管内皮细胞可以提高同一环境下的管腔形成率。这提示我们,可以根据调整血管内皮细胞诱导因子的浓度改善生理微环境状况,以找到最佳的伤口治疗方式。此外,通过EPC-VEC移植入小鼠体内,创伤修复模型的血管生成增多,炎症细胞和成纤维细胞的数量明显增加,出现大量的新生胶原纤维和毛囊。因此,EPC来源的VEC促进创周组织的血管重塑和炎症反应,协同调节炎症和血管生成可提高伤口愈合率。
mESC作为一种强大的干细胞库,被广泛应用于人类疾病建模、基因工程、谱系特异性、干细胞治疗和组织再生的研究[24],利用干细胞诱导技术,可以将mESC分化为心肌细胞[25]、星形胶质细胞[26]和血管内皮细胞等靶细胞,但分化效率因复杂的诱导方法和信号分子变化而不同。VEGF是内皮细胞分泌活跃和分布广泛的因子,在血管生成、血管化和分化过程中发挥着重要作用[27]。本文通过2个浓度的VEGF进行两步法诱导mESC分化为血管内皮细胞,在祖细胞阶段的差异贴壁法将状态好、贴壁快的细胞筛选出来,这种方法在内皮化中也有应用[28]。在VEC分化阶段,将未分化的小细胞团进行了二次信号刺激,分步诱导法增大了分化效率,提高了内皮细胞的存活率,也缩短了内皮细胞的成熟时间,避免了细胞长时间在同一环境下生长所引起的旁分泌抑制效应。mESC衍生的EPC可以高效地分化为血管内皮样细胞,体外诱导获得的血管内皮样细胞为有限的自体内皮细胞源取材和原代内皮细胞易老化的问题提供了新思路,也为血管组织工程和细胞移植治疗缺血性疾病筛选合适的种子细胞提供了新的可能性。
需要注意的是,在血管内皮样细胞诱导产生过程中,细胞仍表达少量的祖细胞基因。在后期研究中,需要进一步确定内皮化初期和后期的功能性差异。目前,对于炎性细胞的种类数量和血管生成-炎症互作的关联因子尚未得到全面地确认和分析,胞内血管生成相关分子的表达和血管周围胞间负向信号通讯对于伤口愈合的作用机制亟待进一步研究,将基于干细胞的治疗性血管生成转化为有效的临床应用值得探索。
致谢:珠海市金湾区三灶镇中心小学陆婷婷老师对本文图片处理提供悉心指导,在此表示由衷的感谢。

