正常与氧糖剥夺再复氧培养的星形胶质细胞来源外泌体miRNA测序分析
龙培艳, 张文萍, 郑 菊, 付燕林, 高 霄,王正薇, 肖 雁*
(1)地方病与少数民族疾病教育部重点实验室, 贵阳 550004;2)贵州医科大学分子生物学重点实验室, 贵阳 550004)
星形胶质细胞是神经系统中含量最多,胞体最大的胶质细胞,可为神经细胞提供营养、支持和保护[1,2]。星形胶质细胞作为分泌型细胞,在生理或病理状态下均可分泌外泌体[3]。外泌体可参与调节包括炎症、免疫应答、肿瘤生长、神经退行性疾病和血管疾病等在内的多种病理生理过程[4-6]。miRNA是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,其大小长约18~26个核苷酸,通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译[7]。外泌体可以通过转运活性miRNA改变受体细胞的生理功能,实现信号传导或转录调控[8]。缺血性中风后再灌注损伤是血管性痴呆的主要原因之一,脑组织对缺血缺氧较为敏感,及时的恢复血流和氧气对于维持神经元正常功能极为关键,但同时也会对神经元产生损伤,脑缺血再灌注会引起炎症、氧化应激及线粒体自噬等病理生理反应[9]。同时脑缺血后星形胶质细胞活跃度增加,缺氧可促进星形胶质细胞释放外泌体,并且所分泌的外泌体还可以保护由缺氧缺血引起的神经元线粒体自噬及细胞凋亡[10,11],但外泌体内的miRNA在此过程中的作用尚未明确。因此,本研究应用氧糖剥夺再复氧(oxygen and glucose deprivation/reoxygenation,OGD/R)培养星形胶质细胞模拟脑内缺血再灌注,对正常培养和OGD/R培养的星形胶质细胞来源外泌体进行miRNA测序,并对测序得到的差异miRNA进行后续的功能富集分析,可为后续研究星形胶质细胞来源外泌体对神经元的保护作用机制提供一定的研究基础。
1 材料与方法
1.1 试剂
DMEM/F12培养基,无糖DMEM培养基,胎牛血清(fetal bovine serum, FBS)购自美国Gibco公司;胰酶,双抗(链霉素,青霉素)购买于以色列BI公司;磷酸盐缓冲液(PBS)购自武汉塞维尔公司;脱脂奶粉和RIPA购自北京 Solarbio 有限公司;BCA蛋白质定量试剂购于美国Thermo Fisher Scientific 公司;预染蛋白质标准分子量(marker)购自上海爱必信公司;PVDF 膜购于美国 Millipore公司;ALIX、TSG101兔单克隆抗体购自于英国abcam公司;HSP60鼠单克隆抗体购自武汉三鹰公司;兔二抗和鼠二抗购自美国Cell Signaling Technology公司;TruSeq Small RNA Sample Prep Kits 试剂盒购于美国Illumina公司;miRNA逆转录试剂和qPCR试剂盒购自上海吉玛公司;miRNA的引物由生工生物工程(上海)股份有限公司合成。
1.2 细胞培养及分组
1.2.1 原代星形胶质细胞培养及分组 本文使用的细胞为课题组前期从SD乳鼠大脑皮质提取,并且通过星形胶质细胞标志性蛋白质胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)免疫荧光染色鉴定为星形胶质细胞[12]。将星形胶质细胞分为正常培养组和OGD/R培养组,正常组用89%DMEM/F12,10%无外泌体FBS和1%双抗制备的完全培养基在37 ℃,5%CO2的正常培养箱中培养48 h后收集培养基上清;OGD/R组当细胞密度达到70%时从培养箱中取出,用PBS洗2次,再用无糖DMEM培养基洗1次,换含1%双抗的无糖DMEM培养基在1%O2,5%CO2,94%N2的三气培养箱中培养9 h,之后取出用PBS洗2次,换89%DMEM/F12,10%无外泌体FBS和1%双抗配制的正常培养基在37 ℃、5%CO2的正常培养箱中培养24 h后收集培养基上清。
1.2.2 无外泌体血清制备 胎牛血清用超速离心机进行离心,4 ℃条件下140 000 g离心2 h,弃去离心管底部沉淀,得到的血清于-20 ℃冰箱保存备用。
1.3 外泌体提取
使用超速离心法提取外泌体:收集2个组的细胞培养基上清,首先1 200 g离心10 min去除细胞团,2 000 g离心10 min去除细胞碎片,11 000 g离心30 min去除小的细胞碎片和细胞器,最后,140 000 g离心90 min后收集外泌体,所有离心均在4 ℃下进行,离心结束后用PBS重悬外泌体用于鉴定和后续测序。
1.4 外泌体鉴定
将外泌体用PBS重悬后低温送往上海华盈生物公司,进行纳米颗粒追踪技术分析和透射电镜鉴定其形态特征。使用免疫印迹法检测外泌体的标志性蛋白质:使用BCA法测外泌体的浓度,加入上样缓冲液(loading buffer),沸水浴5 min使其变性,放4 ℃备用。配制10%的分离胶和5%的浓缩胶,上样量为30 μg,30 mA恒流电泳2 h,200 mA恒流湿转转膜2 h。转膜完用TBST洗3次,每次10 min。用5%的脱脂奶粉室温封闭1 h,TBST洗3次,每次10 min。一抗HSP60(1∶1 000)、TSG101(1∶1 000)、ALIX(1∶2 000)4 ℃摇床孵育过夜。回收一抗,TBST洗3次,每次10 min;二抗室温孵育1 h后,再用TBST洗3次,每次10 min。加ECL发光液,使用蛋白质曝光仪曝光。
1.5 miRNA测序
小RNA测序文库制备采用TruSeq Small RNA Sample Prep Kits试剂盒。文库制备工作完成后,对构建好的文库使用Illumina Hiseq2000进行测序分析,测序读长为单端 1X50 bp。miRNA数据分析软件为ACGT101-miR,分析流程如下:(1)去除3′接头和垃圾序列:获取有效数据(clean data);(2)长度筛选:保留碱基长度在18~26 nt的序列;(3)各种RNA数据库比对分析:将剩余序列比对(不包含miRNA)mRNA、RFam和Repbase数据库,并进行过滤;(4)miRNA鉴定:获取有效数据,并比对前体和基因组进行miRNA鉴定;(5)miRNA差异性分析,(6)差异性miRNA靶基因预测分析。
1.6 差异基因功能富集分析
1.6.1 GO分析 GO功能分析是针对差异miRNA靶基因进行功能注释和归类。GO分析柱状图是在所有选定的miRNA靶基因中,将这些基因对应的GO注释按照分子功能(molecular function)、生物过程(biological process)和细胞组成(cellar component)分为3类,并且将每一类中的GO功能按照注释到的靶基因个数从高到低排序,并进行作图,横坐标是对GO的分类,纵坐标是靶基因所占的百分比。GO分析散点图是采用ggplot2对GO富集分析结果以散点图展示:Rich factor表示位于该GO的差异基因个数/位于该GO的总基因数,P值越小,GO富集程度越高。
1.6.2 KEGG分析 KEGG功能注释通路显著性富集,主要是确定差异基因参与的最主要生化代谢途径和信号转导途径。利用KEGG数据库对差异miRNA靶基因进行途径(pathway)分析,并用超几何分布检验的方法, 计算每个途径条目中差异miRNA靶基因富集的显著性。
1.7 qPCR验证
选择2个上调的miRNA(rno-let-7a-5p , rno-miR-93-5p)和2个下调的miRNA(rno-miR-375-3p_R-1_1ss21GT ,mmu-mir-6240-p5_1ss15TG),进行qPCR验证。以 U6snRNA 为内参,计算方法采用2-△△CT,miRNA引物序列见Table 1。

Table 1 Primer sequences of miRNAs
1.8 统计学方法
本研究使用SPSS22.0统计软件进行数据处理,数据以均数±标准差表示,两组样本间统计使用t-检验进行分析,P<0.05时,表示其差异具有统计学意义。
2 结果
2.1 外泌体鉴定
在透射电镜下观察到外泌体呈囊泡状,具有明显的膜性结构,并且包膜结构完整,其内含有低电子密度小颗粒 (Fig.1A、B)。从两组星形胶质细胞培养基上清中经超速离心所得的沉淀物,通过免疫印迹检测,结果显示,超速离心所得的沉淀均表达ALIX、HSP60、TSG101外泌体标志性蛋白质(Fig.1C)。纳米颗粒追踪技术(NTA)分析检测到星形胶质细胞外泌体大小为100.5±31.1 nm,占比为 96.8%(Fig1D)。
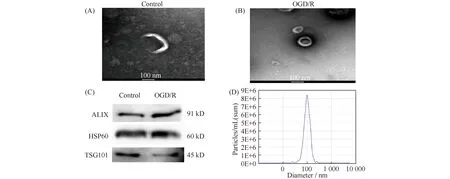
Fig.1 Identification of astrocyte-derived exosomes (A) Electron micrograph of astrocyte-derived exosomes of the control group; (B) Electron micrograph of astrocyte-derived exosomes of the OGD/R group; (C) Western blot detection showed that the exosome contained exosome-specific proteins tumor-susceptibility protein (TSG101), heat shock protein 60 (Hsp60), ALG-2-interacting protein X(ALIX); (D) NTA detected astrocyte exosomes with a size of 100.5±31.1 nm, accounting for 96.8%
2.2 差异miRNA表达
此次测序共检测到292种miRNA,其中有157种miRNA是在两个组中都存在,只存在于正常组中的有46种miRNA,只存在于OGD/R组中有89种miRNA(Fig.2)。OGD/R组星形胶质细胞来源外泌体与正常培养的星形胶质细胞来源外泌体相比共有41个miRNA表达具有显著差异性(P<0.05),其中有20个miRNA表达上调,21个miRNA表达下调,差异miRNA具体信息查看Table 2。

Table 2 Differentially expressed miRNAs in the OGD/R group compared to the control group

Fig.2 The Venn diagram of differentially expressed miRNA Totally 292 miRNAs were detected in this sequence, showing the overlap of 157 miRNAs between both groups
2.3 差异miRNA火山图
以∣log2(Fold change)∣>1 (即两倍差异倍数)且p<0.05为阈值做火山图。红色代表显著上调差异表达miRNA共有14个,蓝色代表显著下调差异表达miRNA共有16个,灰色圆点代表非显著差异表达miRNA。
2.4 差异miRNA靶基因 GO分析
由GO富集柱状图(Fig.4)显示,差异miRNA相对应的靶基因在生物过程中主要与信号转导、RNA聚合酶Ⅱ对转录的调控、氧化还原过程及蛋白质磷酸化等有关;在细胞组成上主要参与细胞膜、细胞质和细胞核等的组成;在分子功能上主要与蛋白质结合和金属离子结合等有关。

Fig.3 Volcano map of differentially expressed miRNAs in OGD/R group vs Control group Red represents 14 miRNAs that are significantly up-regulated, blue represents 16 miRNAs that are significantly down-regulated, and gray dots represent non-significantly differentially expressed miRNAs
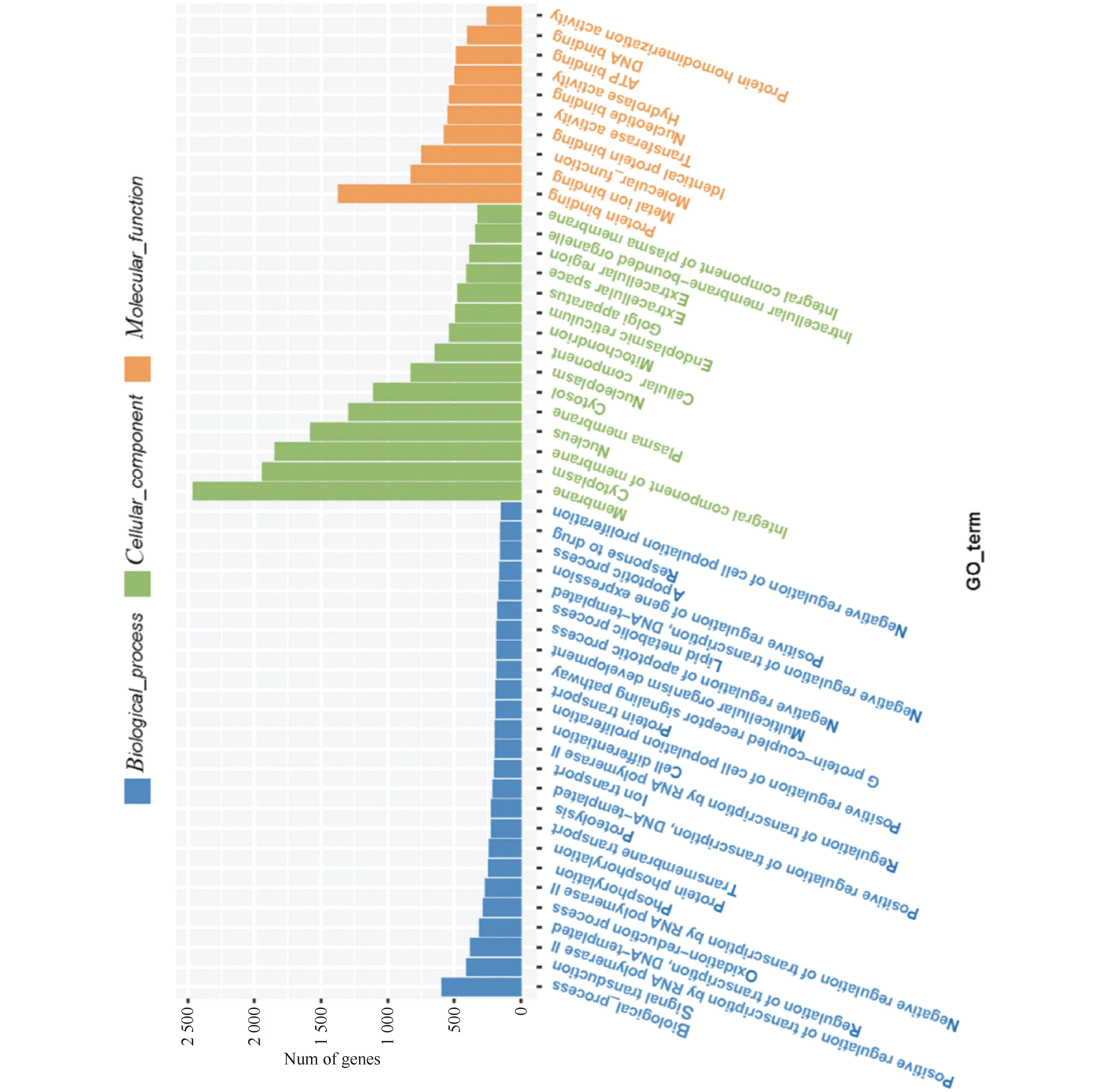
Fig.4 Histogram of GO enrichment of the predicted target genes of the differentially expressed miRNAs The target genes are mainly related to signal transduction, regulation of transcription by RNA polymerase Ⅱ, Oxidation-reduction process and protein phosphorylation in biological processes. They are mainly involved in the composition of cell membrane, cytoplasm, and nucleus. They are mainly related to molecular functions including protein binding and metal ion binding and so on
GO富集散点图(Fig.5)表明,差异表达基因主要与蛋白质糖基化、脂质代谢过程、磷酸化作用、高尔基体、内质网、内吞体、细胞质囊泡和细胞突起等有关。

Fig.5 Scatter plot of GO enrichment of the predicted target genes of the differentially expressed miRNAs Differentially expressed genes are mainly related to protein glycosylation, lipid metabolism process, phosphorylation, Golgi membrane and apparatus, endoplasmic reticulum, endosome, cytoplasmic vesicles and cell junction
2.5 差异miRNA KEGG分析
KEGG通路分析散点图(Fig.6)显示,差异miRNA靶基因主要与丁酸代谢、β-丙氨酸代谢、脂肪酸降解、线粒体自噬、p53信号通路和Toll样受体信号通路等代谢途径和信号通路有关。
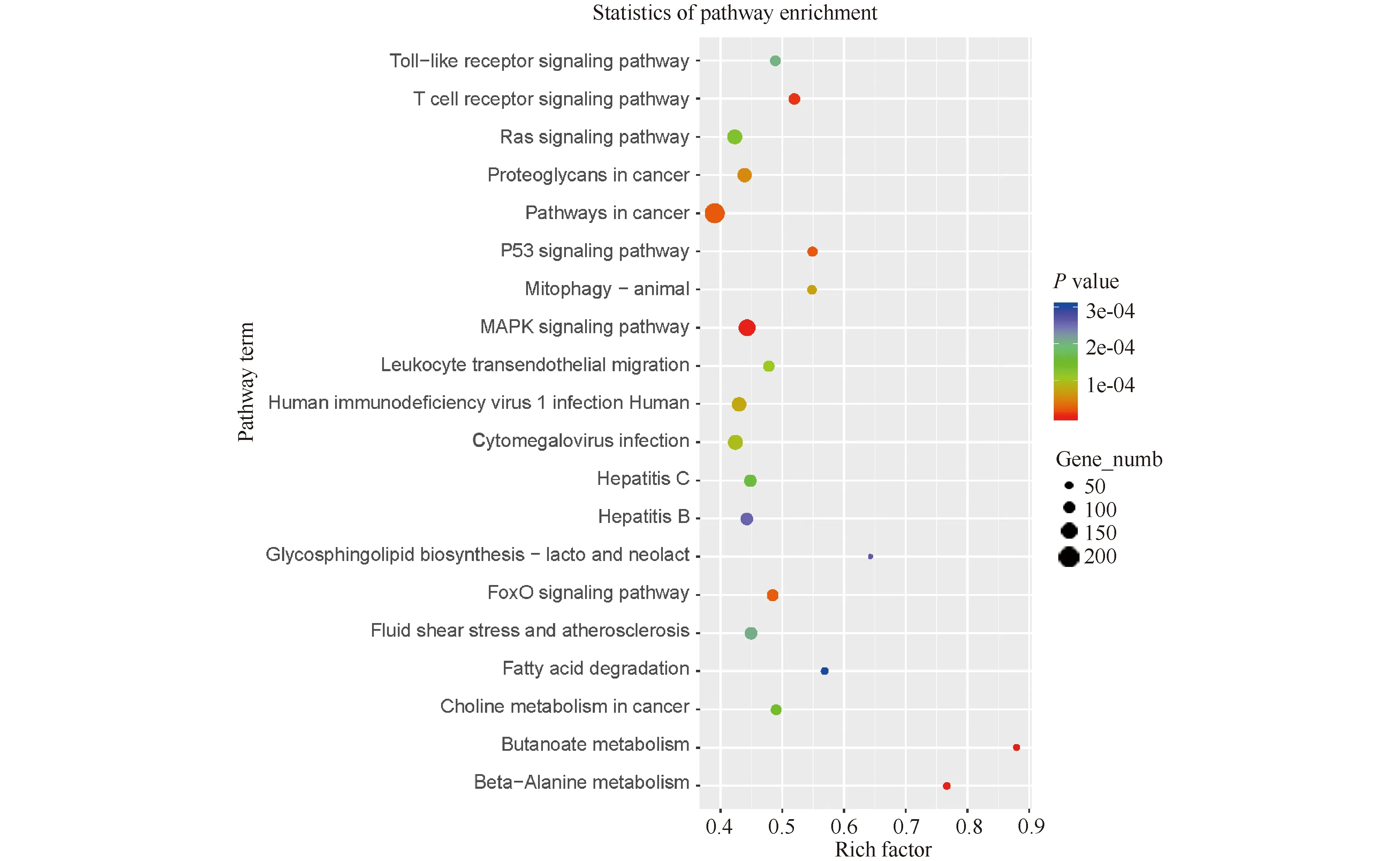
Fig.6 Scatter diagram of KEGG analysis of the predicted target genes of the differentially expressed miRNAs Differential target genes are mainly related to butyrate metabolism, β-alanine metabolism, fatty acid degradation, mitophagy, p53 signaling, Toll-like receptor signaling and other metabolic and signaling pathways
2.6 qPCR验证
选取的rno-let-7a-5p、rno-miR-93-5p、rno-miR-375-3p_R-1_1ss21GT 、mmu-mir-6240-p5_1ss15TG在正常组和OGD/R组外泌体表达差异具有统计学意义,且升高或者降低趋势与测序结果一致(Table3)。
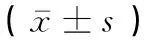
Table 3 Expression of miRNA in control group and OGD/R group
3 讨论
本研究通过高通量测序技术获得了正常培养和OGD/R培养的星形胶质细胞来源外泌体的miRNA差异表达谱,与正常组相比,OGD/R组共有41个显著差异表达的miRNA,其中上调的有20个,下调的有21个。为探索显著差异表达的基因参与的生物学环节,将差异表达的miRNA的靶基因进行GO分析和KEGG通路分析。GO分析显示,显著差异表达的靶基因主要参与蛋白质糖基化、脂质代谢过程、磷酸化作用、高尔基体、内质网、内吞体、细胞质囊泡和细胞突起等生物学过程;KEGG通路分析显示,显著差异表达的miRNA靶基因在丁酸代谢、β-丙氨酸代谢、脂肪酸降解、线粒体自噬、p53信号通路和Toll样受体信号通路等代谢途径和信号通路显著富集。由上述研究分析发现,OGD/R组和正常组的差异主要集中在高尔基体,内质网,内吞体,线粒体自噬等方面,这些差异表明,氧糖剥夺再复氧的星形胶质细胞来源的外泌体可能参与高尔基体和内质网的形态改变及线粒体自噬过程。
缺血再灌注会引起一系列复杂的病理过程,包括炎症因子释放、氧化应激、线粒体自噬等,这一系列病理过程可导致神经元的损伤和凋亡[9]。星形胶质细胞作为神经系统含量最多的胶质细胞,可分泌含有核酸、蛋白质等物质的外泌体,对缺血再灌注的神经元功能产生一定的调控作用[13]。课题组前期研究结果证实,当神经细胞进行OGD/R后,会引起神经元氧化应激、线粒体自噬和细胞凋亡增加[14,15]。高尔基体作为一个在生物合成、蛋白质的分类和转运上发挥重要作用的细胞器,通过糖基化、蛋白质水解等方式对蛋白质进行加工修饰,有研究发现,当脑缺血再灌注后高尔基体可发生形态改变,参与转导应激信号,触发神经元凋亡[16,17]。本次研究发现,OGD/R的星形胶质细胞来源的外泌体miRNA的靶基因在高尔基体、高尔基体膜及蛋白质糖基化上富集,由此可知外泌体差异miRNA可能会通过影响高尔基体的形态和蛋白质的修饰来调控神经元凋亡。
线粒体是真核生物进行能量代谢、细胞分化和凋亡的重要场所,线粒体自噬可消除功能失调或冗余的线粒体,从而微调线粒体数量,维持能量代谢稳定,线粒体自噬也是缺血再灌注的一个主要病理过程[18]。有研究表明,星形胶质细胞分泌的外泌体可抑制由缺血缺氧引起的线粒体自噬[11],Hou J等人[19]发现,miR-106b-5p可以阻断线粒体融合蛋白2(mitofusin2,Mfn2),从而损害肝细胞线粒体结构和能量供应,有文献证实,miR-151-5p和miR-320-3P都能调节PI3K/AKT信号通路活性[20,21],PI3K/AKT可调节下游mTOR对线粒体自噬产生一定的调控作用。以上miRNA在本次研究OGD/R组均发生了改变,由此可知,OGD/R后星形胶质细胞外泌体可能是通过转运miRNA调控线粒体自噬过程。内吞体可参与物质转运、溶酶体和自噬小体的形成,进一步参与到缺血再灌注引起的线粒体融合分裂、自噬和炎症反应等病理过程中[22]。而内质网不仅在OGD/R引起的氧化应激发挥重要作用,其与线粒体组成的线粒体相关内质网膜(MAM)在线粒体自噬也发挥着重要作用[23],这些都与本次研究发现具有一致性。由此可知,OGD/R的星形胶质细胞来源外泌体miRNA,可能主要是通过调控神经元线粒体自噬和氧化应激等病理过程从而对氧糖剥夺的神经元产生调控作用。
本次研究在应用高通量测序技术对正常组和OGD/R组星形胶质细胞来源外泌体miRNA进行测序可知,线粒体自噬可能是显著差异表达miRNA参与的一条重要通路,且线粒体自噬通路在缺血再灌注的发病机制中也发挥了重要作用,这为下一步研究星形胶质细胞外泌体对神经元的具体机制提供了一定的基础。尽管本研究获得了差异表达基因的一些信息,但仍然存在一定的局限性,本研究仅限于基因水平,缺乏细胞水平及动物模型中的验证,课题组将在后期完善相关研究来进一步验证本次发现。

