超声造影结合弹性成像对甲状腺微小乳头状癌的诊断价值
张凯华
(太原市急救中心<太原市第九人民医院>超声科 山西 太原 030008)
甲状腺癌是临床常见且多发的恶性肿瘤,在头颈部恶性肿瘤中发病率居于首位,其中乳头状癌占所有类型的78%左右[1],甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)则多发生在甲状腺腺体内组织,病灶最大直径不超过1 cm,且起病隐匿,缺乏典型临床症状和影像学特征,体检触诊时难以察觉,而CT扫描、磁共振等影像学诊断方法的显示效果欠佳,导致诊断准确性低[2]。随着超声技术的进步,超声造影和弹性成像技术被应用到PTMC的诊断当中,并表现出特有优势,能用于对活体脏器良恶性肿瘤进行无创性评价,可提高PTMC的检出率和诊断准确性,但受病灶大小、诊断方法差异性和评价标准等因素的影响,导致超声造影和弹性成像的诊断结果出现差异[3]。因此以下将探讨超声造影结合弹性成像对PTMC的诊断价值,报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月—2022年2月太原市急救中心收治的疑似甲状腺微小乳头状癌患者66例为研究样本,其中男29例,女37例,年龄21~67岁,平均(41.48±9.47)岁,共79个结节,病灶直径0.3~0.9 cm,平均(0.52±0.12)cm。
纳入标准:①所有患者均经手术或穿刺病理检查确诊为PTMC,结节直径≤1 cm,临床资料完整;②经常规超声检查发现甲状腺背景为回声均匀的实质正常甲状腺组织;③所有患者均签署知情同意书。排除标准:①等回声、高回声结节;②心肺功能严重障碍,无法接受超声造影检查者;③造影剂过敏者;④依从性差者;⑤有精神病史者。
1.2 方法
仪器为迈瑞DC-N3S和迈瑞DC-8EXP彩色多普勒超声诊断系统,使用(3~13)MHz的全能高频探头,配有超声造影和弹性成像分析软件,机械指数0.06~0.08,造影剂为声诺维(生产商:Bracco Imaging B.V.,批准文号:国药准字J20030117),使用前先注入5 mL 0.9%氯化钠溶液并充分震荡,配置成微泡混悬液备用(六氟化硫浓度为8 μg/mL)。所有患者均接受超声造影和弹性成像诊断,检查时让患者保持仰卧位,充分暴露颈部皮肤,先进行常规二维超声和彩超诊断,明确甲状腺内结节大小、位置、形态、边界和内部回声,随后开启超声造影成像模式,探头频率设为(6~8)MHz,功率3%,灰阶46%,声压45 kPa,扫描深度为3~4 cm,将病灶下方设为聚焦点,肘部浅静脉穿刺后迅速团注1~3 mL造影剂混悬液,随后以生理盐水冲管,开启计时按钮,实时观察团注造影剂后2~3min的动态图像,储存图像。
启动弹性成像模式,选择病灶最佳显示切面,固定探头并让其与病灶垂直,施加轻度压力并振动,嘱咐患者保持平静呼吸,不要进行吞咽动作。压力指数维持在3~4,持续3~5 s后,病灶区会显示蓝绿两色,若病灶蓝色显色区范围>50%则以蓝色为主,绿色判断方式同蓝色,随后保存图像。
通过手术、细针穿刺细胞学检查获取病理结果,细针穿刺细胞学检查分为良性、可疑恶性、恶性、取材不满意、无法诊断,其中可疑恶性和恶性均判断为恶性,其余结果判断为良性。
1.3 观察方法
超声造影诊断标准:①增强模式分为均匀和不均匀增强;②增强强度分为低增强、高增强、等增强;③早期消退分为早期、无早期消退。良恶性判断为:持续低增强判断为恶性,等增强、无增强、高增强、环状增强判断为良性。
弹性成像诊断标准:囊性占病灶的主要成分,显色为红蓝绿,或蓝绿相间为0分;周围组织与病灶均呈现出均匀的绿色为1分;病灶绿色显示范围≥90%为2分;病灶为不规则蓝绿相间,且蓝色显色范围60%~90%为3分,病灶蓝色显示范围≥90%为4分。计算总积分,<3分为良性结节,≥3分为恶性结节。
联合诊断判定标准:超声造影、弹性成像均诊断为良性则最终判断为良性,若两种方法任意一种诊断为恶性则最终判断为恶性。
1.4 统计学方法
采用SPSS 20.0统计软件进行数据处理。正态分布的计量资料以(± s)表示,行t检验;计数资料以频数(n)、百分比(%)表示,行χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 病理诊断结果
66例患者共检出79个结节,包括45个良性结节,其中局灶性肉芽肿性炎1个、滤泡上皮细胞嗜酸性变4个、腺瘤状增生5个、甲状腺瘤9个、结节性甲状腺肿26个;恶性结节34个,均为PTMC,其中有12个合并颈部淋巴结转移的结节。
2.2 PTMC检测结果
超声造影检出PTMC结节26个、弹性成像检出PTMC结节25个,超声造影联合弹性成像共检出PTMC结节32个。见表1。
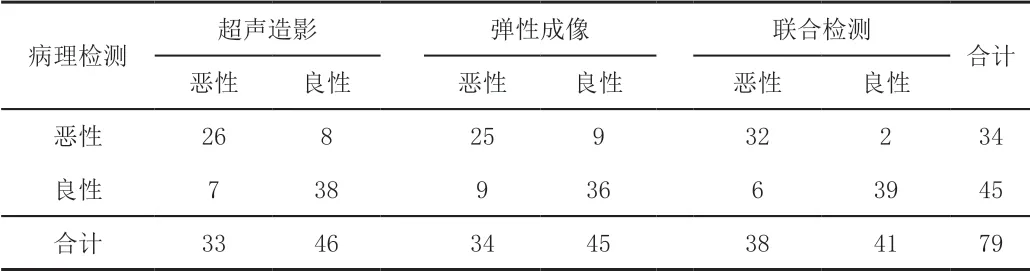
表1 超声造影、弹性成像、联合检测对PTMC的检测结果 单位:例
2.3 诊断效能比较
超声造影联合弹性成像检测PTMC的敏感度、准确性显著高于超声造影、弹性成像单项检测,且漏诊率显著低于单项检测(P<0.05);联合检测的特异度、误诊率与单项检测对比差异无统计学意义(P>0.05)。见表2。
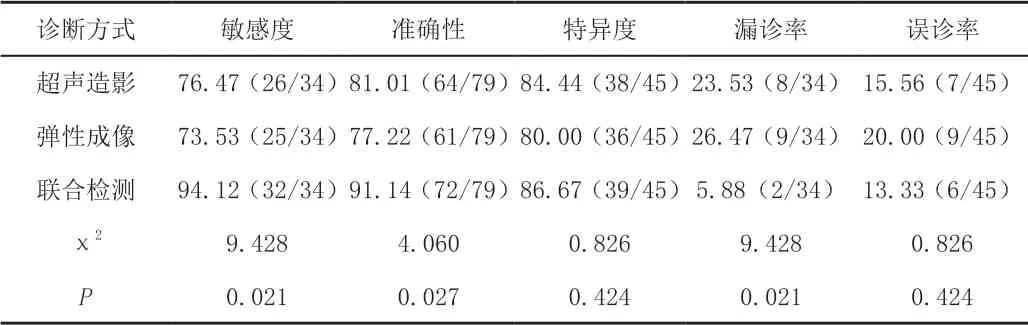
表2 超声造影、弹性成像、联合检测对PTMC的诊断效能[%(n/m)]
3 讨论
近年来PTMC发病率迅速增加,占新发甲状腺乳头状癌病例的36%以上[3],虽然PTMC呈缓慢进展,但仍有区域淋巴结转移和腺体内扩散风险,早期确诊并采取有效治疗对延缓PTMC进展有重要作用。PTMC缺乏显著临床特征,有75%的确诊患者在体格检查中漏诊,例如脖子粗短或直径2.0 cm以下的结节容易被漏诊[4]。病理诊断是PTMC的金标准,但无论是手术或是细胞学穿刺均属于有创检查,无创诊断仍需要借助影像学技术,放射性核素检查、CT、磁共振是目前主要影像学诊断方法,但价格昂贵且存在局限性,多应用于未分化甲状腺癌,或疑似远处转移的分化型甲状腺癌的诊断[5]。超声则具有操作简单、分辨率高、无创的优势,可对病灶进行实时动态扫查,是筛查恶性甲状腺结节的常用方法[6]。袁国胜等[6]认为PTMC的常规二维超声表现为直径≤1 mm的微钙化、低回声或实性回声、不规则形态、边界模糊、纵横比≥1等,50%的患者常规超声检查时可发现微小砂粒体,但体积过小难以形成反射界面,因此二维超声无法有效显示,或与良性小结节相互重叠,导致漏诊、误诊。
超声造影属于无创活体脏器良恶性诊断技术,通过背向散射原理提高病灶微血管结构的显示程度,从而提高PTMC的检出率,团注造影剂不仅可将甲状腺病灶区域血管走行、血供丰富程度以及周围血流灌注情况实时清晰地显示出来,并能显示病灶区域微血流灌注和消退顺序,可用于鉴别甲状腺结节的良恶性[7]。甲状腺恶性结节在超声造影中表现为最大灌注强度低、达峰时间晚、不均匀低增强等影像学特征,郝历红等[8]研究结果显示超声造影对PTMC的敏感度、准确性、特异度分别为87%、84%、80%,提示超声造影有利于甲状腺单发微小病灶的检出,尤其是病理检查诊断为不明确的结节;弹性成像是通过对病灶组织硬度进行评价,从而判断病灶良恶性的诊断方法,在无额外侵入性检查的条件下,弹性成像可通过对病变性质进行评估,从而提高具有可疑特征结节的确诊率[9]。弹性成像具体技术包括ARFI、RTE、SWE等[10],其中RTE技术对直径≤1 cm的甲状腺小结节良恶性鉴别的敏感度为87.5%,精确度高。在诊断PTMC时,需对被测组织外部施以压力,让组织发生形变,对形变程度进行检测,从而判断病灶性质[11]。甲状腺恶性结节浸润性生长,活动度差,且边界模糊,在弹性成像中可发现病灶整体为蓝色,弹性评分增加,可提高PTMC恶性结节的确诊率[12]。
本研究结果显示:超声造影检出PTMC结节26个、弹性成像检出PTMC结节25个,超声造影联合弹性成像共检出PTMC结节32个;超声造影联合弹性成像检测PTMC的敏感度(94.12%)、准确性(94.14%)高于超声造影(敏感度76.47%、准确性81.01%)、弹性成像(敏感度73.53%、准确性77.22%)单项检测,且联合检测漏诊率5.88%低于单项检测(超声造影23.53%,弹性成像26.47%),差异均有统计学意义(P<0.05)。原因分析为:①超声造影对直径<1 cm的甲状腺良恶性结节的血流灌注成像存在一定的重叠性,提示其诊断PTMC时存在局限性。王亚冬等[13]认为超声造影后PTMC病灶有乏血供特征,其原因与病灶体积过小,不具备恶性肿瘤血管的特征,例如血管分支多、管径和形态变异大、容易形成动静脉瘘等。也可能与病灶新生血管功效低,病灶介质水肿、纤维化、部分微血管关闭等因素有关[14],容易导致漏诊。此外,仪器调节、参数设置、造影剂操作等因素也可能导致超声造影结果失真[15];②良恶性结节弹性系数重叠会导致弹性成像诊断时误诊,其原因一方面为PTMC病灶由大量滤泡组织构成,滤泡组织间分化程度各异,若分化较好则恶性结节弹性系数与甲状腺正常组织相似,从而导致弹性分级降低。另一方面为炎症反应的刺激导致玻璃样、纤维化、钙化等病理变化,导致病灶硬度增加,影响诊断结果。病灶组织出血、坏死会导致硬度降低,出现假阴性。此外,弹性成像诊断时还会受患者颈动脉搏动和呼吸运动的影响,导致弹性系数缺乏准确性;③超声造影联合弹性成像诊断PTMC时可发挥协同效果,优势互补,从微血管结构、病灶区域血流灌注、病灶硬度差异等方面综合判断,从而鉴别良恶性结节,准确性更高,且能避免单项诊断的局限性,减少漏诊、误诊问题,为临床诊治提供可靠依据。
综上所述,超声造影联合弹性成像诊断能提高PTMC病灶的检出率,且敏感度、准确性较高,可减少单项技术诊断容易产生的漏诊问题,值得应用。

