氧糖剥夺不同时间再灌注后对PC12细胞炎症反应的影响
施诚龙,高永军,王 振,陈景策,陈 冲,徐 蔚
(昆明医科大学第二附属医院 神经外科,云南 昆明 650101)
缺血性卒中(Ischemic Stroke,IS)是世界范围内最重要的死亡和残疾原因之一[1]。在IS中,氧气和葡萄糖供应不足会在几小时内造成脑损伤,然而,脑卒中后缺血/再灌注引起的神经元损伤是一个多因素共同作用的过程,其中炎症反应是最主要的机制之一[2]。在IS后24 h内,循环中的白细胞能够穿透受损的脑实质,释放补体因子和炎性细胞因子,如白细胞介素-1受体相关激酶1(IL-1 receptor associated kinase 1,IRAK1)和TNF-a[3]。大鼠嗜铬细胞瘤细胞(Pheochromocytoma cells,PC12 cells)细胞是体外卒中模型中最常用的神经细胞系之一[4],本研究采用体外培养的PC12细胞制作氧糖剥夺再灌注(Oxygen-glucose deprivation/reperfusion,OGD/R)模型来模拟体内脑缺血再灌注损伤,观察不同时长OGD/R后PC12细胞的形态改变以及细胞炎症因子IRAK1和TNF-a在mRNA水平上的表达,以探讨OGD/R对PC12细胞炎症反应的影响。
1 材料和方法
1.1 材料
1.1.1 细胞、试剂、仪器
PC12细胞购自于中科院昆明细胞库,编号为KCB200736YJ。主要试剂:胎牛血清、DMEM培养基、CCK-8试剂盒;mRNA的实时荧光定量多聚酶链式反应(Quantitative Real-time PCR,QRT-PCR)使用SureScript-First-strand-cDNA-synthesis-kit试剂盒和BlazeTaqTMSYBR® Green qPCR Mix 2.0试剂盒;相关引物由生物公司合成。主要仪器:倒置显微镜、酶标板自动读数仪、实时荧光定量PCR仪。
1.2 方法
1.2.1 细胞培养
PC12细胞使用DMEM完全培养基在37 ℃、95%湿度、5% CO2的条件下培养,24 h换液,培养2~4 d传代。
1.2.2 OGD/R模型建立及分组
根据OGD的时间不同将实验细胞随机分为5组(每组均进行6次实验):Normal组、OGD 3 h组、OGD 6 h组、OGD 12 h组和OGD 24 h组。建立OGD/R模型:将原培养基换成无糖DMEM培养基培养于94% N2、5% CO2和1% O2条件下模拟PC12细胞OGD损伤,OGD不同时间培养之后换用完全培养基置于37 ℃、95%湿度、5% CO2恒温箱中复糖复氧继续培养24 h,于倒置显微镜下观察OGD不同时间再复糖复氧培养后PC12细胞形态学变化及处理送检。
1.2.3 CCK-8法检测细胞活力
将细胞以5×103/孔的密度接种于96孔细胞培养板,按上述干预后每孔加入10 μL CCK-8试剂,置于37℃、95%湿度、5% CO2的恒温箱中继续孵育2 h并用酶标仪测定在450 nm处的吸光值,计算细胞活性。
1.2.4 QRT-PCR检测mRNA表达水平
OGD/R处理后,收集细胞用Trizol法提取RNA,紫外分光光度计测定各样本中RNA浓度及纯度后将其反转录为cDNA,然后使用BlazeTaqTMSYBR®Green qPCR Mix 2.0试剂盒对cDNA进行实时定量扩增,PCR引物序列,见表1。采集记录荧光,制作扩增曲线和溶解曲线,读取Ct值,用2-△△Ct法计算基因的相对表达量。
1.3 统计学分析

2 结果
2.1 不同时长OGD/R后PC12细胞形态学改变
未进行OGD/R处理的PC12细胞在倒置显微镜下观察生长良好,形态正常,细胞间相互连接交织成网状,密度高,细胞体饱满舒展,折光性好,从胞体发出长短不一且有分枝的突起。进行OGD/R处理的细胞,随着OGD时间的延长,PC12细胞损伤逐渐明显且细胞密度逐渐降低,间隙增大,树突和轴突回缩,细胞皱缩变圆,体积变小,OGD 3 h后复糖复氧主要表现为细胞树突和轴突部分回缩,细胞固缩,OGD 6 h后复糖复氧细胞树突和轴突回缩较OGD 3 h明显且固缩更为严重,细胞部分漂浮,OGD 12 h和OGD 24 h后复糖复氧与前2组比较出现更为明显且范围更广的树突和轴突回缩及细胞固缩等结构破坏,有大量细胞碎片出现,见图1。
2.2 不同时长OGD/R后PC12细胞活性的改变
与Normal组相比OGD/R组细胞活力逐渐降低(P<0.05),Normal组和OGD 3 h组细胞存活率差异无统计学意义(P>0.05);OGD 6 h组、OGD 12 h组、OGD 24 h组与Normal组相比存活率明显降低(P<0.01),见表2、图2。

表2 CCK-8试剂盒检测不同时长OGD/R后PC12细胞活力
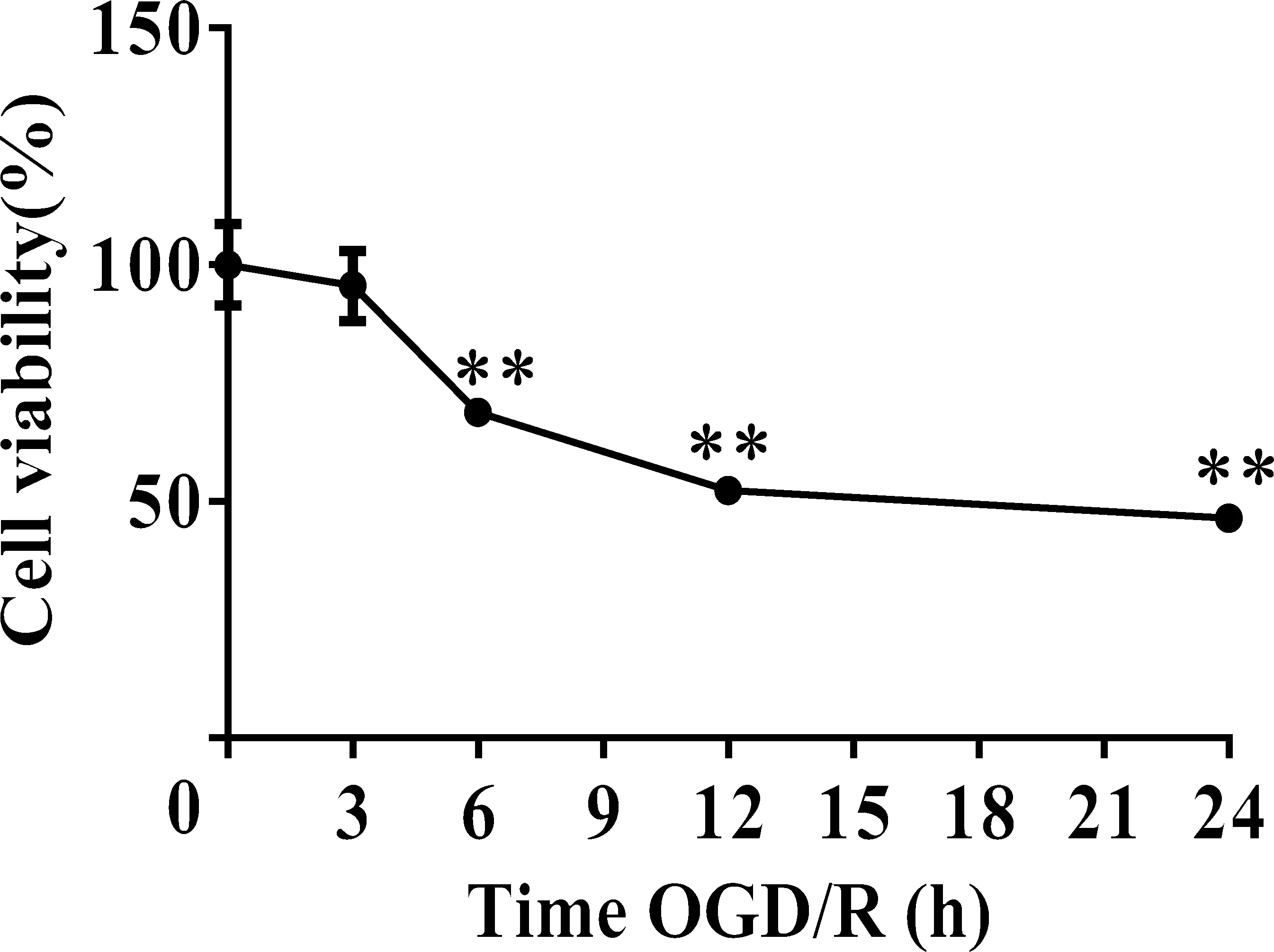
图2 CCK-8试剂盒检测不同时长OGD/R后PC12细胞活力
2.3 不同时长OGD/R后PC12细胞炎症因子的表达
与Normal组相比,OGD/R组细胞IRAK1和TNF-a在mRNA水平的表达升高,从OGD 6 h组开始IRAK1和TNF-a在mRNA水平的表达具有差异(P<0.05),在OGD 12 h组达到高峰,在OGD 24 h组出现回落,见表3、图3。

表3 QRT-PCR检测不同时长OGD/R后PC12细胞IRAK1和TNF-a在mRNA水平的表达
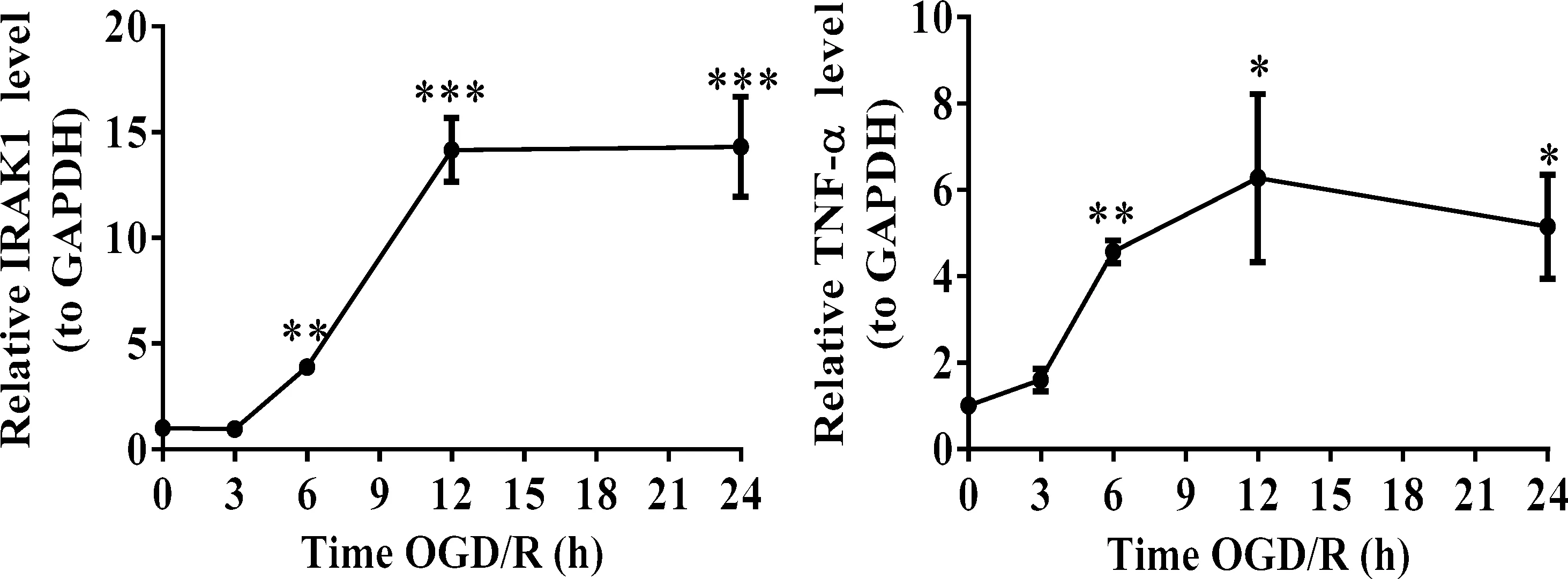
图3 QRT-PCR检测不同时长OGD/R后PC12细胞IRAK1和TNF-a在mRNA水平的表达
3 讨论
IS是最多见的中枢神经系统脑血管病之一,然而,影响IS病理生理和康复的决定因素还知之甚少,先前的研究已经确定了几种与IS有关的机制,其中,诱导缺血后炎症的先天免疫反应在IS进展中起着关键作用[5]。作为先天免疫的重要参与环节,促炎细胞因子IRAK1和TNF-a被认为在卒中的病理生理过程中扮演着尤为重要的角色[6,7]。髓系分化因子88招募IRAK4进而磷酸化IRAK1,最终导致下游的核因子-κB的激活和TNF-a的释放[8,9]。这些发现强调了IRAK1和TNF-a是调节免疫反应的重要靶点。在体外PC12细胞OGD/R模型中,OGD的时间是关键,OGD时间过长可能诱导过度的炎症反应导致细胞死亡,OGD时间过短则可能无法有效地诱导炎症反应。因此,对于OGD/R后PC12细胞炎症反应的相关研究很有必要,其中OGD的时间窗是关键的研究要点,也是后续研究PC12细胞炎症反应机制及IS后神经元保护的基础。
在本研究中,我们通过构建体外PC12细胞OGD/R模型以观察PC12细胞不同时间OGD/R后细胞形态学及炎症因子表达的变化,探讨神经元OGD不同时间后对炎症反应的影响。结果显示,倒置显微镜下观察未进行OGD/R处理的PC12细胞生长良好形态正常,进行OGD/R处理的细胞,随着OGD时间的延长,细胞损伤逐渐加重,主要表现为细胞树突和轴突回缩,细胞固缩死亡。相关研究报道,在缺血性脑损伤中,缺血后小鼠脑内蛋白的破坏程度及其对缺血结局的影响随其缺血时间的延长而增加[10,11],与本研究结果一致。本研究中,OGD 3 h细胞损伤没有明显变化,可能原因是OGD 3 h对PC12细胞是一个短暂的亚致死性阶段,因而再灌注不会导致太大的损伤。OGD 12 h后细胞损伤严重甚至大量死亡,说明合适的OGD时间至关重要。与Normal组相比OGD各组细胞活性随着时间的延长逐渐降低。相关研究报道,在OGD致PC12细胞损伤的体外模型中OGD导致细胞存活率显著下降[12],与本研究结果一致。我们进一步研究发现OGD组细胞中IRAK1和TNF-a的表达量明显增加,表明不同时长OGD/R后均可诱导PC12细胞的炎症反应,在OGD 6 h组开始有显著性差异,在OGD 12 h组达到高峰。相关研究报道,在体外建立PC12细胞OGD/R模型中缺氧缺血性脑病组炎症因子IRAK1和TNF-α表达均高于对照组,与本研究结果一致[12]。随着OGD时间的进一步延长导致大量自由基的产生进而氧化细胞膜磷脂中的不饱和脂肪酸,导致膜损伤,随后通过坏死或凋亡模式导致细胞大量死亡,故炎症因子的分泌反而减少,在OGD 24 h组出现回落。
综上所述,OGD 6 h后再复糖复氧能较好地在体外诱导PC12细胞炎症反应且对细胞损伤较小,故推荐在体外OGD模型研究中OGD的时长采用6 h为宜。这对于后续神经炎症相关干预措施的选择研究及对缺血性卒中神经元保护的研究具有重要指导价值。

