Z-没药甾酮基于PI3K/AKT通路化瘀解毒抗缺血性脑卒中的作用及机制
刘天龙,王文军,陈 伟,蔺发聪,刘 润,席 宁,吕 静,吕培霖
(1.解放军联勤保障部队第九四〇医院,甘肃 兰州 730050;2.空军军医大学西京医院,陕西 西安 710032;3.解放军联勤保障部队第九四四医院,甘肃 酒泉 735000)
缺血性脑卒中是临床常见的脑血管疾病,具有高发病率、高致残率和高病死率的特点[1]。该病的首选急救措施是溶栓,但因治疗窗口仅有4~6 h,严重制约了其应用[2]。中医药在缺血性脑卒中的防治中理论基础雄厚、实践经验丰富,具有独特优势。缺血性脑卒中属“血瘀证”范畴,瘀血阻络、毒损脑络是其主要病机,故化瘀解毒是中医药对缺血性脑卒中的主要治则之一[3-5]。现代生理病理学研究发现,磷酸肌醇-3-羟激酶(PI3K)/蛋白激酶B(Akt)通路在缺血性脑卒中的发生发展中发挥重要作用,其可通过调控下游靶蛋白内皮型一氧化氮合酶(eNOS)和Nrf2,分别发挥调节血流变、减轻氧化应激损伤的脑保护作用[6-7],这与中药“化瘀解毒”功效不谋而合。没药(Myrrha)属活血化瘀中药,是防治缺血性脑卒中中药方剂的常用组方药物。Z-没药甾酮是没药的主要活性物质[8-9],其是否可通过PI3K/Akt通路发挥化瘀解毒的作用尚不清楚。本研究分别从血管活性物质和氧化应激层面,研究了Z-没药甾酮对缺血性脑卒中大鼠的保护作用,旨在进一步揭示Z-没药甾酮保护脑缺血损伤的分子机制,丰富中医药化瘀解毒理论的现代科学内涵,为缺血性脑卒中提供新的药物治疗思路和理论依据。
1 实验材料与方法
1.1实验动物 SPF级8周龄雄性SD大鼠60只,体重(250±10)g,购于联勤保障部队第九四〇医院实验动物科,动物使用许可证号:SYXK(军)2017-0047。饲养环境:温度(25±2)℃,湿度(50±10)%,12 h照明,自由饮食。所有实验程序已获伦理委员会批准(2020KYLL058)并遵守国内外动物实验相关规范。
1.2药品与试剂 实验用Z-没药甾酮(美国Santa Cruz公司,纯度≥98 %);线栓(美国Doccol公司);TTC试剂(美国Sigma公司);内皮素-1(ET-1)、血栓素B2(TXB2)、血栓调节蛋白(TM)、6-酮-前列环素1α(6-keto-PGF1α)试剂盒及二甲基亚砜(DMSO)溶剂(热默尔生物科技有限公司);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒(南京建成生物工程研究所);活性氧簇(ROS)试剂盒(上海贝博生物科技有限公司);PI3K、磷酸化蛋白激酶B(p-Akt)、Nrf2、磷酸化内皮型一氧化氮合酶(p-eNOS)抗体(美国Abcam公司)。
1.3实验方法 将大鼠随机分为假手术组、模型组、Z-没药甾酮低剂量组、Z-没药甾酮中剂量组、Z-没药甾酮高剂量组,每组12只。模型组和Z-没药甾酮各组大鼠采用经典的大脑中动脉阻闭法(MCAO)建立缺血性脑卒中模型:在颈正中处切口,暴露大鼠右侧颈总动脉,分别结扎颈总和颈内外动脉,于颈内外动脉分叉下方剪开,从切口中缓缓插入线栓,进线约18 mm时到达脑中动脉。假手术组只暴露血管,不放入线栓。造模全过程中,通过肛温监测确保大鼠的体温维持在37 ℃。Z-没药甾酮低、中、高剂量组大鼠分别于术前30 min给予25 mg/kg、50 mg/kg、100 mg/kg Z-没药甾酮(用DMSO溶解,确保给药时DMSO终浓度<5%)腹腔注射,其余组大鼠给予等量DMSO腹腔注射,术后均继续干预3 d。
1.4检测指标及方法
1.4.1神经功能评分 末次干预结束后,根据Longa评分方法对各组大鼠进行单盲评分。0分:无神经功能损伤;1分:左前肢不能完全伸展;2分:行走时大鼠向左侧转圈;3分:行走时大鼠向左侧倾倒;4分:无自发活动,有意识障碍。评分越高提示神经功能损伤越严重。
1.4.2脑梗死体积和脑含水量 采用30 mg/kg戊巴比妥钠麻醉大鼠,腹主动脉取血后断头处死。每组随机取6只大鼠大脑,称重获得湿重后,将大脑放入预冷的脑槽中,从人字缝分叉处开始,切成2 mm厚冠状切片。脑片在37 ℃下浸泡于2 % TTC溶液中约15 min,待脑片染成粉红色后,用10%多聚甲醛固定24 h。染色后缺血区(脑梗死)颜色为白色,非缺血区为红色,测量并计算总梗死体积。梗死体积的水肿校正通过以下公式计算:梗死体积比=(左侧正常组织-右侧正常组织)/左侧正常组织。TTC染色结束后将所有大脑组织在110 ℃下干燥24 h,获得干重,计算脑含水量,脑含水量=(湿重-干重)/湿重×100%。
1.4.3全血黏度和凝血参数 用肝素锂采血管采集2 mL腹主动血,用锥板黏度计在37 ℃下测1/s、5/s、30/s、200/s剪切率下的全血黏度。用3.8 %柠檬酸钠采血管采集2 mL腹主动血,采用自动凝血仪测定凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)水平。所有检测在采血后3 h内完成。
1.4.4血清血管活性物质和氧化应激指标水平 腹主动脉取血,按照试剂盒操作说明检测血管活性物质ET-1、TXB2、TM、6-keto-PGF1α和氧化应激指标SOD、GSH-Px、CAT、ROS、MDA水平。
1.4.5脑组织中PI3K、p-Akt、Nrf2和p-eNOS蛋白表达情况 采用免疫组化法检测:取各组6只大鼠脑组织进行石蜡包埋并切片,依次用二甲苯和酒精脱蜡脱水,放入0.3 %甲醇-H2O2液中,室温孵育30 min,消除内源性过氧化物酶活性。切片放入pH 6.0的枸橼酸抗原修复液中,高压锅煮沸2 min,静置18 min,自然冷却至室温。滴加山羊血清封闭液孵育30 min,轻轻甩去。加入相应一抗后放4 ℃冰箱过夜孵育,洗涤后加入二抗,室温下孵育1 h。用DBA显色后,加苏木素复染。最后脱水、封片。单盲条件下观察拍照,在各样本切片中随机选取5个视野,用Image Pro Plus 6.0软件测量光密度值。
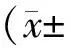
2 结 果
2.1各组大鼠神经功能评分比较 模型组及Z-没药甾酮低、中、高剂量组大鼠神经功能评分分别为(3.17±0.72)分、(2.50±0.67)分、(2.00±0.74)分、(1.92±0.67)分,Z-没药甾酮各剂量组大鼠神经功能评分均显著低于模型组(P均<0.05),Z-没药甾酮中、高剂量组比较差异无统计学意义(P>0.05)。
2.2各组大鼠脑梗死体积和脑含水量比较 模型组大鼠脑梗死体积和脑含水量均显著高于假手术组(P均<0.05)。Z-没药甾酮中、高剂量组大鼠脑梗死体积、脑含水量均显著低于模型组(P均<0.05),Z-没药甾酮中、高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表1。
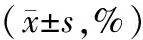
表1 假手术组和缺血性脑卒中各组大鼠脑梗死体积和脑含水量比较
2.3各组大鼠全血黏度比较 模型组大鼠不同切变率下全血黏度均显著高于假手术组(P均<0.05)。Z-没药甾酮中、高剂量组大鼠不同切变率下全血黏度及Z-没药甾酮低剂量组1/s和30/s切变率下全血黏度均显著低于模型组(P均<0.05),Z-没药甾酮中、高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表2。
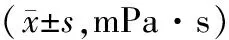
表2 假手术组和缺血性脑卒中各组大鼠全血黏度比较
2.4各组大鼠凝血参数比较 与假手术组比较,模型组大鼠TT、PT、APTT均显著缩短(P均<0.05),FIB水平显著升高(P<0.05)。与模型组比较,Z-没药甾酮中、高剂量组大鼠TT、PT、APTT及Z-没药甾酮低剂量组大鼠APTT均显著延长(P均<0.05),Z-没药甾酮各剂量组大鼠FIB水平均显著降低(P均<0.05);Z-没药甾酮中、高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表3。
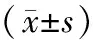
表3 假手术组和缺血性脑卒中各组大鼠凝血参数比较
2.5各组大鼠血管活性物质水平比较 与假手术组比较,模型组大鼠血清ET-1和TXB2水平均显著升高(P均<0.05),TM和6-keto-PGF1α水平均显著降低(P均<0.05)。与模型组比较,Z-没药甾酮中、高剂量组大鼠血清ET-1和TXB2水平均显著降低(P均<0.05),TM和6-keto-PGF1α水平均显著升高(P均<0.05),Z-没药甾酮低剂量组大鼠仅血清ET-1水平显著降低(P<0.05);Z-没药甾酮中、高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表4。
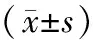
表4 假手术组和缺血性脑卒中各组大鼠血清血管活性物质水平比较
2.6各组大鼠氧化应激指标水平比较 与假手术组比较,模型组大鼠血清SOD、GSH-Px、CAT水平均显著降低(P均<0.05),ROS和MDA水平均显著升高(P均<0.05)。与模型组比较,Z-没药甾酮中、高剂量组大鼠血清SOD、GSH-Px、CAT水平及Z-没药甾酮低剂量组大鼠SOD水平均显著升高(P均<0.05),Z-没药甾酮各剂量组大鼠ROS和MDA水平均显著降低(P均<0.05);Z-没药甾酮中、高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表5。
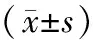
表5 假手术组和缺血性脑卒中各组大鼠血清氧化应激指标水平比较
2.7各组大鼠脑组织PI3K/Akt通路蛋白表达情况比较 免疫组化染色结果显示,假手术组各蛋白在脑组织中呈现大面积棕黄色染色;相比于假手术组,模型组免疫组化染色深度降低,阳性染色细胞数量减少;Z-没药甾酮各剂量组各蛋白免疫组化染色较模型组加深。量化结果显示,模型组大鼠脑组织中PI3K、p-Akt、Nrf2和p-eNOS蛋白表达光密度值均显著低于假手术组(P均<0.05),Z-没药甾酮各剂量组大鼠各蛋白表达光密度值均显著高于模型组(P均<0.05)。见图1及表6。

表6 假手术组和缺血性脑卒中各组大鼠脑组织中PI3K/Akt通路相关蛋白表达光密度值比较
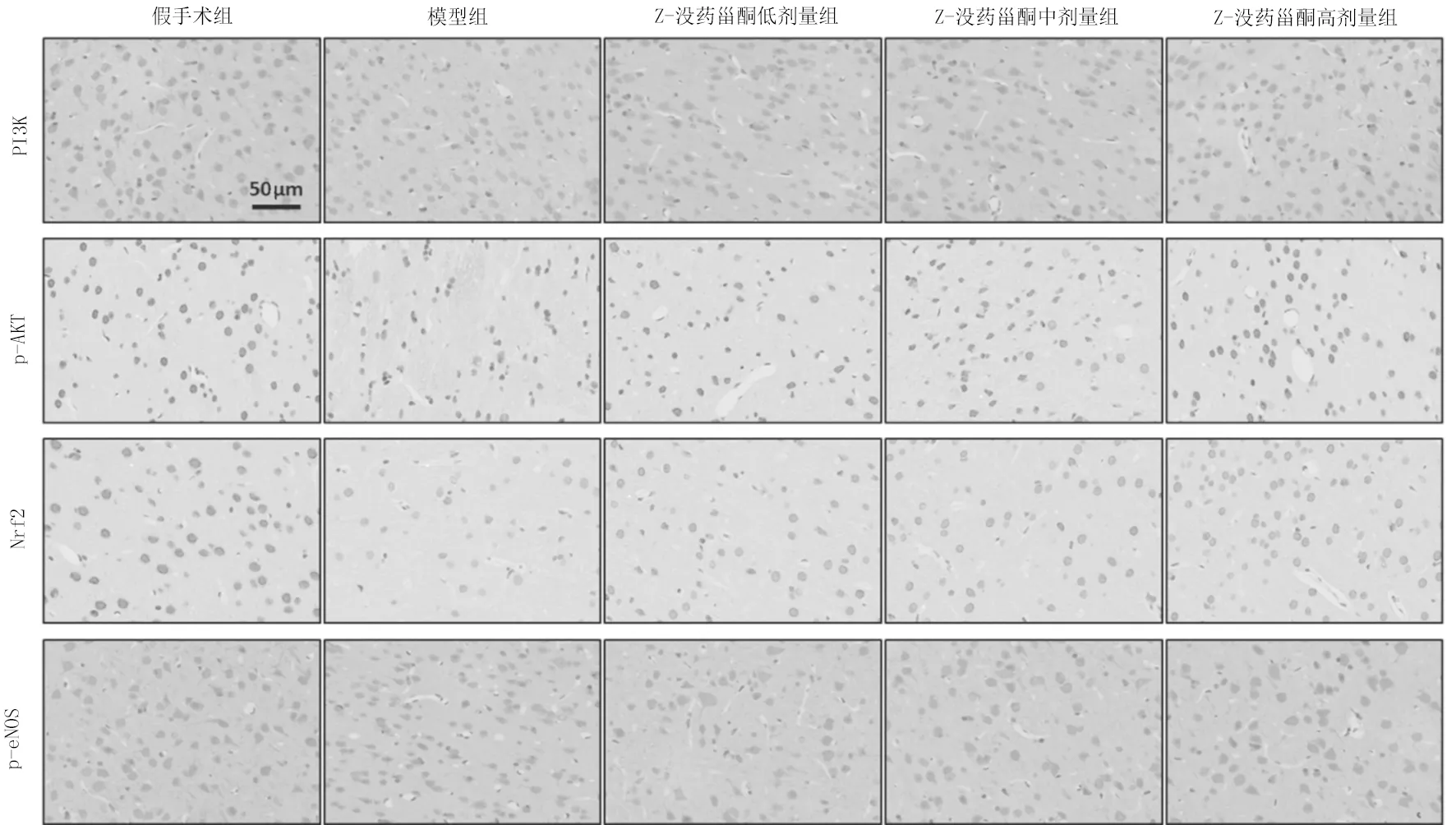
图1 假手术组和缺血性脑卒中各组大鼠脑组织中PI3K/Akt通路相关蛋白表达情况(免疫组化染色,×200)
3 讨 论
脑卒中是指由于脑血流紊乱引起的急性缺血性或出血性脑病。缺血性脑卒中是最常见的脑卒中类型,约占临床卒中总发病率的87%,其特点是血栓形成或栓塞导致血流突然丧失,阻塞供应大脑特定区域的脑血管[10]。缺血性脑卒中是永久性残疾的主要原因,给患者家庭和社会带来沉重负担。近些年中医药现代化发展成果瞩目,在心脑血管疾病的临床治疗中受到国内外的重视和认可[11]。
根据中医理论,缺血性脑卒中属“血瘀证”范畴,活血化瘀的治疗思想最早见于《黄帝内经》。经过历代医家的实践探索,该理论思想不断丰富和发展,逐渐形成了系统、全面的理法方药诊疗体系[12]。有诸多中医药理论研究认为,“瘀血阻络”和“毒损脑络”是脑血管栓塞疾病的主要病机。“瘀”和“毒”在机体发生复杂的交互作用,既是病证的病理产物,同时也继发成为病证的重要诱因。“血瘀”是指病变机体的血液在体内外诱因的影响下,发生“黏、浓、凝、聚”,若瘀聚集于头则诱发缺血性脑卒中。现代中医研究将“血瘀”划分为“有形”和“无形”两类,其中血液黏度增高、血流动力学失常为“无形之瘀”。因此,改善血流变及调节血管收缩活性物质水平与“化瘀”功效是内在统一的。本实验中,大鼠造模后血液黏度增高,凝血时间缩短,ET-1和TXB2水平显著升高,TM和6-keto-PGF1α水平显著降低,表明造模诱导了大鼠“血瘀”状态;Z-没药甾酮给药后,以上指标均不同程度恢复,体现了Z-没药甾酮的“化瘀”功效。另一方面,“瘀”导致组织灌注减少,会诱发体内的“毒”。王永炎院士认为,在缺血性脑卒中病理机制中,“毒邪”发挥重要作用,在此基础上提出了缺血性脑卒中“毒损脑络”的病机假说[13]。体现在微观层面,“毒损脑络”与机体氧化应激反应导致脑损伤是一致的。而诸多中药可通过抗氧化应激改善脑缺血损伤[14]。因此,抗氧化应激与“解毒”功效是内在统一的。本实验中,大鼠造模后血清SOD、GSH-Px、CAT水平显著降低,ROS和MDA水平显著升高,提示缺血性脑卒中大鼠体内“毒邪”滋生;Z-没药甾酮给药后,血清SOD、GSH-Px、CAT水平升高,ROS和MDA水平降低,表明Z-没药甾酮可通过“解毒”发挥保护作用。
PI3K/Akt是经典的抗凋亡、促存活信号通路,在脑梗死等血管性疾病中发挥重要调节作用。生理状况下,PI3K的活化和钝化处于平衡状态,活化的PI3K可使Akt发生磷酸化,p-Akt进一步调节下游靶蛋白eNOS和Nrf2的激活,参与细胞发育、生长和分化[15]。研究发现,MCAO大鼠脑组织中p-Akt表达减少,而中药可通过激活PI3K/Akt通路缓解缺血性脑损伤[16]。在PI3K-/-小鼠MCAO模型和siRNA-PI3K转染的皮质神经元氧糖剥夺模型中,脑梗死体积增大,细胞凋亡增加,表明PI3K/Akt是脑缺血损伤中的重要调节通路[17]。eNOS主要存在于内皮细胞中,是NO的限速酶,其可通过调节血管张力和血流分布,对心脑血管疾病产生直接影响[18]。通过激活eNOS通路,可显著减轻血管内皮损伤[19]。课题组前期研究也发现,在血瘀证大鼠模型中,肠系膜动脉舒张功能减弱,血管内皮受损,同时伴随p-eNOS和NO水平降低[20]。Nrf2是存在于各种细胞类型中的一种转录因子,机体在稳态条件下,Nrf2与过Keap1在细胞内以非活性形式存在[21];在应激条件下,Nrf2与Keap1解离并易位到细胞核中,结合到DNA上的抗氧化反应原件区,调控其下游靶基因抗氧化酶的转录,从而发挥抗氧化应激作用[22]。本实验免疫组化染色发现,Z-没药甾酮给药可上调缺血性脑卒中大鼠脑组织中PI3K、p-Akt、Nrf2和p-eNOS蛋白表达,提示Z-没药甾酮发挥脑保护作用是通过PI3K/Akt通路及其介导的Nrf2和eNOS途径实现的。
综上所述,Z-没药甾酮可通过活化PI3K/Akt通路及其下游Nrf2和eNOS途径,分别从血管活性物质和氧化应激两个层面发挥“化瘀解毒”的脑缺血损伤保护作用。
利益冲突:所有作者均声明不存在利益冲突。

