人参皂苷Rb1激活HRD1信号通路对动脉粥样硬化内皮细胞凋亡的影响*
任丽,吴锡骅,刘婷,梅益彰,苏施雅
(佛山复星禅诚医院,广东 佛山 528031)
动脉粥样硬化是多种疾病发展的主要原因,如脑卒中、心肌梗死和外周动脉疾病,氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是动脉粥样硬化发展的重要触发因素[1-2]。动脉粥样硬化是脑卒中发生的主要原因之一,由它引起的脑卒中具有非常高的发病率和致残率[3-4]。研究发现,阻止内皮细胞凋亡可以抑制动脉粥样硬化进展[5];人参皂苷Rb1(ginsenoside Rb1,GRb1)是人参皂苷的主要成分,具有多种生物活性,包括抗氧化应激、抗炎等[6],GRb1可通过抑制细胞凋亡对ApoE-/-小鼠早期动脉粥样硬化发挥抑制作用[7],但其抑制内皮细胞凋亡的具体机制尚不完全清楚。有研究表明,羟甲基戊二酰辅酶A还原酶降解蛋白1(hydroxymethylglutaryl-goA reductase degradation protein 1,HRD1)参与动脉粥样硬化的发生,在患者中呈低表达状态[8];有报道GRb1可通过激活HRD1信号通路从而减轻小鼠结肠炎症状[9];但GRb1能否通过调控HRD1信号通路抑制动脉粥样硬化介导的内皮细胞凋亡尚不明确。因此,本研究利用ox-LDL处理人主动脉内皮细胞(human aortic endothelial cells,HAECs)构建动脉粥样硬化细胞模型,探究GRb1对动脉粥样硬化介导的内皮细胞凋亡的影响以及作用机制。
1 材料与方法
1.1 材料
1.1.1细胞来源 人主动脉内皮细胞HAECs(上海启达生物,货号ACBRI 375)。
1.1.2主要试剂 HRD1小干扰RNA(si-HRD1)及其阴性对照si-NC购自北京百泰派克生物科技有限公司,CCK-8试剂盒(货号YT8193)购自北京伊塔生物科技有限公司,双染细胞凋亡检测试剂盒(上海高创化学科技有限公司,货号G003-1),丙二醛(malondialdehyde,MDA)试剂盒(上海西唐生物科技有限公司,货号F01963),超氧化物歧化酶(super oxide dismutase,SOD)试剂盒(北京杰辉博高生物技术有限公司,货号JM-ELISA-15098)。兔源一抗HRD1(货号ab170901)、B细胞淋巴瘤-2(b-cell lymphoma 2,Bcl-2,货号ab32124)、半胱氨酸天冬氨酸蛋白酶3(cysteine aspastic acid-specific protease 3,Caspase-3,货号ab184787)、B细胞淋巴瘤-2相关X蛋白(bcl-2-associated X,Bax,货号ab32503)、GAPDH(货号ab9485)、辣根过氧化物酶(HRP)标记的山羊抗兔二抗(货号ab97051)购于Abcam公司。
1.2 研究方法
1.2.1细胞培养及分组 将HAECs细胞置于含有10% FBS的DMEM培养基中,在37 ℃、5% CO2条件下培养,收集对数生长期的HAECs细胞,将其分为正常对照组(NC组)、模型组、GRb1组、GRb1+si-NC组(si-HRD1阴性对照组)和GRb1+si-HRD1组。其中模型组、GRb1组、si-HRD1阴性对照组和GRb1+si-HRD1组HAECs细胞分别对应用0 μmol/L GRb1、50 μmol/L GRb1[10]、50 μmol/L GRb1+转染si-NC、50 μmol/L GRb1+转染si-HRD1[8]处理12 h后,加入100 μg/mL ox-LDL[11]处理24 h。NC组细胞正常培养,不做任何处理。
1.2.2HAECs细胞活力 将HAECs细胞以5×103个/100 μL的密度接种到96孔板中,经过相应的药物处理后,将10 μL CCK-8溶液加入每个孔中,并在37 ℃下孵育4 h;使用酶标仪检测450 nm处的OD值来评估细胞活力。细胞活力(%)=[(实验组OD值-空白组OD值)/(NC组OD值-空白组OD值)]×100%。
1.2.3氧化应激指标的检测SOD和MDA表达 除去各组细胞培养液,用PBS洗涤3次后,加入含有10 μmol/L 2′,7′-二氯荧光黄双乙酸盐的DMEM培养液,在37 ℃下孵育30 min后,利用荧光显微镜观察细胞在激发波长为488 nm、发射波长为525 nm处的荧光强度,通过荧光强度的强弱反映细胞内的活性氧(ROS)水平;按照SOD、MDA试剂盒说明书操作步骤检测细胞裂解液中SOD、MDA水平。
1.2.4HAECs细胞凋亡 收集各组HAECs细胞,并用PBS洗涤2次,再向细胞中加入100 μL 1×结合缓冲液、5 μL Annexin V-FITC和5 μL PI,室温下孵育15 min,然后再加入100 μL 1×结合缓冲液,利用流式细胞仪分析细胞凋亡情况。
1.2.5Caspase-3、Bax、Bcl-2、HRD1蛋白表达 将细胞用PBS洗涤2次后,裂解提取总蛋白。加入抗体Caspase-3(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、HRD1(1∶2 000)、GAPDH(1∶1 000),山羊抗兔二抗(1∶2 000)在室温下孵育1 h,通过ECL化学发光试剂盒检测蛋白质条带显色情况,通过ImageJ软件对蛋白质条带的灰度值进行定量。
1.3 统计学分析
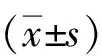
2 结果
2.1 HAECs细胞活力
与NC组比较,模型组HAECs细胞活力降低,差异有统计学意义(P<0.05);与模型组比较,GRb1组HAECs细胞的活力升高,差异有统计学意义(P<0.05);与GRb1组、si-HRD1阴性对照组比较,GRb1+si-HRD1组HAECs细胞活力降低,差异有统计学意义(P<0.05)。见表1。
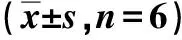
表1 各组HAECs细胞活力比较
2.2 SOD、ROS、MDA水平
与NC组比较,模型组SOD水平降低,ROS、MDA水平则呈升高的趋势,差异有统计学意义(P<0.05);与模型组比较,GRb1组SOD水平升高,ROS、MDA含量降低,差异有统计学意义(P<0.05);与GRb1组、si-HRD1阴性对照组比较,GRb1+si-HRD1组SOD水平显著降低,MDA、ROS水平升高,差异有统计学意义(P<0.05)。见图1和表2。
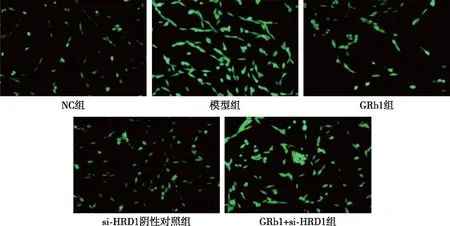
图1 各组HAECs细胞内ROS表达(荧光法,×100)
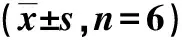
表2 各组HAECs细胞中SOD、MDA水平
2.3 HAECs细胞凋亡
与NC组比较,模型组HAECs细胞凋亡率升高,差异有统计学意义(P<0.05);与模型组比较,GRb1组HAECs细胞凋亡率降低,差异有统计学意义(P<0.05);与GRb1组、si-HRD1阴性对照组比较,GRb1+si-HRD1组HAECs细胞凋亡率升高,差异有统计学意义(P<0.05)。见图2和表3。
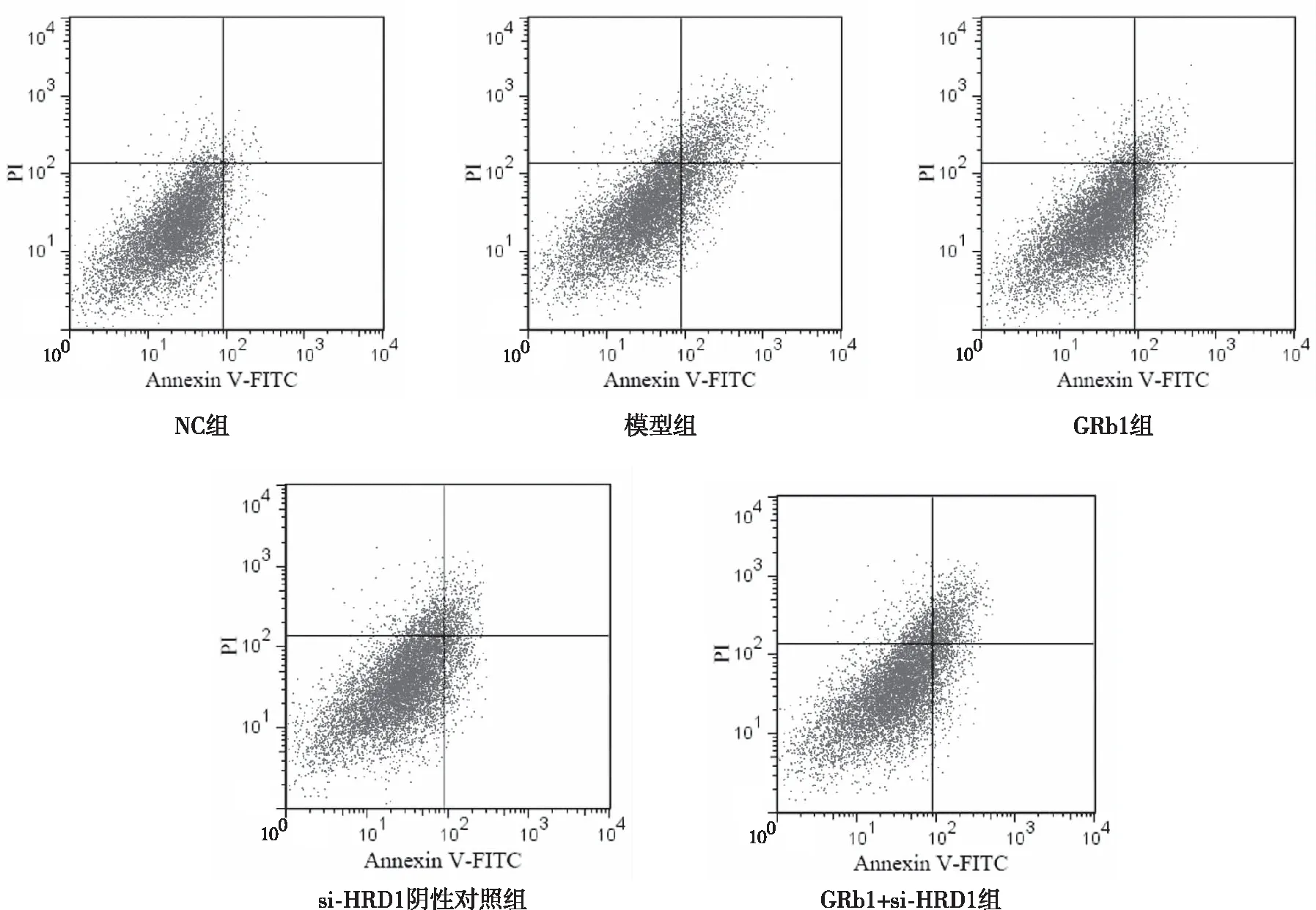
图2 流式细胞仪分析各组HAECs细胞凋亡情况
表3 各组HAECs细胞凋亡率比较
2.4 Caspase-3、Bax、Bcl-2蛋白表达
与NC组比较,模型组HAECs细胞中Caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,GRb1组HAECs细胞中Caspase-3、Bax蛋白表达降低,Bcl-2蛋白表达升高,差异有统计学意义(P<0.05);与GRb1组、si-HRD1阴性对照组比较,GRb1+si-HRD1组HAECs细胞中Caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低,差异有统计学意义(P<0.05)。见图3和表4。
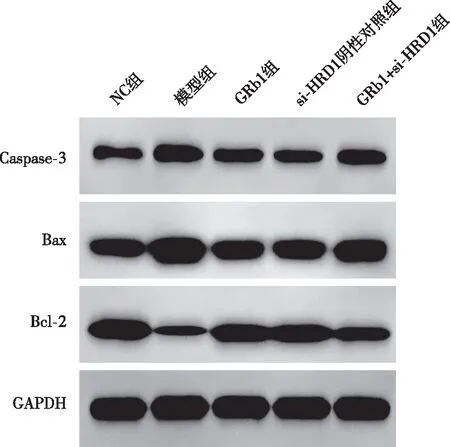
图3 Western blot检测HAECs细胞中Caspase-3、Bax、Bcl-2蛋白表达
表4 各组HAECs细胞中Caspase-3、Bax、Bcl-2蛋白表达
2.5 HRD1通路相关蛋白在HAECs细胞中的表达
与NC组比较,模型组HAECs细胞中HRD1蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,GRb1组HAECs细胞中HRD1蛋白表达升高,差异有统计学意义(P<0.05);与GRb1组、si-HRD1阴性对照组比较,GRb1+si-HRD1组HAECs细胞中HRD1蛋白表达降低,差异有统计学意义(P<0.05)。见图4和表5。

图4 Western blot检测HAECs细胞中HRD1蛋白表达
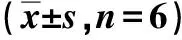
表5 各组HAECs细胞中HRD1蛋白表达
3 讨论
动脉粥样硬化是脑血管疾病发生的主要原因。大量研究证实,ox-LDL是动脉粥样硬化发生和发展的关键因素,ox-LDL通过与低密度脂蛋白受体1结合诱导ROS大量产生,大量的ROS可以进一步上调ox-LDL的形成并激活脂质过氧化,这可能导致细胞凋亡和氧化应激增加[12-13]。有研究报道,ROS的增加会促使血管内皮细胞氧化应激增加,与动脉粥样硬化的发生发展有相关性[14];SOD、MDA分别作为衡量机体抗氧化、氧化能力的重要指标,已有研究显示在动脉粥样硬化大鼠血清中,MDA含量上升,SOD活性下降[15]。本研究发现,与NC组比较,模型组HAECs细胞中SOD水平显著降低,ROS、MDA水平则显著升高,提示ox-LDL诱导的HAECs细胞氧化应激增加。Zhang等[16]研究发现,ROS诱导的氧化应激增加,最终会促进血管内皮细胞的凋亡。作为细胞凋亡的标志性蛋白,Bcl-2可促进细胞存活,Bax会增加细胞凋亡,而Caspase-3作为调节中心来控制细胞凋亡的发生,且在进一步激活凋亡酶方面发挥核心作用[17-18]。与NC组比较,模型组HAECs细胞活力、Bcl-2蛋白相对表达量显著降低,细胞凋亡率、Caspase-3、Bax蛋白相对表达量显著升高,表明ox-LDL诱导的HAECs细胞存在大量凋亡现象。以上结果提示,ox-LDL诱导的动脉粥样硬化细胞模型构建成功。GRb1是从人参中提取的主要活性成分之一[19-20],近年来发现GRb1还具有强大的血管保护潜力[21-22]。如GRb1可抑制大鼠球囊损伤引起的颈动脉新生血管内膜增生[23];GRb1可促进受损颈动脉的再内皮化[24];GRb1在动脉粥样硬化患者中有稳定斑块的作用[25]。而关于GRb1对动脉粥样硬化介导的内皮细胞凋亡的影响鲜有报道。本研究结果显示,与模型组比较,HAECs细胞经GRb1处理后活力升高,氧化应激减弱,细胞凋亡率显著降低,提示GRb1可能通过抑制氧化应激降低ox-LDL诱导的动脉粥样硬化内皮细胞凋亡。HRD1是一种E3泛素连接酶,已有研究报道,上调HRD1表达可抑制ox-LDL诱导的内皮细胞凋亡[8];高表达的HRD1能够抑制ox-LDL导致的人脐静脉血管内皮细胞凋亡[26]。而GRb1能否通过调控HRD1通路抑制ox-LDL诱导的HAECs细胞凋亡尚不清楚。本研究结果显示,与NC组对比,模型组HAECs细胞中HRD1蛋白相对表达量显著降低,推测HRD1通路可能参与了ox-LDL诱导的动脉粥样硬化内皮细胞凋亡过程。与模型组比较,GRb1组HAECs细胞中HRD1蛋白相对表达量显著升高,推测GRb1可能通过激活HRD1通路抑制低ox-LDL诱导的内皮细胞凋亡。为了验证该推测,本研究利用HRD1小干扰RNA进行干预,结果显示,与GRb1组比较,GRb1+si-HRD1组HAECs细胞中HRD1蛋白相对表达量、细胞活力降低,氧化应激增强,细胞凋亡率升高,表明si-HRD1可逆转GRb1对ox-LDL诱导的动脉粥样硬化内皮细胞凋亡的抑制作用。
综上所述,GRb1可能通过激活HRD1通路抑制氧化应激,进而抑制ox-LDL诱导的动脉粥样硬化内皮细胞凋亡。然而关于GRb1调节ox-LDL诱导的动脉粥样硬化内皮细胞凋亡涉及的通路较多,有待后续实验进一步深入探究。

