哌嗪取代嘧啶衍生物的合成及其抗菌活性*
贾学敏,程铖,刘丽娅,聂久伟,付恒建,汤磊,,杨元勇*
(1.贵州医科大学 药学院,贵州 贵阳 550004;2.贵州省化学合成药物研发利用工程技术研究中心,贵州 贵阳 550004)
在过去的几十年中,许多含氮杂环在药物设计中发挥了重要作用。嘧啶环被认为是药物化学中的一种特殊结构,以嘧啶为核心的化合物具有多种类型的生物和药物活性,嘧啶衍生物常被作为抗菌剂、抗病毒剂及抗肿瘤剂等[1-4]。Nagender等[5]研究开发了一系列新的吡唑[3,4-b]吡啶和嘧啶功能化1,2,3-三唑衍生物,抗菌结果表明该系列化合物在金黄色葡萄球菌(Staphylococcusaureus,S.aureus)MTCC 96,S.aureusMLS-16 MTCC 2940的拮抗关系中都显示出较好的抑菌活性,其中活性最优化合物的最低抑菌浓度可低至15.6 mg/L;Suresh等[6]研究合成了一系列新型吡喃并[2,3-d]嘧啶类化合物,并对其进行了一系列的抗生物膜活性的筛选,结果显示此系列化合物对S.aureusMTCC 96和S.aureusMLS-16 MTCC 2940有着较好的抑菌活性,最低抑菌浓度可分别低至15.6 mg/L和3.9 mg/L。同时,哌嗪因其广泛的药理活性而在药物化学中受到关注[7]。许多哌嗪衍生物通常表现出一系列显著的治疗活性,包括抗分枝杆菌、抗菌、抗病毒、抗真菌、抗肿瘤、抗镇痛、抗惊厥活性等[8-9];Chaudhary等[10]合成了一系列取代的哌嗪衍生物并测试了其抑菌活性,结果表明1-甲基-4-(3-苯基-2-丙基)哌嗪在30 mg/L的浓度下对S.aureusMTCCB 737的抑制区为18 mm;Chandra等[11]设计合成了一系列新型取代的 1-[双(4-氟苯基)甲基]哌嗪衍生物,显示1-[双(4-氟苯基)甲基]-4-戊基哌嗪对S.aureusATCC 25953的最低抑菌浓度约30.00 mg/L。已有研究显示嘧啶与哌嗪片段耦合的部分化合物对S.aureus显示出一定的抗菌活性,但是活性相对较低[10-12]。因此,本研究根据活性拼合原理,合成一系列哌嗪取代嘧啶类化合物并对其进行抗菌活性的研究,以期筛选出活性更好的抗菌化合物。
1 材料与方法
1.1 实验材料
1.1.1实验菌株S.aureusATCC 433000和表皮葡萄球菌(Staphylococcusepidermidis,S.epidermidis)102555购于北京北纳创联生物技术研究院,大肠埃希菌(Escherichiacoli,E.coli)Dh5a、铜绿假单胞菌(Pseudomonasaeruginosa,Ps.aeruginosa)ATCCC 9027及MRSA 20151026025为贵州医科大学附属医院检验科馈赠。
1.1.2主要试剂 2-氨基-4,6-二氯嘧啶、哌嗪类底物和酰氯类底物(上海毕得医药),米勒顿肉汤(mueller-hinton broth,MHB)培养基、96 孔板、无菌培养皿、无菌离心管、一次性枪头及一次性比色皿(贵阳超远志诚),实验柱层析所用200~300目的硅胶(烟台新诺化工),实验所用化学反应试剂和层析溶剂均为分析纯(上海沃化化工)。
1.1.3主要仪器 SHB-Ⅲ循环水式多用真空泵(郑州长城),旋转蒸发仪(上海爱朗);ZF-Ⅰ型三用紫外分析仪(上海顾村),81-2型恒温磁力搅拌器(上海司乐),WRX-4显微熔点仪(上海易测),Xevo G2-XS型四极杆-飞行时间质谱(美国Waters);600M超导核磁共振波谱仪(德国Bruker),BSC-1600IIB2苏净安泰生物安全柜(南京贝登),震荡培养箱和THZ-82N台式恒温震荡培养器(上海跃进),DW-86W海尔医用超低温保存箱(青岛海尔),电热恒温培养箱(上海一恒),SH-250生化培养箱(上海精宏),721G-100紫外可见分光光度计(上海仪电),ZYCGF-II-107超纯水机(四川卓越),LDZX-75KBS立式压力蒸汽灭菌器(上海申安),ELX800型酶联免疫检测仪(美国伯腾)。
1.2 实验方法
1.2.1目标化合物的合成 室温氮气下将1.5 mmol/L酰氯原料滴加入含有1 mmol/L 2-氨基-4,6-二氯嘧啶原料和2 mmol/L N, N-二异丙基乙胺的干燥甲苯溶液2 mL中,110 ℃下反应4 h,用薄层色谱法(thin-layer chromatography,TLC)监测反应进度;待2-氨基-4,6-二氯嘧啶完全反应后,旋转蒸发仪旋干溶剂,经乙酸乙酯和1 mol/L盐酸溶液萃取,饱和碳酸氢钠溶液萃取有机层,经无水硫酸钠,过柱层析,得到相应的目标化合物中间体3;在氮气保护下,2 mL异丙醇中依次加入1 mmol/L化合物3、1.1 mmol/L取代哌嗪原料、1.5 mmol/L三乙胺,室温温反应1~2 h,用TLC监测反应进度;完全反应后,经旋转蒸发仪旋干溶剂,乙酸乙酯和1 mol/L盐酸溶液萃取,饱和碳酸氢钠溶液萃取有机层,经无水硫酸钠,过柱层析,得到相应的目标化合物4a~4j[13-14]。见图1。
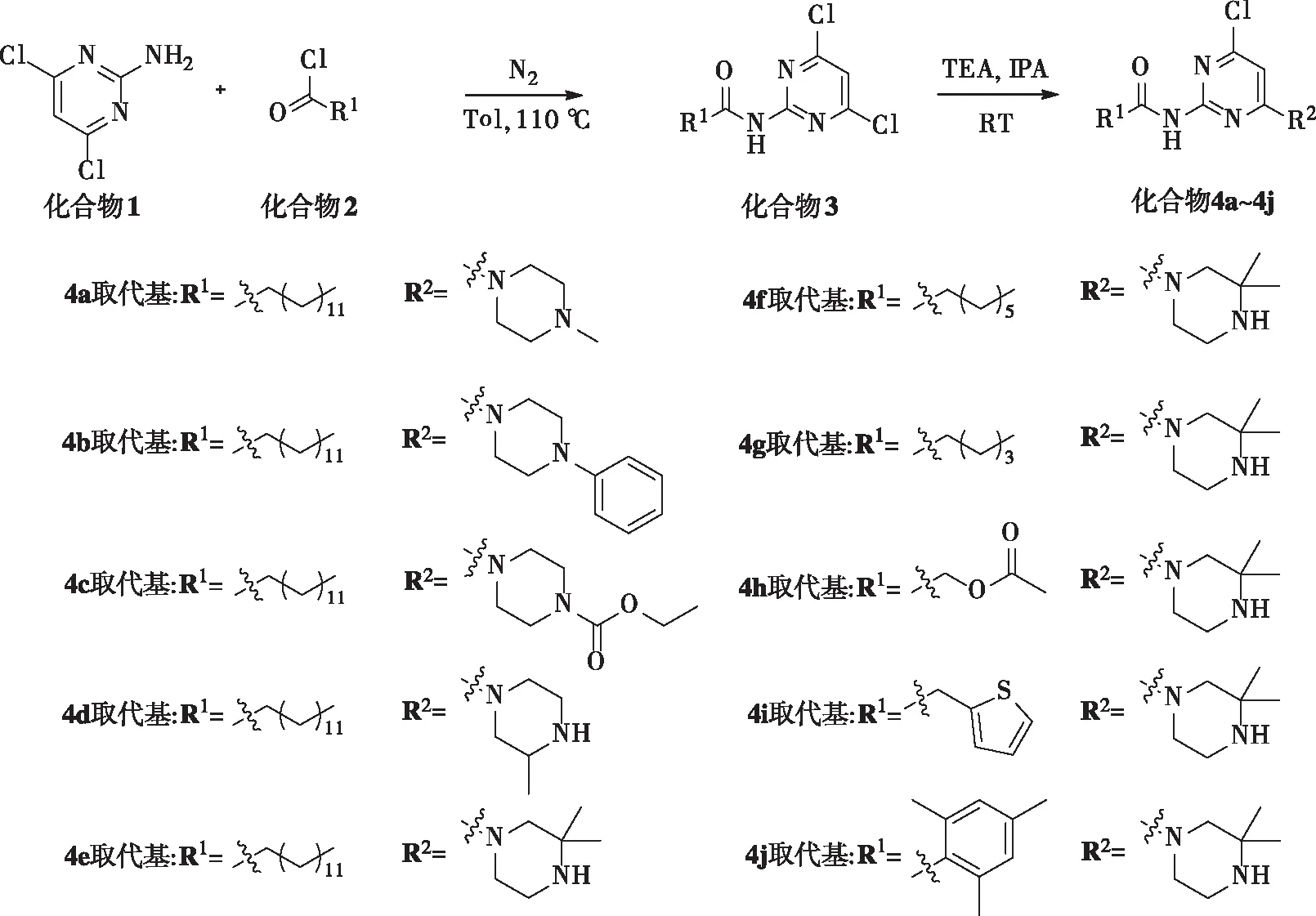
图1 目标化合物的合成路线
1.2.2抑菌活性的测试 根据美国临床和实验室标准协会(clinical and laboratory standards institute, CLSI)的方法,从-80 ℃冰箱取一环菌液于含MHB培养基5 mL 的无菌离心管中,37 ℃恒温振荡培养箱中培养18~24 h;取200 μL活化后菌液于含 MHB 5 mL培养基的无菌离心管中,37 ℃恒温培养3~4 h,菌液浓度调至1×109CFU/L(D600=0.1时,菌浓度为1×1010CFU/L)[15];将待测化合物配成5120 mg/L后待用;标记编号96孔聚苯乙烯板,从第3列开始在每孔中加上述配好的化合物10 μL及MHB 100 μL,每个化合物设置1个复孔(即每块96孔聚苯乙烯板测4个化合物),以苯唑西林(Oxacillin)加于96孔板的第1~2行作为阳性对照组,第3~8行分别加3个目标化合物作为实验组;分别于第1列和第3列加MHB 100 μL和90 μL;将第3列混匀后吸取100 μL混液加入第4列,按此方法等倍稀释至第12列,第12列吸取混液100 μL后弃之;第2列到第12列分别加上述配好的菌液100 μL;第1列为空白对照组,第2列为阴性对照组,药物的终浓度为256.00、128.00、64.00、32.00、16.00、8.00、4.00、2.00、1.00、0.50、0.25 mg/L,菌液终浓度为5×108CFU/L,总体积为200 μL;96孔板放入37 ℃恒温培养箱中培养18~24 h,比较观察孔中培养基浑浊情况,观察到澄清的1孔浓度即为对该菌的最低抑制浓度(minimal inhibitory concentration, MIC)[16];分别选取革兰阳性菌S.aureusATCC 433000、S.epidermidis102555、MRSA 20151026025和革兰阴性菌E.coliDh5a、Ps.aeruginosaATCC 9027测定目标化合物4a~4j的MIC。
2 结果
2.1 化合物的结构表征
2.1.1化合物4a系N-[4-氯-6-(4-甲基哌嗪-1-基)嘧啶-2-基]十四酰胺,白色固体,产率为99%,熔点为128~130 ℃;1H NMR(600 MHz,CD3OD)δ6.55(s,1H),3.71(s,4 H),2.55(t,J=7.4 Hz,2H),2.52~2.47(m,4H),2.34(s,3H),1.71~1.61(m,2H),1.40~1.27(m,20H),0.91(t,J=7.2 Hz,3H);13C NMR(150 MHz,CD3OD)δ173.8,163.1,159.9,156.7,96.6,54.0,44.7,43.5,36.7,31.7,29.4,29.3,29.3,29.2,29.2,29.1,29.0,28.9,24.9,22.3,13.1;HRMS(ESI)C23H40ClN5O[M+H]+的理论值和实际值均为438.300 0。
2.1.2化合物4b系N-[4-氯-6-(4-苯基哌嗪-1-基)嘧啶-2-基]十四酰胺,白色固体,产率为30%,熔点为82~84 ℃;1H NMR(600 MHz,CDCl3)δ7.30(d,J=8.7 Hz,2H),6.98~6.88(m,3H),6.25(s,1H),3.82(s,3H),3.29~3.24(m,4H),2.69(s, 2H),2.36(t,J=7.5 Hz,1H),1.70(d,J=7.6 Hz,2H),1.29~1.25(m,20H),0.88(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ163.0,160.0,156.4,150.7,129.3,120.6,116.5,96.3,49.0,44.2,37.6,31.9,29.7,29.6,29.6,29.5,29.5,29.4,29.3,29.3,24.8,22.7,14.1;HRMS(ESI)C28H42ClN5O[M+H]+的理论值和实际值分别为500.315 6和500.315 7。
2.1.3化合物4c系N-4-(6-氯-2-十四烷氨基嘧啶-4-基)哌嗪-1-甲酸乙酯,白色固体,产率为63%,熔点为87~89 ℃;1H NMR(600 MHz,CDCl3)δ6.21(s,1H),4.18(q,J=7.1 Hz,2H),3.62(m,7H),2.66(d,J=6.8 Hz,2H),2.35(t,J=7.5 Hz,1H),1.69(m,2H),1.30~1.25(m,23H),0.88(d,J=6.9 Hz,3H);13C NMR(150 MHz,CDCl3)δ163.0,160.2,156.3,155.4,96.3,61.8,37.6,31.9,29.7,29.6,29.6,29.5,29.4,29.4,29.3,29.2,29.1,24.8,22.7,14.6,14.1;HRMS(ESI)C23H38ClN5O3[M+H]+的理论值和实际值分别为468.274 1和468.273 4。
2.1.4化合物4d系N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]十四酰胺,白色固体,产率为95%,熔点为74~76 ℃;1H NMR(600 MHz,CD3OD)δ6.53(s,1H),3.04(d,J=12.5 Hz,1H),2.96(t,J=12.0 Hz,1H),2.82~2.74(m,2H),2.61(t,J=11.4 Hz,1H),2.54(t,J=7.2 Hz,2H),1.71~1.63(m,2H),1.44~1.20(m,22H),1.14(d,J=6.4 Hz,3H),0.90(t,J=7.0 Hz,3H);13C NMR(150 MHz,CD3OD)δ173.9,163.1,160.0,156.6,96.6,51.8,43.3,36.7,31.7,29.4,29.3,29.3,29.2,29.2,29.1,29.1,28.9,24.9,22.3,13.0,10.3;HRMS(ESI)C23H40ClN5O[M+H]+的理论值和实际值分别为438.300 0和438.299 9。
2.1.5化合物4e系N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]十四酰胺,白色固体,产率为99%,熔点为76~78 ℃;1H NMR(600 MHz,CD3OD)δ6.58(s,1H),3.76(s,2H),3.59(s,2H),3.09~3.02(m,2H),2.52(t,J=7.4 Hz,2H),1.66(d,J=7.3 Hz,2H),1.37~1.26(m,20H),1.23(s,6H),0.89(t,J=7.1 Hz,3H);13C NMR(150 MHz,CD3OD)δ173.9,163.3,160.1,156.6,96.4,53.0,51.7,48.1,42.6,39.3,36.7,31.6,29.4,29.3,29.3,29.2,29.1,29.1,29.0,28.9,24.9,22.7,22.3,13.0;HRMS(ESI)C24H42ClN5O[M+H]+的理论值和实际值均为452.315 6。
2.1.6化合物4f系N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]辛酰胺,浅黄色固体,产率为99.0%,熔点为226~228 ℃;1H NMR(600 MHz,DMSO-d6)δ10.15(s,1H),6.57(s,1H),3.52(s,2H),3.37(s,2H),2.77~2.70(m,2H),2.45(t,J=7.0 Hz,2H),1.53(d,J=14.1,7.0 Hz,2H),1.25(t,J=7.8 Hz,8H),0.99(s,6H),0.85(t,J=7.0 Hz,3H);13C NMR(150 MHz,DMSO-d6)δ172.0,163.4,159.9,157.0,96.8,54.6,38.4,36.9,34.1,31.6,29.0,28.9,25.0,22.5,22.0,14.4;HRMS(ESI)C18H30ClN5O[M+H]+的理论值和实际值分别为368.221 7和368.220 2。
2.1.7化合物4g系N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]己酰胺,白色固体,产率为93.3%,熔点为281~282 ℃;1H NMR(600 MHz,DMSO-d6)δ10.35(s,1H),6.76(s,1H),3.96(d,J=6.5 Hz,2H),3.74(s,2H),3.15(d,J=6.4 Hz,2H),2.43(t,J=7.4 Hz,2H),1.54(d,J=7.2 Hz,2H),1.31(d,J=7.5 Hz, 6H),1.26(m,4H),0.86(t,J=7.2 Hz,3H);13C NMR(150 MHz,DMSO-d6)δ172.1,163.4,159.9,157.0,96.8,54.6,38.4,36.9,31.3,24.6,22.3,22.0,14.3;HRMS(ESI)C18H22ClN5O2[M+H]+的理论值和实际值分别为340.190 4和340.189 3。
2.1.8化合物4h系N-2-{[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]氨基}-2-氧代乙酸乙酯,白色固体,产率为93.0%,熔点为253~255 ℃;1H NMR(600 MHz,DMSO-d6/CD3OD)δ6.03(s,1H), 4.30~4.24(m,4H),3.44(s,3H),3.25(s,2H),3.12(s,1H),2.70~2.68(m,2H),0.97(s,6H);13C NMR(150 MHz,DMSO-d6)δ 163.7,162.7,159.6,90.7,61.7,49.9,40.1,39.8,39.7,24.9;HRMS(ESI)C14H20ClN5O3[M+H]+的理论值和实际值分别为342.133 3和342.131 7。
2.1.9化合物4i系N-N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]-2-(噻吩-2-基)乙酰胺,浅棕色固体,产率为97.0%,熔点为216~219 ℃;1H NMR(600 MHz, DMSO-d6)δ10.64(s,1H),7.38(dd,J=4.8,1.5 Hz,1H),7.03~6.87(m,2H),6.76(s,1H),4.01(s,2H),3.89(s,2H),3.67(s,2H),3.08~3.04(m,2H),1.90(s,1H),1.25(s,6H);13C NMR(150 MHz,DMSO-d6)δ169.2,163.9,160.3,157.4,137.5,127.6,126.1,97.6,54.5,39.2,38.4,23.0;HRMS(ESI)C16H20ClN5OS[M+H]+的理论值和实际值分别为366.115 5和366.112 1。
2.1.10化合物4j系N-[4-氯-6-(3,3-二甲基哌嗪-1-基)嘧啶-2-基]-2,4,6-三甲基苯甲酰胺,白色固体,产率为97.2%,熔点为423~425 ℃;1H NMR(600 MHz,DMSO-d6)δ10.68(s,1H),6.83(s,2H),6.50(s,1H),3.46~3.22(m,4H),2.61(s, 2H),2.22(s,3H),2.09(s,6H),1.86(s,1H), 0.84(s,6H);13C NMR(150 MHz,DMSO-d6)δ182.0,170.5,168.1,166.5,162.8,159.5,156.5,136.8,128.1,96.1,40.2,40.1,24.7,20.9,19.1;HRMS(ESI)C20H26ClN5O[M+H]+的理论值和实际值分别为388.190 4和388.188 2。
2.2 抑菌活性
以Oxacillin作为阳性对照,分别选取革兰阳性菌S.aureusATCC 433000、S.epidermidis102555、MRSA 20151026025和革兰阴性菌E.coliDh5a、Ps.aeruginosaATCC 9027用于评估目标化合物4a~4j的抑菌活性。结果显示,目标化合物4a~4j起始浓度256.00 mg/L时,化合物4a对S.aureusATCC 433000、S.epidermidis102555及MRSA 20151026025的MIC分别为16.00 mg/L、8.00 mg/L及128.00 mg/L;化合物4d和4e对S.aureusATCC 433000、S.epidermidis102555及MRSA 20151026025的MIC均为2.00 mg/L;其余化合物于256.00 mg/L浓度时对它们没有明显抑菌活性;其中化合物4d、4e对MRSA 20151026025的MIC明显优于阳性对照组,但目标化合物对革兰阴性菌E.coliDh5a、Ps.aeruginosaATCCC 9027并在256.00 mg/L浓度下未显示出抑菌活性。见表1。
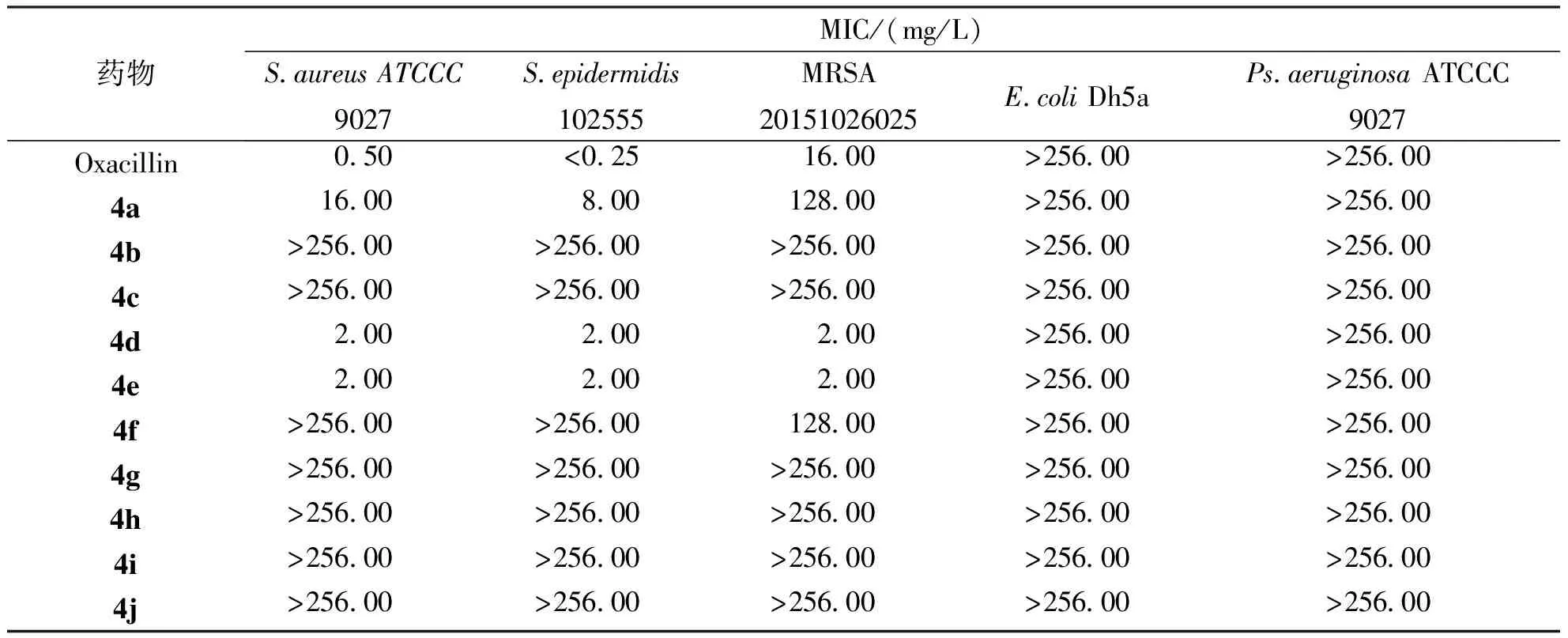
表1 目标化合物4a~4j的抗菌活性
3 讨论
S.aureus是分布最广的细菌病原体之一,每年在全球范围内引起严重的皮肤感染及难以估计的侵袭性感染[17]。它是引起呼吸道、手术部位、假体关节与心血管感染,以及医院菌血症和其他感染疾病的主要病原体,通常不会危及生命,但发病率较高并可能伴有严重疼痛[18-20]。细菌感染对医疗保健和社区环境存在着严重的威胁,尤其是耐药菌的广泛传播。由于S.aureus分离株中经常出现抗生素耐药性,S.aureus感染尤为棘手,其中MRSA与甲氧西林敏感的S.aureus相比,MRSA感染更可能造成公共卫生负担增加[21]。MRSA是引起高发病率医院获得性感染的主要原因,包括软组织和骨骼感染、菌血症及心内膜炎,其发病率和死亡率都很高[20,22-23]。同时,MRSA对氨基糖苷类、大环内酯类及林可酰胺等抗生素产生耐药性的菌株的数量也一直在增加[24]。据中国细菌耐药监测网统计数据显示,2020年S.aureus占全国革兰阳性菌病原菌的32.56%,对MRSA的检出率和耐药率均在35%以上[25]。因此,具有临床应用前景的抗S.aureus活性先导化合物成为科研工作者们的研究热点。众所周知,嘧啶和哌嗪是许多大体积化合物的骨架,也是多种上市药物的重要核心结构[26-27]。Moesslacher等[28]研究表明,在单一结构框架内将吡啶环与哌嗪部分结合可增强生物活性。近年来研究结果显示,抗MRSA活性的先导化合物常常通过引入卤代基团或增加化合物的脂溶性提高其抗菌活性[29]。本研究在嘧啶环与哌嗪环活性拼接的基础上,考虑嘧啶环有较强的亲水性,故于2位引入亲脂性的酰胺脂肪长链,同时于4位引入氯原子,得到化合物4a~4j共10个化合物;后续抑菌活性测试结果提示,当哌嗪环的氮上有给电子基的甲基存在时,化合物4a对S.aureusATCC 433000、S.epidermidis102555及MRSA 20151026025有一定的抑制效果;含有空间位阻和吸电子基的化合物4b和4c于256.00 mg/L浓度下,则无明显抑制效果;意外的是,当哌嗪氮上为氢原子时,化合物4d和4e对S.aureusATCC 433000、S.epidermidis102555及MRSA 20151026025的抑菌作用明显增强,可能是氢键作用的影响或者是仲胺较强的亲核性使其可以与亲电中心进行共价键结合而发挥作用;随后对嘧啶环上酰胺侧链进行构效关系的研究显示,当酰胺侧链的烷基链缩短后抑菌活性也随之降低,引入酯基后化合物4h于256.00 mg/L浓度时也没有产生抑菌效果;引入芳族基团,试图与抗菌靶点形成潜在的π-π共轭,然而化合物4i和4j于256.00 mg/L浓度时并没有表现出抑菌活性;随后选用革兰氏阴性菌E.coliDh5a、Ps.aeruginosaATCCC 9027对目标化合物作进一步活性评估,结果表明它们并没有对这2个菌株表现出抑菌活性。
综上所述,本研究设计合成的哌嗪取代嘧啶类化合物4a、4d和4e对革兰氏阳性菌S.aureusATCC 433000和S.epidermidis102555具有较好的抗菌潜力,尤其是4d与4e对MRSA 20151026025的抗菌活性明显优于阳性药Oxacillin。因此,本研究可为抗葡萄球菌提供新的先导化合物,并为后续的抗生素开发提供理论参考,但是对于目标化合物抑菌的作用机制还需要进一步的探索。

