基于薄层CT扫描肺纯磨玻璃结节的病理分析
苏 雷 张 毅 高 艳 魏 兵 李元博 钱 坤 王雷明 王腾腾 魏秀芹
胸部低剂量螺旋CT扫描(low-dose computed tomography,LDCT)和高分辨率断层扫描(high resolution computed tomography,HRCT)已经成为筛查和诊断早期肺癌的重要手段[1~4]。肺部磨玻璃结节(ground-glass opacity,GGO)就是基于HRCT技术的一个以局灶性、不遮蔽肺血管或支气管结构、朦胧的不透明区域为特征的影像学表现,是早期肺癌的常见影像学表现之一[1,3~6]。分析GGO的影像学特征对早期肺癌术后病理的预判十分重要[2~8]。随着影像学诊断技术的进步,胸部薄层CT扫描(thin-section CT,TSCT)越来越多地应用于早期肺癌的发现和诊断的临床实践中[1~3,6~12]。相比断层为5~10mm的胸部常规CT扫描,0.60~1.25mm断层的TSCT扫描后重建的影像可更细致、准确地观察以p-GGO为表现的影像学特征。现将笔者医院2019年1月~2020年6月期间行胸腔镜手术治疗的451例术前TSCT表现为p-GGO患者的影像学资料和术后病理结果报道如下。
对象与方法
1.临床资料:(1)一般资料:包括患者性别、年龄、观察时间、观察结果[包括p-GGO最大径度和(或)内部特征的变化]等(表1)。(2)影像学资料:术前患者影像学数据均来自笔者医院影像科TSCT扫描数据。p-GGO分类方法:将GGO三分类法中归类的p-GGO按照其在TSCT扫描(参数设定:管电压120kV,管电流110mA,重建层厚1.25mm,肺窗窗宽W=1485HU,窗位C=-530HU)所表现的影像学内部征象(如空泡征、支气管征等)的差异,分为Ⅰ型p-GGO和Ⅱ型p-GGO[3,12]。其他影像学特征包括p-GGO径度大小、部位、形态是否规则、边缘征象[是否清晰、是否光滑、有无毛刺和(或)分叶征]、胸膜征、血管征等。p-GGO类型分组详见表1。随访过程中出现内部特征变化如出现空泡征或支气管征的Ⅰ型p-GGO在术前归为Ⅱ型p-GGO。

表1 临床资料
2.手术方法:根据术前定位标志或术前规划确定病变部位,选定术侧腋前线经第4肋间的手术切口。根据术中冷冻病理结果及患者耐受情况确定肺叶或亚肺叶术式[3,12]。
3.术后病理:由首都医科大学宣武医院病理科胸部肿瘤专业组医师确定病理诊断。着重描述病理性质(良性病变、浸润前期病变、微浸润期病变和浸润期病变)、病理亚型等。对浸润期病变评估是否发生局部单一的肺泡内浸润(spread through air spaces,STAS)、脉管浸润、脏层胸膜浸润或复合浸润(STAS+脉管浸润,STAS+胸膜浸润,脉管浸润+胸膜浸润,STAS+脉管浸润+胸膜浸润)和淋巴结(肺段间、叶间、肺门、纵隔区域)转移情况(表1)。

结 果
1.一般临床资料及观察时间和随访结果:本组451例患者手术前在TSCT表现为Ⅰ型p-GGO 188例(41.7%),Ⅱ型p-GGO 263例(58.3%)。两组患者的平均年龄(54.96±10.80岁 vs 58.16±10.60岁,F=0.071,P=0.790)和性别构成(男性133例 vs 女性318例,P=0.073)比较,差异无统计学意义。全组病例的平均观察时间为11.08±18.90个月,期间有333例(73.8%)没有观察到明显的影像学特征变化,包括Ⅰ型p-GGO 133例(39.9%),Ⅱ型p-GGO 200例(60.1%);有105例(23.3%)观察到p-GGO径度增大,其中Ⅰ型p-GGO 55例(52.4%),Ⅱ型p-GGO 50例(47.6%)。有18例(4.0%)观察到p-GGO密度增高和径度增大,其中观察到5例Ⅰ型p-GGO密度增高和径度增大的平均时间为30.50±14.30个月,明显长于13例Ⅱ型p-GGO的平均时间(9.74±16.40个月,F=6.945,P=0.009)。
2.两组p-GGO其他影像学特征分析:(1)p-GGO部位:451例p-GGO的病变部位分别位于右肺上叶161例(35.7%),右肺中叶45例(10.0%),右肺下叶76例(16.9%),左肺上叶122例(27.1%),左肺下叶47例(10.4%)。两组p-GGO病变部位比较,差异无统计学意义(P=0.346)。(2)p-GGO径度大小:451例p-GGO病变的最大径均值为10.25±5.60mm,其中包括亚厘米病变297例(65.9%),≥10且<20mm 130例(28.8%),≥20且<30mm 21例(4.7%),≥30mm 3例(0.7%)。Ⅰ型p-GGO病变最大径均值明显小于Ⅱ型(8.86±5.10mm vs 11.24±5.80mm,F=8.247,P=0.004)。两组p-GGO病例数和所占比例在亚厘米级的p-GGO病变径度较为接近;随着病变径度的增大,Ⅱ型p-GGO病例数和所占比例在≥10mm且<20mm(71.5% vs 28.5%)和≥20mm且<30mm级(85.7% vs 14.3%)明显增多(P=0.000,表1)。(3)p-GGO形态特征:本组病例中有370例(82.0%)表现为形态规则的p-GGO,81例(18.0%)呈不规则表现。没有看到两组p-GGO的在影像学形态特征的差异(P=0.849),详见表1。(4)p-GGO边缘特征:有243例(53.9%)的p-GGO病变与周边肺组织分界清晰,Ⅰ型(n=113)和Ⅱ型(n=130)病例数相近;有208例(46.1%)边缘不清晰,其中Ⅰ型p-GGO的病例明显少于Ⅱ型p-GGO(75例 vs 133例,P=0.025)。Ⅰ型p-GGO病例数在233例(51.7%)边缘光滑的p-GGO病例中多于Ⅱ型(129例 vs 104例),在97例(21.5%)有分叶征(30例 vs 67例)、66例(14.6%)有呈毛刺征(21例 vs 45例)、55例(12.2%)同时伴有分叶征和毛刺征(8例 vs 47例)的病例中,Ⅰ型明显少于Ⅱ型p-GGO(P=0.000)。在有胸膜征表现的67例(14.9%)中,Ⅰ型p-GGO病变的病例数明显少于Ⅱ型p-GGO(15例 vs 52例,P=0.001)。在有血管征表现的295例(65.4%)的病例中,Ⅰ型p-GGO的病例数明显少于Ⅱ型p-GGO(110例 vs 185例,P=0.009)。
3.两组p-GGO患者的术式分析:全组肺叶切除88例(19.5%),亚肺叶切除363例(80.5%)。Ⅰ型p-GGO病变的肺叶切除例数明显少于Ⅱ型p-GGO患者(18例 vs 70例,P=0.000)。
4.两组p-GGO术后病理分析:(1)病变性质:共报告良性病变为56例(12.4%),恶性病变395例(87.6%),包括浸润前期病变186例(41.2%)、微浸润期病变106例(23.5%)、浸润期病变103例(22.8%)。两组p-GGO病例中的良性病变病例数差异无统计学意义(表1)。Ⅰ型、Ⅱ型p-GGO组中诊断为浸润前期病变例数(123例 vs 63例)、微浸润期病变例数(20例 vs 86例)和浸润期病变的例数(17例 vs 86例)比较,差异有统计学意义(P=0.000,表1)。(2)浸润期病变病理亚型分析:在103例浸润期病变中观察到明确病理亚型有98例(95.1%),包括1例(1.0%)微乳头为主型(micropapillary predominant pattern,MPP),6例(6.1%)乳头为主型(mapillary predominant pattern,PPP),57例(58.2%)贴壁为主型(lepidic predominant pattern, LPP),33例(33.7%)腺泡为主型(acinar predominant pattern, APP),另有1例(1.0%)属于变异型肺腺癌。可以看到Ⅱ型p-GGO组有较多的MPP和PPP亚型病例,但差异无统计学意义(P=0.812)。(3)局部浸润和淋巴结转移情况分析:在103例浸润期病变中观察到6例(5.8%)STAS,2例(1.9%)脉管浸润,21例(20.4%)脏层胸膜浸润。与Ⅰ型p-GGO组比较,可以看到Ⅱ型p-GGO组中有明显多的病例发生局部浸润(P=0.000),而且其中有1例Ⅱ型p-GGO病例同时发生STAS+胸膜浸润,另1例则同时发生STAS+脉管浸润+胸膜浸润。两组中均未发现淋巴结转移的病例。(4)细胞核增殖指数ki-67:共获得311例恶性病变的ki-67指数,均值为5.62%±4.70%。其中,Ⅰ型p-GGO组的ki-67指数(4.52%±3.50%)明显低于Ⅱ型p-GGO组(6.25%±5.10%,F=6.968,P=0.000)。
5.以术后病理结果为诊断标准的ROC曲线分析:观察到基于TSCT的GGO分型(敏感度为90.6%,特异性为56.7%)与三分类法(敏感度为42.8%,特异性为11.9%)不同的诊断价值。图1中所示的ROC曲线下面积分别为0.771和0.659,相应的标准误为0.021和0.026,P=0.000,95% CI:0.730~0.811。
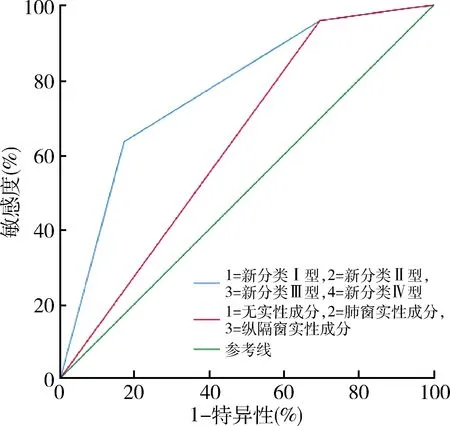
图1 基于TSCT的p-GGO分型与三分类法预测早期肺癌的ROC曲线
6.术后随访:全组无围术期死亡病例。术后常规随访至今,两组患者均未发现局部复发或转移病例。
讨 论
早期肺癌的诊断得益于胸部影像学肺癌胸部影像学诊断技术的进步和发展[1~6]。2011年10月由美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)发表的对高危人群应用低剂量螺旋CT(low-dose CT,LDCT)研究结果成为在早期肺癌诊断研究和实践中的里程碑事件[1~6]。LDCT对早期肺癌诊断的贡献,就是对以肺结节为主要影像学表现的早期肺癌的发现和诊断。肺结节的影像学特征成为预判病理性质、病理类型和计划术式的重要依据[1~8,12~17]。随着CT机械硬件和重建算法的不断进步,对早期肺癌影像学表现的研究也在不断深入。Suzuki等在2006年提出了基于10mm层厚HRCT技术重建所获取影像学特征的GGO的六分类法[1~7]。Kakinuma等[7]在2016年又将其归为三分类:第1类是纯GGO(p-GGO),第2类是仅在肺窗可见实性成分的异质性GGO(h-GGO),第3类就是在肺窗和纵隔窗均可见实性成分的部分实性GGO(part-solid GGO)。2015年我国推出首部《肺部结节诊治中国专家共识》,并在2018年的修订版中强调了对经LDCT发现肺结节的患者,推荐采用胸部TSCT扫描(1mm层厚)进行随访[12]。其中对GGO的分类方法依然沿用Kakinuma等的三分类法。目前检索到胸部TSCT扫描对GGO分析研究的文献较少[8,18]。
既往研究结果显示,p-GGO在TSCT所显示的影像学特征也存在明显不同[3,12]。从本次临床资料的对比结果看,两型p-GGO患者的性别、平均年龄、病变部位、病变形态特征不存在明显差异;与Ⅰ型p-GGO比较,Ⅱ型p-GGO有更多的病例在TSCT扫描中表现为病变的边缘不清(P=0.025)、边缘不光滑呈分叶征和(或)毛刺征(P=0.000)、胸膜征(P=0.001)、血管征(P=0.812);从动态观察时间(平均11.08±18.90个月)的结果看,与Ⅰ型p-GGO比较,Ⅱ型p-GGO出现径度增大和(或)内部征象变化所用时间明显缩短(F=6.945,P=0.009);Ⅱ型p-GGO的径度均数明显大于Ⅰ型p-GGO(F=8.247,P=0.004),在≥10mm且<20mm级(71.5% vs 28.5%)和≥20mm且<30mm级(85.7% vs 14.3%)的病例数明显多于Ⅰ型p-GGO(P=0.000)。可见,基于TSCT扫描所显示p-GGO内部特征的分型不仅具有明显的影像学特征区分,而且观察到随访结果和发生变化所需时间明显不同。
从术后的病理分析结果看,恶性病例数占总例数的87.6%(n=395),这与之前的研究报告相似[3,12]。两型p-GGO与术后病理呈明显相关,其中Ⅰ型p-GGO占浸润前期病变例数总数的66.1%,Ⅱ型p-GGO分别占据微浸润期病变例数的81.8%和浸润期病变例数的83.5%(P=0.000)。Logistic回归分析结果也显示,两型p-GGO与术后病理相关性的明显差异,在TSCT扫描表现为Ⅰ型p-GGO影像学特征的预判浸润前期病变(OR=1.952,95% CI:1.066~3.577,P=0.030)、预判微浸润期病变(OR=0.233,95% CI:0.114~0.475,P=0.000)和浸润期病变(OR=0.198,95% CI:0.094~0.414,P=0.000)。在103例浸润期病变中的病理亚型分析中,可以看到在Ⅱ型p-GGO组有较多的MPP和PPP亚型病例,但差异无统计学意义(P=0.812)。
STAS和脏层胸膜浸润被认为是早期肺癌局部复发的重要危险因素,也是选择术式的重要依据[1,3~6,8,10~18]。共检出6例发生STAS的全部病例和21例发生脏层胸膜浸润中的19例(90.5%)为Ⅱ型p-GGO(P=0.000),其中包括1例同时发生STAS+胸膜浸润和1例同时发生STAS+脉管浸润+胸膜浸润的病例。从这一数据看,对于在TSCT表现为Ⅱ型p-GGO的外科治疗术式应慎重选择楔形切除。在本组数据中Ⅱ型p-GGO病变的肺叶切除例数明显多于Ⅰ型p-GGO患者(70例 vs 18例,P=0.000)。
对311例恶性病变的ki-67指数分析,可以观察到在均值为5.62%±4.70%的两组p-GGO中,Ⅰ型p-GGO组的ki-67指数均值(4.52%±3.50%)明显低于Ⅱ型p-GGO组(6.25%±5.10%,F=6.968,P=0.000)。笔者同时观察到浸润期病变的ki-67指数均值(8.79%±5.90%)明显高于浸润前期病变(3.61%±2.70%,F=27.656,P=0.000)和微浸润期病变(5.02%±3.30%,F=19.295,P=0.000)。进一步说明两型p-GGO与早期肺癌病理特性的相关性。
通过该组临床资料的回顾分析,笔者看到在TSCT扫描以内部征象为主要影像学区分点的两型p-GGO,不仅在其他影像学特征上有明显区分,与术后病理的浸润前期病变、微浸润期病变和浸润期病变有明显的对应关系,而且初步显示出病变组织ki-67指数和局部浸润程度方面的差别。随着TSCT扫描技术的广泛应用,将会有更多的医疗单位开展基于TSCT扫描的p-GGO诊断。多中心的数据分析将弥补这次回顾研究中数据不足的问题。基于TSCT的p-GGO的影像学特征分析将提高早期肺癌病理预判的准确性。

