错配修复蛋白及程序性死亡蛋白配体1在子宫内膜癌中的表达及意义
任单阳,徐 萌
(1.单县中心医院病理科;2.单县中心医院内分泌科,山东菏泽 274300)
子宫内膜癌(endometrial cancer,EC)是女性常见生殖器疾病,既往临床对EC的分类多是根据病理组织形态来进行,但存在明显的主观性,而且重复性不强,在临床指导与预后评估中作用有限[1]。随着临床研究不断深入,肿瘤基因组图谱(TCGA)对其进行新的分子分类,能反映肿瘤预后,为临床提供更多指导。不过,鉴于其所需的技术要求高,难以广泛推广,为此研究者重点加强TCGA实验方法的改良,力求找到更为简单与实用的分类方法,从而更好地应用于临床。错配修复(MMR)蛋白是MMR基因编码蛋白的产物,在EC发病中主要有4种参与其中,即MutL同源蛋白1(MLH1)、MutS同源蛋白2(MSH2)、减数分裂后分离蛋白2(PMS2)、MutS同源蛋白6(MSH6),其中以MLH1与PMS2结合、MSH2与MSH6结合,最终形成二聚体复合物,同时发挥相应的作用[2]。但是,MMR蛋白表达缺失可能导致一些比较严重的问题,其中DNA碱基错配难以矫正便是一种情况,最终会出现微卫星短串联重复序列改变,诱发微卫星不稳定(MSI)。免疫组化检测MSI比较方便,且经济快速[3],在基层医院也可推广。此外,程序性死亡蛋白配体1(PD-L1)在肿瘤组织及其浸润淋巴细胞中的表达也可为筛选免疫治疗提供依据,成为研究热点。本研究就EC患者中MMR、PD-L1表达及其意义进行了探究,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年2月至2022年1月单县中心医院收治的75例子宫内膜癌患者进行回顾性分析。患者年龄28~87岁,平均年龄(56.28±2.35)岁;<50岁20例,≥50岁55例;国际妇产科联盟(FIGO)标准分期[4]:Ⅰ期60例,Ⅱ期11例,Ⅲ期3例,Ⅳ期1例;分化程度:低分化13例,中分化25例,高分化37例;浸润深度:≥50%肌层12例,<50%肌层63例;累及子宫下段18例,未累及子宫下段57例。本研究经单县中心医院医学伦理委员会批准。诊断标准:参照《子宫内膜癌诊断与治疗指南(第4版)》[5]中EC的诊断标准,经术后病理确诊。纳入标准:①临床资料无缺失;②均采用免疫组化检测MMR蛋白与PD-L1表达情况;③均为初次治疗、未接受过内分泌物治疗。排除标准:①合并其他恶性肿瘤;②妊娠期或哺乳期;③精神疾病。
1.2 检测方法 采用免疫组化法检测MMR蛋白及PD-L1表达情况,其中MMR蛋白相关抗体包括鼠抗人MLH1、MSH2、PMS2、MSH6单克隆抗体,均为福建迈新公司提供,而PD-L1单克隆抗体由美国Pathcom system公司提供。将石蜡切片放烤箱留夜处理,控制好箱内温度,维持62 ℃左右;次日对石蜡切片进行脱蜡和水化处理,之后采用乙二胺四乙酸(EDTA)(德州润昕实验仪器有限公司,型号:60-00-4,规格:100 g/瓶)缓冲液高压修复,并保存在室温下,待其自然冷却后再处理;用3%过氧化氢溶液处理,避光孵育,温度以室温为主,之后用磷酸缓冲盐溶液(PBS)(北京生物制品研究所,国药准字S10850002,规格:1 mL/支)缓冲液冲洗;加入一抗-兔抗人胸腺细胞免疫球蛋白(Genzyme Polyclonals S.A.S.,国药准字J20130139,规格:5 mL∶25 mg)后孵育1 h,温度为室温;加PBS处理3次,采用Max VisionTM2/HRP(福州迈新生物技术开发公司,型号:KIT-5020,规格:18 mL/100 mL)继续孵育,温度为室温,最后予以PBS处理。采用二氨基联苯胺(DAB)(上海金穗生物科技有限公司,型号:91-95-2,规格:BR 98%)显色,显微镜(日本Olympus公司,型号:IX50-12)下对染色进展进行观察,若成功则用水冲洗,并用苏木素(美国Sigma公司,型号:GMPIVD GHS316,规格:500 mL)复染,乙醇脱水,二甲苯(湖北成丰化工有限公司,型号1330-20-7,规格:500 g/瓶)透明,封片后待检,经显微镜检查,并进行分析。
检查结果交由单县中心医院经验丰富的两名病理科医师采取双盲法独立阅片,MMR蛋白检查均定位于细胞核,内对照为正常间质细胞或淋巴细胞,MMR蛋白表达完整标准为MMR蛋白中4种细胞核均为棕褐色着色,若其中任何1种未出现棕褐色着色,均判断为MMR表达缺失[6],并根据结果进行分组,包括MMR表达缺失组与MMR表达完整组。PD-L1定位于细胞膜,其阳性对照为扁桃体组织,肿瘤细胞PD-L1阳性数按照棕黄色或黄色染色来判断,若表达≥1%判断为阳性,不足1%判断为阴性[7]。
1.3 观察指标 ①统计MMR表达缺失情况。②比较两组患者临床病理特征。包括年龄、分化程度、浸润深度、子宫下段、组织学类型、脉管内癌栓、淋巴结转移、FIGO分期。③比较两组患者PD-L1表达水平。
1.4 统计学分析 采用SPSS 22.0统计学软件进行数据处理。计数资料以[例(%)]表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MMR表达缺失情况分析 共计检出MMR表达缺失20例,缺失率为26.67%,其中MLH1/PMS2配对表达缺失占比最高,见表1。
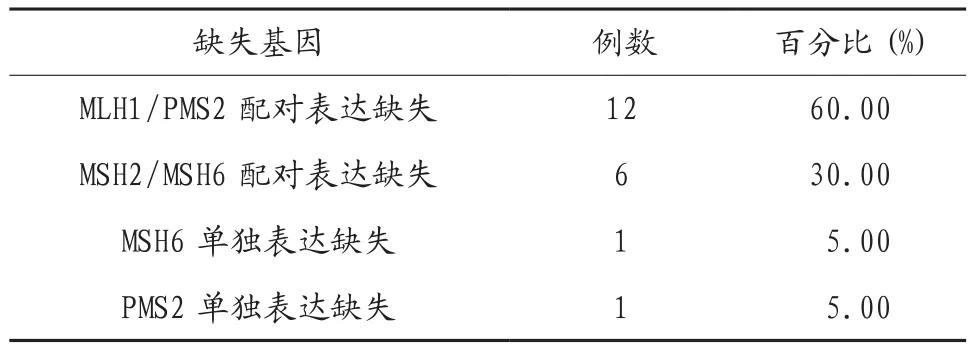
表1 MMR表达缺失情况
2.2 两组患者临床病理特征比较 两组患者年龄、分化程度、浸润深度、组织学类型比较,差异无统计学意义(P>0.05),但MMR表达完整组患者无累及子宫下段、无脉管内癌栓、无淋巴结转移及FIGO分期为Ⅰ~Ⅱ期的患者占比高于MMR表达缺失组,差异有统计学意义(P<0.05),见表2。

表2 两组患者临床病理特征比较 [例(%)]
2.3 两组患者PD-L1表达情况比较 MMR表达缺失组患者PD-L1表达率显著高于MMR表达完整组(P<0.05),见表3。
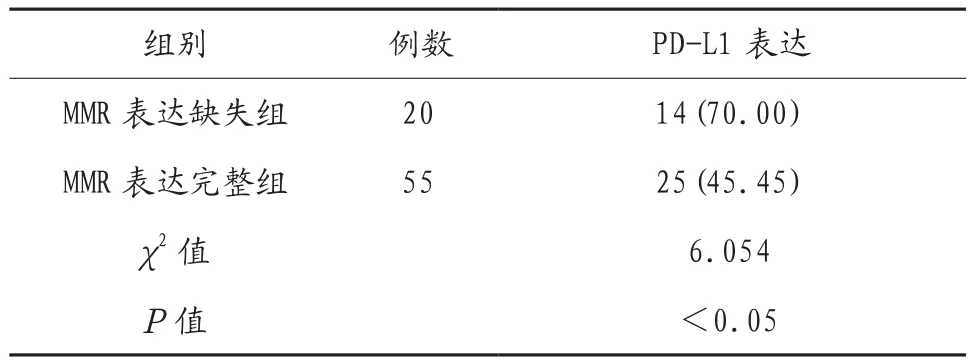
表3 两组患者PD-L1表达情况比较 [例(%)]
3 讨论
EC是女性生殖器三大恶性肿瘤之一,该病不仅有年龄化趋势,而且发病率也持续升高,严重影响身心健康,威胁生命安全[8]。随着相关学者对分子生物学的研究不断深入,越来越多的报道发现多聚ADP核糖聚合酶1(PARP-1)在多种恶性肿瘤组织中均有异常表达,可能与肿瘤发病机制、化疗耐药产生、疾病预后等相关。目前,关于PARP-1在子宫内膜癌中的研究与报道较少,而关于PD-1的报道则逐渐增多。PD-1经调节T细胞活性,使抗原特异性T细胞的凋亡被激活,同时还可抑制调节性T细胞的凋亡,从而在抑制免疫反应与促进自身耐受性方面起到良好的效果。PD-L1则是一类跨膜蛋白,也是免疫应发的抑制因子之一,与PD-1结合后,可促进PD-1阳性细胞的增殖减少,从而抑制细胞因子分泌,加速其凋亡。总之,PD-L1在多种恶性肿瘤中均可发挥作用,能减弱宿主对肿瘤细胞的免疫反应,从而诱导其免疫逃避。此外,PD-L1为靶点的免疫治疗成为肿瘤治疗新方向,在EC中是否可行,可通过检测PD-L1表达情况来进行评估,也是比较热门的课题。
本研究结果显示,MMR表达完整组患者无累及子宫下段、无脉管内癌栓、无淋巴结转移及FIGO分期为Ⅰ~Ⅱ期的患者占比高于MMR表达缺失组,MMR表达缺失组PD-L1表达率显著高于MMR表达完整组。说明对于EC患者,测定MMR表达、PD-L1表达对临床有益,明确MMR表达缺失,是否有PD-L1阳性情况,从而为免疫治疗提供依据[9]。研究发现,EC患者MMR表达缺失率在20%左右,与本研究结果相似,主要以MLH1/PMS2配对表达缺失最常见[10]。同时,在累及子宫下段、有脉管内癌栓、有淋巴结转移等情况下,更易发生MMR表达缺失,也更易诱发EC。PD-L1是肿瘤组织中常见的因子,大部分肿瘤体内有高表达,结合配体PD-1后,明显抑制CD4+T细胞增殖与活化,还可下调炎症因子水平的分泌,还能对T细胞功能产生抑制,形成免疫环境,最终导致肿瘤细胞逃脱免疫系统监控[11]。MMR表达缺失患者突变率较高,肿瘤周围浸润较多淋巴细胞,导致PD-L1表达阳性,为此可作为PD-L1免疫抑制的受益群体。T细胞活化是肿瘤免疫的核心,PD-1则是T细胞表面比较常见的免疫共抑制受体,表达在活化的T细胞表面,与相关配体PD-L1结合,对T细胞增殖及分化有明显的抑制作用,导致T细胞处于无功能状态,使得其抗肿瘤免疫反应受到抑制[12]。基于此,可从PD-1/PD-L1抑制剂方面探索来进行肿瘤药物的研发,这类抑制剂能消除PD-1/PD-L1免疫负性调节,解除对免疫检查点的抑制,从而恢复、促进效应T细胞特异性识别及杀灭肿瘤细胞的功能[13]。但这方面的研究缺乏大样本的系统分析,经免疫治疗后,临床缓解率虽然有无提高,但还需进一步大样本验证。
综上,MMR蛋白检测对筛查与诊断EC有参考价值,而MMR蛋白表达异常可用于评估EC,同时分析PD-L1表达情况,可为PD-L1相关免疫治疗提供依据。

