双包覆法改善高压钴酸锂正极材料的电化学性能
邓昊天 王传伟 陈守潇 潘思宇 吕 超郭明佳 刘君珂 魏国祯 周 尧 李君涛*,
(1厦门大学能源学院,厦门 361102)(2厦门大学化学与化工学院,厦门 361005)(3厦门厦钨新能源材料股份有限公司,厦门 361026)
近年来,锂离子电池的技术得到了快速发展,其在储能、数码产品以及电动汽车等产品中都得到了广泛应用。为了满足消费者对锂离子电池能量密度越来越高的要求,研究者们开发了多种具有高比容量的电极材料。在众多正极材料中,由于钴酸锂(LiCoO2)具有较高的压实密度以及较好的循环稳定性,是数码电池的主要正极材料。其较高的压实密度赋予电池较高的体积能量密度,良好的循环稳定性使其可以较好地适应数码设备的使用周期[1]。目前大多数商用LiCoO2的充电截止电压均在4.45 V,其比容量和质量能量密度分别为170 mAh·g-1和700 Wh·kg-1,然而随着数码设备日新月异的发展,人们对设备的持续工作时间提出了更高的要求[2]。
提升能量密度的方法有提高颗粒的压实密度、调整活性物质的质量比、提高材料的充电截止电压以及减少电极中黏结剂和导电剂等非活性材料的使用量等[3]。当LiCoO2的充电截止电压提高至4.5 V时,其初始比容量和质量能量密度将会升高至185 mAh·g-1和734 Wh·kg-1[4]。但随着工作电压的提高,材料中也会有更多的Co3+被氧化为Co4+,并发生从六方晶相到单斜晶相的不可逆相变,导致了材料结构在高电压下的不稳定。此外,高氧化态的Co4+的反应性也比Co3+强,使得其与电解液间的副反应加剧。这不仅导致了材料中钴元素不可逆的流失,还使得电解液被过度消耗,材料表面副反应严重[5-6]。因此,需要对LiCoO2材料进行改性才能满足在高电压下的使用需求。此外,如果通过减少黏结剂和导电剂等非活性材料的使用量或增大载量的方式来提高能量密度,则需材料有更好的离子和电子电导率,从而能减少正极中导电剂的含量并增大活性物质比例。
一些典型的掺杂元素诸如Al、Mg和Ti等已被证明可改善LiCoO2的性能,这些元素通过稳定LiCoO2的晶体结构进而抑制其在高电压下的不可逆相变[7-9]。但已有研究表明掺杂元素Al等会在循环过程中与电解液中的LiPF6反应,导致正极与电解液界面不稳定和体相中Al元素的流失[4]。将一些金属或非金属氧化物,诸如ZrO2、Al2O3或SiO2包覆在Al掺杂的LiCoO2上,可以抑制界面副反应[10-14]。然而,其中大部分的包覆物不具备快速传导锂离子能力。而且,由于颗粒包覆的局限性,包覆后的LiCoO2部分表面依旧会暴露在电解液里。所以在LiCoO2的颗粒表面形成一层连续且薄的均匀包覆层是非常重要的,而目前已有的方法包括磁控溅射和原子层沉积等[15-16]成本昂贵且无法进行大规模生产。
我们开发了一种简易且易于推广、条件温和的方法来实现对LiCoO2的表面包覆。依次向LiCoO2的表面包覆离子导体钛酸锂(Li4Ti5O12)和导电聚合物聚吡咯(PPy)。二者可以分别有效地提高LiCoO2的离子电导率和电子电导率,并抑制其与电解液发生副反应。通过各项表征研究了这种独特的双包覆结构在循环性能以及倍率性能上提升的作用。
1 实验部分
1.1 Al掺杂LiCoO2材料的制备
Al掺杂LiCoO2粉末通过共沉淀法合成。将CoSO4·7H2O(702.9 g,AR,99%,Aladdin)和 Al2(SO4)3(8.6 g,99.95%,Aladdin)在50℃下溶于去离子水中,再用氨水将溶液的pH调至11,然后将溶液中的沉淀物离心过滤后在800℃下煅烧,得到Al掺杂的Co3O4。将其与Li2CO3(AR,99%,Aladdin)按照化学计量比混合后并在马弗炉中以1 000℃煅烧6 h,得到Al掺杂LiCoO2粉末。
1.2 纳米Li4Ti5O12材料的制备
将 TiO2(99.99%,Aladdin)与 LiOH(99.99%,Aladdin)按化学计量比混合研磨后,再将混合物放入马弗炉中750℃热处理6 h得到大粒径的Li4Ti5O12。将 Li4Ti5O12放入砂磨机(NT-0.6L,Longly China)中进行纳米化,砂磨时间为3 h,大粒径Li4Ti5O12会形成固含量30%的砂磨液,最终得到纳米化的Li4Ti5O12。
1.3 Li4Ti5O12包覆LiCoO2(LTO@LCO)材料的制备
根据先前研究,在本研究中Li4Ti5O12的包覆量控制在 0.25%[13]。将 Li4Ti5O12与 Al掺杂的 LiCoO2粉末按照质量比0.25∶100在高速固相包覆机中以5 000 r·min-1的转速持续运行20 min,从而将纳米化的Li4Ti5O12包覆在Al掺杂的LiCoO2材料表面,然后将其在马弗炉中于800℃下煅烧6 h,制得LTO@LCO。
1.4 PPy-LTO@LCO的制备
将吡咯(99%,Macklin)与LTO@LCO分别以质量比0.05∶100、0.15∶100、0.5∶100混合于无水乙醇中,搅拌2 h。再加入Na2S2O8(AR,99%,Aladdin)作为引发剂,引发剂与吡咯的物质的量之比为1∶3,然后在冰浴下搅拌6 h,过滤、洗涤并干燥,分别得到双包覆xPPy-LTO@LCO(x=0.05%、0.15%、0.5%)。
1.5 电极的制备与电池的组装
分别将上述未包覆和包覆后的LiCoO2与导电剂(Super P)、黏结剂聚偏氟乙烯(PVDF)混合,三者质量比为80∶10∶10或90∶3∶7(文中如无特别指出,该质量比均为80∶10∶10),将PVDF配制为10%的N-甲基吡咯烷酮溶液。将得到的浆料用刮刀均匀涂抹至Al箔上,随后在100℃下真空干燥10 h后得到所需的正极极片,将其用冲片机裁成直径为12 mm的小圆片使用。电极活性物质的载量为5或10 mg·cm-2(文中如无特别指出,载量均为5 mg·cm-2)。在Ar气氛的手套箱中,将正极与锂金属负极组装成2025型扣式电池进行电化学性能测试,电解液为1.0 mol L-1LiPF6的碳酸乙烯酯和碳酸甲乙酯(EC和EMC,体积比为3∶7,苏州佛赛新材料有限公司)溶液。
1.6 电化学测试
在室温下,于LAND测试仪(武汉蓝电公司,CT2001A)上进行了2.7~4.5 V的恒电流充放电循环测试,在 0.1C(1C=180 mA·g-1)下活化 2周,随后在0.5C下测试不同包覆量LiCoO2的循环性能;在0.1C、0.5C、1C、2C、5C下测试不同包覆量LiCoO2的倍率性能并最后回到0.1C。在CHI660E电化学工作站(中国上海)上进行了循环伏安(CV)法的测试。此外,在CHI660E上进行了交流阻抗谱(EIS)测试,交流扰动信号为5 mV,频率范围为105~0.01 Hz。
1.7 材料的表征
采用傅里叶变换红外光谱(FT-IR,NICOLET iN10,Thermo Fisher,America)对材料的有机包覆层进行了分析。采用X射线衍射仪(XRD,Rigaku Ultima Ⅳ)对材料的相结构进行表征,工作电压40 kV,工作电流150 mA,辐射源为CuKα靶辐射(λ=0.154 06 nm),扫描范围10°≤2θ≤90°,扫描速率5(°)·min-1。采用场发射扫描电子显微镜(SEM,日立S4800,加速电压 15 kV,发射电流 10 μA)和透射电子显微镜(TEM,JEM-2100,Nippon Electronics Corporation,Japan,加速电压200 kV)观察材料的形貌和结构。使用同步热分析仪(德国耐驰,STA449F5)对材料进行热重(TG)测试,分析材料表面的有机包覆层的含量,测试温度范围25~800℃,升温速率2℃·min-1,升温气氛80%N2+20%O2。使用四探针测试仪(RTS-8,广州四探针)测试了材料的电子电导率,测试温度和相对湿度分别为25℃和52%。使用X射线光电子能谱分析仪(XPS,Physical Electronics Ltd.,America)分析以AlKα(14 866.6 eV)辐射为主激发源的电极表面元素价态,工作功率为150 W。使用三离子束切割仪(Leica EM TIC 3X)对循环后极片上的材料进行了切割,离子束能量为5 keV,工作气氛为Ar。
2 结果与讨论
2.1 材料外观、组成和性质的表征
图1分别为 LCO、LTO@LCO、0.15%PPy-LTO@LCO的SEM图。LCO的表面光滑(图1a),但LTO@LCO表面均匀地分布一些直径约10 nm的颗粒(图1b)。在LTO@LCO的表面未观察到裂痕,表明LCO颗粒在经过与纳米Li4Ti5O12颗粒高速固相混合后并未遭到破坏,图S1(Supporting information)为LTO@LCO的EDS(能谱)结果,Co和Ti元素信号的出现证明LTO的成功包覆。由图1c可知,0.15%PPy-LTO@LCO表面的小颗粒消失,表面也变得更加粗糙,形貌与图1b差别明显。图1g为0.15%PPy-LTO@LCO的EDS结果,由图可知,材料表面有明显的Co、Ti和N元素信号,与包覆物存在的元素相符。进一步的TEM图(图1d~1f)表明,相比于LCO和LTO@LCO,0.15%PPy-LTO@LCO的表面出现了一层连续的衬度较低的非晶态物质,其厚度约6 nm,表明其颗粒的表面有一层连续的包覆层。

图1 (a)LCO、(b)LTO@LCO和(c)0.15%PPy-LTO@LCO的SEM图;(d)LCO、(e)LTO@LCO和(f)0.15%PPy-LTO@LCO的TEM图;(g)0.15%PPy-LTO@LCO的元素映射图Fig.1 SEM images of(a)bare LCO,(b)LTO@LCO,and(c)0.15%PPy-LTO@LCO;TEM images of(d)bare LCO,(e)LTO@LCO,and(f)0.15%PPy-LTO@LCO;(g)Elemental mapping images of 0.15%PPy-LTO@LCO
图2a是材料在2 000~800 cm-1范围的FT-IR谱图。LCO、LTO@LCO没有明显的FT-IR吸收峰;而0.15%PPy-LTO@LCO有3个FT-IR吸收峰,分别为1 050 cm-1(N—H 键)、1 260 cm-1(C=N 双键)、1 419 cm-1(C—N键)[17-19]。由图 2b的 XRD图可知,在18.98°、37.44°、45.22°、49.42°、59.10°、65.42°、66.34°和 69.68°处的峰分别对应 LiCoO2的 (003)、(101)、(104)、(015)、(009)、(018)、(110)和(113)晶面(Rm空间群)。由于包覆物Li4Ti5O12含量过低以及PPy为非晶态物质,在XRD中未能明显检测到其信号。由图2c的TG测试结果可知,LCO、LTO@LCO在温度升高过程中,无明显质量变化,而0.15%PPy-LTO@LCO则有较明显的质量变化,说明其外表面包覆的聚合物在高温下被分解。计算可知,聚合物在材料中的质量分数约0.15%。

图2 LCO、LTO@LCO和0.15%PPy-LTO@LCO的(a)FT-IR谱图、(b)XRD图和(c)TG曲线;LCO、LTO@LCO和0.15%PPy-LTO@LCO的(d)C1s、(e)N1s、(f)Ti2p和(g)Co2p的XPS谱图Fig.2 (a)FT-IR spectra,(b)XRD patterns,and(c)TG curves of LCO,LTO@LCO,and 0.15%PPy-LTO@LCO;XPS spectra of(d)C1s,(e)N1s,(f)Co2p,and(g)Co2p spectra of LCO,LTO@LCO,and 0.15%PPy-LTO@LCO
图2d~2g为 LCO、LTO@LCO、0.15%PPy-LTO@LCO的XPS谱图。3种材料的Co2p谱图中都出现了 Co2p3/2(780.00 eV)以及 Co2p1/2(795.00 eV)的峰,表明基底材料均为LiCoO2,且包覆层厚度在10 nm以下[20-22]。在LTO@LCO、0.15%PPy-LTO@LCO的XPS谱图中出现Ti2p1/2(457.9 eV)和Ti2p3/2(463.9 eV)的峰[23-24],表明纳米Li4Ti5O12颗粒成功地包覆在其表面。而N1s谱图仅在0.15%PPy-LTO@LCO观察到,399.57和397.53 eV处的峰分别为PPy中的N—H键和C=N键[25-26]。0.15%PPy-LTO@LCO的C1s谱图中出现了与其他2种材料不同的峰。LCO、LTO@LCO的C1s谱图中只有284.8 eV的峰,归属于C—C键;而0.15%PPy-LTO@LCO的C1s谱图中还出现了283.9和285.7 eV处的峰,分别归属于PPy中的C=C键和C—N键[27]。以上表征证明了Li4Ti5O12和PPy成功地包覆在LiCoO2上。
为了研究包覆层对材料的影响,在2.7~4.5 V的电压范围内以不同的扫描速率(0.1~0.9 mV·s-1)进行了CV测试,结果如图3a~3c所示。3种材料的氧化峰和还原峰的位置基本一致,表明包覆物未明显改变LiCoO2的结构,且包覆物在所测电位区间稳定。此外,随着扫描速率的增加,材料氧化峰的位置发生偏移。通过截取各扫描速率下氧化峰的最高点并进行拟合,可以得到3种材料离子扩散速率的相对大小。包覆纳米Li4Ti5O12后,LiCoO2的锂离子扩散系数明显提升,而双包覆的0.15%PPy-LTO@LCO锂离子扩散系数略小于单包覆的LTO@LCO(图3d),这也在后续的GITT测试中得到证明。为了进一步得到3种材料在循环中的锂离子电导率,后续又对其进行了GITT测试,其中LCO、LTO@LCO和0.15%PPy-LTO@LCO的锂离子电导率分别为1.1×10-10、2.3×10-10和 2.0×10-10cm2·s-1。LTO@LCO 的锂离子电导率约为LCO的2倍,而0.15%PPy-LTO@LCO的锂离子电导率比LTO@LCO略低,这可能是PPy包覆层会对锂离子的传输起到一些阻碍作用。但由于包覆层较薄,锂离子电导率下降得不多,对其性能也没有明显的影响。随后,对3种材料的电子电导率进行了测试(图3h),将材料压制成直径为12 mm的小圆片,并用四探针法测试得到了各自的电子电导率。由图可知,0.15%PPy-LTO@LCO的电子电导率为0.006 S·cm-1,与LCO和LTO@LCO相比提升了约10倍。这也与0.15%PPy-LTO@LCO在离子电导率不是最高的情况下,却仍然在大电流和大载量下具有最佳性能的表现相符(见后文)。

图3 (a)LCO、(b)LTO@LCO和(c)0.15%PPy-LTO@LCO的CV曲线;(d)LCO、LTO@LCO和0.15%PPy-LTO@LCO的相对离子电导率;(e)LCO、(f)LTO@LCO和(g)0.15%PPy-LTO@LCO的GITT曲线;(h)LCO、LTO@LCO和0.15%PPy-LTO@LCO的电子电导率Fig.3 CV curves of(a)LCO,(b)LTO@LCO,and(c)0.15%PPy-LTO@LCO;(d)Relative ionic conductivities of LCO,LTO@LCO,and 0.15%PPy-LTO@LCO;GITT curves of(e)LCO,(f)LTO@LCO,and(g)0.15%PPy-LTO@LCO;(h)Electronic conductivities of LCO,LTO@LCO,and 0.15%PPy-LTO@LCO
2.2 材料的电化学性能表征
将3种材料制作成极片并装配成半电池进行恒电流充放电测试以评估不同的PPy包覆量对材料电化学性能的影响。所有的半电池正极的载量均为5 mg·cm-2,测试温度均为室温25℃,电压区间为2.7~4.5 V。如图4a所示,当PPy的包覆量为0.05%和0.15%时,其循环性能(0.5C)与LTO@LCO相当。在循 环 300周时 ,LCO、LTO@LCO和 0.15%PPy-LTO@LCO的放电比容量分别为139.9、141.4和136.8 mAh·g-1,容量保持率分别为78.5%、76.9%和77.4%。而当PPy包覆量为0.5%时,其循环性能相较LTO@LCO有所下降,其循环300周时的比容量仅有98.6 mAh·g-1,容量保持率为55.6%。这是由于包覆层太厚,阻碍了锂离子的传输,其循环性能反而下降。在图4b的倍率性能测试中0.15%PPy-LTO@LCO展示出了优异的倍率性能,其在5C的电流密度下比容量为150 mAh·g-1。在随后图4c的10C大电流循环测试中,0.15%PPy-LTO@LCO依然保持了优异的循环性能,其循环200周时依然有98.9 mAh·g-1的比容量,容量保持率为70.2%。以上结果证明双包覆和单包覆相比,可以进一步提升材料在大电流密度下的循环性能以及倍率性能。

图4 LCO、LTO@LCO和xPPy-LTO@LCO的电化学性能:导电剂为10%、载量为5 mg·cm-2时,0.5C下的(a)循环性能、(b)倍率性能以及(c)10C下的循环性能;导电剂为3%、载量为5 mg·cm-2时的(d)倍率性能和(e)0.5C下的循环性能;(f)导电剂为3%、载量为10 mg·cm-2时倍率性能Fig.4 Electrochemical performance of bare LCO,LTO@LCO,and xPPy-LTO@LCO:(a)cycling performance at 0.5C,(b)rate performance,and(c)cycling performance at 10C with 10%conductive agent and 5 mg·cm-2mass loading;(d)rate performance and(e)cycling performance at 0.5C with 3%conductive agent and 5 mg·cm-2mass loading;(f)rate performance with 3%conductive agent and 10 mg·cm-2mass loading
由于PPy的包覆,材料电子电导率增加,因此尝试在电极片中减少导电剂,以期有效提高活性物质在极片中的占比。如图4e所示,当导电剂的含量从10%下降到3%时,0.15%PPy-LTO@LCO的循环性能无明显下降,循环200周时比容量依然有147.5 mAh·g-1,容量保持率为82.8%,而LCO和LTO@LCO的循环性能大幅度地下降。不仅如此,当导电剂含量降至3%时,倍率性能的差别更为明显。如图4d所示,在5C电流密度下,0.15%PPy-LTO@LCO的比容量为130 mAh·g-1,而LCO和LTO@LCO的比容量为 95 mAh·g-1。当载量从 5 mg·cm-2提升至 10 mg·cm-2时,倍率测试结果如图4f所示,此时0.15%PPy-LTO@LCO在5C电流密度下有110 mAh·g-1的比容量,而LCO和LTO@LCO仅有30~40 mAh·g-1的比容量。这表明双包覆策略有效提高了材料在大能量密度(更少的导电剂)下以及大载量下的循环性能和倍率性能。
2.3 包覆物保护原理的探究
除此之外,为了观察材料在电化学循环后的变化,对3种材料循环50周后的极片表面进行XPS表征。如图5a~5c所示,3种材料的F1s谱图中均出现了相同位置的峰,但强度差别较大。其中,687.6 eV处的峰归属于AlF3[13,28-29],AlF3形成的原因可能是在循环过程中,Al元素会富集于材料表面并与电解液中的LiPF6反应;686.5 eV处的峰归属为LiPO2F2,LiPO2F2主要是由锂盐LiPF6的分解反应、LiPF6与Li2CO3的反应或LiPF6与电解液中存在的痕量水反应生成[29-30];684.8 eV处的峰归属于LiF,主要是电解液在循环过程中正常分解所致[20]。由于LCO表面没有包覆层,故其体相中的Al元素会流失并与LiPF6反应生成大量的AlF3,而分解所产生的LiF的含量也远小于其它2种材料。这不仅影响了材料的长循环稳定性,也造成了电解液的消耗,故其性能会远差于另外2种材料。而0.15%PPy-LTO@LCO的F1s的XPS谱图中显示的AlF3信号强度最低(图5c),LTO@LCO的AlF3信号强度强于0.15%PPy-LTO@LCO但弱于LCO,证明制备LTO@LCO所使用的固相包覆的方法也能在一定程度上阻止电解液与基体反应,然而这种包覆方法并不能实现完全包覆,使得仍有部分基体裸露在电解液中。与之相比,制备0.15%PPy-LTO@LCO使用的固、液相双包覆方法,则有效地覆盖了基体的表面,阻止了材料与电解液的反应,进而增强了长循环性能。在N1s谱图中,LCO、LTO@LCO都没有出现明显的峰,而0.15%PPy-LTO@LCO在401.0 eV处出现了明显的峰[25-26,31],证明在经历过50周循环后,有机包覆层依然稳定地包覆在材料的表面,表明有机包覆层可保护材料的表面使其获得长循环稳定性。包覆层对材料表面的保护作用也体现在交流阻抗测试中,根据图S1,循环50和100周后,0.15%PPy-LTO@LCO正极的阻抗要远小于LTO@LCO和LCO,说明在循环过程中双包覆层起到了屏障的作用,阻止了电解液在材料表面过多分解,抑制了副产物的产生,促进了材料电化学性能的提升。
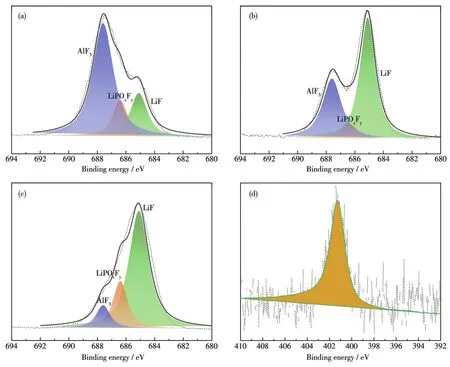
图5 (a)LCO、(b)LTO@LCO和(c)0.15%PPy-LTO@LCO循环50周后的F1s XPS图;(d)0.15%PPy-LTO@LCO循环50周后的N1s XPS谱图Fig.5 F1s XPS spectra of(a)LCO,(b)LTO@LCO,and(c)0.15%PPy-LTO@LCO after 50 cycles;(d)N1s XPS spectra of 0.15%PPy-LTO@LCO after 50 cycles
图6为3种材料在循环50周后的截面SEM图,使用离子束切开材料后观察其横截面。由图可知,LCO电极在循环50周后内部出现了明显的裂纹和断裂,而LTO@LCO和0.15%PPy-LTO@LCO电极在循环50周后,内部依旧保持完整,证明包覆层可以在材料循环的过程中有效地保护材料的体相结构。
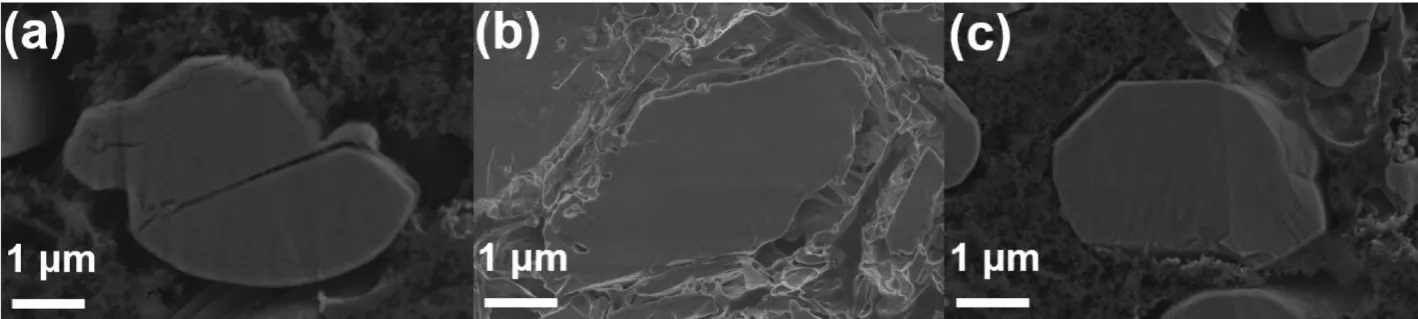
图6 循环50周后的(a)LCO电极、(b)LTO@LCO电极、(c)0.15%PPy-LTO@LCO电极的截面SEM图Fig.6 Cross-sectional SEM images of(a)LCO electrode,(b)LTO@LCO electrode,and(c)0.15%PPy-LTO@LCO electrode after 50 cycles
3 结论
综上所述,我们通过固相和液相双包覆法合成了聚吡咯和Li4Ti5O12共包覆的LiCoO2材料,该方法不仅有效提高了材料的离子电导率和电子电导率,还构建了一层物理保护层,减少了电解液与材料表面的反应,从而提升了LiCoO2材料在高电压下的循环和倍率性能。这种双包覆的策略可以进一步推广到其它高电压的正极材料中,从而促进高性能正极材料的发展。
Supporting information is available at http://www.wjhxxb.cn

