基于密度泛函理论对等离子体中H/CO2相互作用的第一性原理研究
王雪峰 沈崇雨 吴吉良 叶小球*,
(1表面物理与化学重点实验室,绵阳 621908)(2中国工程物理研究院材料研究所,绵阳 621900)
0 引言
随着石油、天然气等化石能源用量的日益增加及其储量的不断减少,能源和环境问题受到越来越广泛的关注。为了实现“碳达峰”和“碳中和”目标,一方面我们需对排放的二氧化碳进行有效处理,实现二氧化碳“净零排放”;另一方面需发展新型能源,以逐步减少二氧化碳的排放。
在众多新能源中,受控核聚变能源是解决人类能源问题、实现“碳中和”的终极方案,成为国家“十四五”能源发展规划优先事项。由欧盟、印度、日本、中国、俄罗斯、韩国及美国一同参与的国际热核实验堆(international thermonuclear experimental reactor,ITER)已经在法国装机完成,且首次在50 MW的输入功率下产生约500 MW的热输出功率[1]。这表明聚变过程产生的热能多于加热等离子体的能耗,聚变过程满足持续进行的基本条件,快速发展的热核聚变将成为实现“碳中和”不可或缺的一环。
目前热核聚变实验堆为氘氚聚变。主燃料之一的氚,价值高昂且具有自衰变特性,因此在整个燃料循环中其安全性备受关注[2-5]。氘氚等离子体在放电或者氚的自衰变过程中,会产生大量高能电子,这些高能电子可以通过电子碰撞电离、激发和离解激活(惰性)气体,以这种方式产生的活性物质(即离子、激发物质和自由基)[6-7]易相互反应,从而形成新分子。在等离子体排气过程或者对真空容器的碳共沉积层及灰尘进行“氧烘烤”时都会产生碳的氧化物(CO、CO2)[8-11]。因此在高能电子的作用下,作为燃料的氢同位素与杂质中的CO2/CO会发生相互作用,厘清这些相互作用中的化学反应机制对于燃料循环设计及氚燃料的回收和提纯都意义重大。
在研究CO2转化技术以实现“碳中和”的研究过程中,众多研究者[12-14]出于节能高效的考量,对CO2转化的技术途径进行了大量尝试。其中等离子体技术的应用研究为本工作提供了思路。许多研究者[15-21]基于不同类型的等离子体发生装置研究了不同条件下CO2混合反应的转化效率,其中主要涉及的等离子体发生装置类型有DBD(dielectric barrier discharges)、MW(microwave)、RF(radio frequency)、SD(surface discharge)等,部分工作归纳如表1所示。
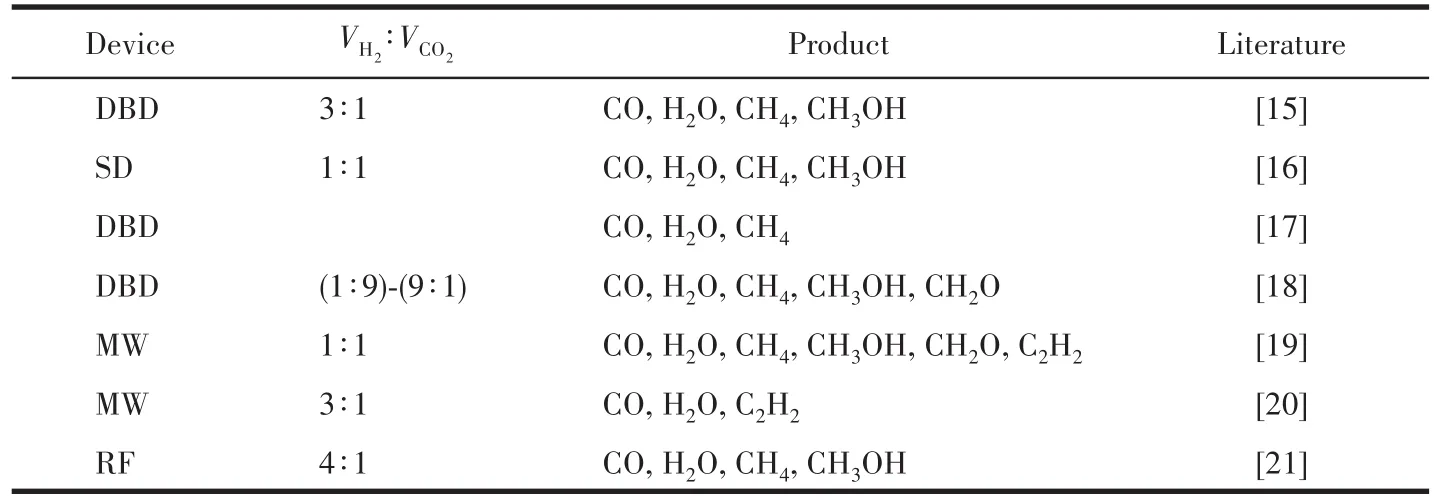
表1 一些等离子体状态下的H2与CO2的反应实例Table 1 Some examples of the reaction of H2and CO2in the plasma state
从表中可看出,等离子状态下H2和CO2反应过程产生的主要产物为CO、H2O,次级产物(数量较少)中比较重要的有甲烷(CH4)、甲醇(CH3OH)。Bogaerts等[22]的工作表明,在等离子体中CO2的离解主要有2种机制:电子直接撞击CO2激发离解过程与电子撞击CO2激发到最低振动能级再逐步振动激发。在高能电子(E≥7.6 eV)作用下,CO2离解为 CO 与 O。Corrigan等[23]细致研究了高能电子下H2的离解过程,其结果显示当电子的E≥(8.8±0.2)eV,H2在电子的撞击下开始离解。因此考虑放电过程中两者的电离条件以及电离率,可认为CO2和H2在电子的作用下持续被离解为CO、O、H,在电动力学的作用机制下参与下一步的化合反应,其中未被电离的CO2以及H2会遵循热力学机制进行离解,并参与到后续反应。而根据石从云等[24]的研究结果,高能H原子与CO2分子的碰撞动力学过程可以引发H+CO2→OH+CO反应,但这种机制对氢原子或离子能量要求高且存在碰撞概率,而常规放电装置对原子或离子的能量提升能力有限,因此本工作暂不考虑此情况。
本工作采用第一性原理计算方法研究了传统热力学下的CO2裂解过程,及在高能电子撞击H2和CO2时离解产生的中性活性粒子(H、CO、O)之间的化学反应。此外,本工作还考虑了不同温度及同位素效应对反应过程的影响,深入研究等离子体条件下,氢同位素与CO2反应的微观机制,为聚变堆氘氚燃料循环工艺的优化设计提供数据支撑。
1 实验部分
1.1 计算方法
本工作使用基于密度泛函理论(DFT)的Gaussian09软件包,其中DFT所用泛函出于对色散效应、计算准确性以及经济性的综合考虑,最终选择 M06-2X[25-26]。H、D(氘)、T(氚)以及 C 采用基组为6-311++G(3d2f,3p2d)[27],利用几何结构优化及频率分析获得相关分子的几何结构以及热力学参数,进一步通过Berny算法搜寻反应物与产物之间的过渡态(TS),最后通过内禀反应坐标(intrinsic reaction coordinate,IRC)法获得反应路径。

其中反应物部分,Bogaerts等[22]的研究指出在CO2等离子体中可能存在20种粒子成分。本工作以CO2、CO、O与H、D、T作为反应物,以报道的主、次要产物CO、H2O、CH4、CH3OH作为产物,寻找反应物到产物之间最有可能的反应路径,利用Shermo[28]程序及过渡态理论完成这些反应路径的热力学计算以及不同温度下的反应速率的计算[29]。
对于反应αA+βB→gC+hD,产物与反应物在焓、熵、自由能上的差异,即焓变(ΔH)、熵变(ΔS)及吉布斯自由能变(ΔG)与该反应的平衡常数Kep满足范特霍夫方程(式1):ΔG=ΔH-TΔS=-RTlnKep,其中T为温度(K),R为摩尔气体常数(8.314 47 J·mol-1·K-1)。反应速率vTST由下式给出[29]:

其中kB为玻尔兹曼常数;h为普朗克常数;p0为压强(Pa);对于n分子反应,Δn=n-1;ΔG0,≠(T)为标准态活化能;σ为反应路径简并度。ΔG0,≠(T)满足式3:ΔG0,≠(T)=ΔGTS0(T)-ΔGreactant0(T),其中GTS为计算不考虑虚频时吉布斯自由能的贡献。σ与反应物和TS的转动对称数(分别用σrot,R和σrot,TS)有关,满足关系式4:σ=σrot,R/σrot,TS。反应速率vTST与反应物的浓度c及反应速率常数kep满足式5[30]:vTST=kepcAαcBβ。
2 结果与讨论
2.1 反应路径
通过TS寻找及IRC[31]扫描,获得H与CO2产生CO、H2O、CH4、CH3OH的反应路径,如图1所示。从热力学的角度看,CO2在反应路径中结构对称性优先被破坏,随后其中一个C=O键断裂,从而形成CO与O原子。由于CO2的标准摩尔生成吉布斯自由能较高(ΔG⊖=-394 kJ·mol-1)[32],且其含有的C=O键相对较强(783 kJ·mol-1)[33],因此 CO2是一种高度稳定的分子,需要大量的能量输入、优化的反应条件和活性催化剂才能进行任何化学转化[34]。相对热力学,高能电子的撞击更容易实现能量的馈入,使得离解过程更容易发生。放电过程中概率性随机电子激发离解机制与热力学机制共存。电子激发离解和热力学机制导致CO2离解产生的O原子极容易和H原子在电动力学的推动下复合为较为稳定的H2O分子;富集的H原子和离解产生的CO会发生化合,继而产生CH3OH;与此同时,CO也可能在加H的过程中,C=O发生断裂,从而形成CH4及H2O;当然CO也有较大可能在高能电子的作用下进一步离解[22],产生的C、O分别与H直接化合产生CH4及H2O。因此,需要研究各可能反应的热力学参数以及环境温度对反应的影响,以及整体反应的反应类型与温度对化学平衡的影响。

图1 (a)CO2离解;(b)H与O的化合;(c)H与CO生成CH3OH;(d)H与CO生成CH4和H2OFig.1 (a)CO2splitting;(b)Combination of H and O;(c)Formation of CH3OH by H and CO;(d)Formation of CH4and H2O by H and CO
2.2 各反应在不同温度下的热力学参数(ΔH与ΔG)
在300~1 100 K范围内,各个反应的标准焓变以及自由能变随温度的变化趋势如图2所示。图2a显示R1的ΔH>0,且随着温度的上升而轻微上升,表明CO2离解后的产物能量之和大于反应物。在该反应过程中,体系从外界吸收能量,为吸热反应,温度升高降低了CO2的离解难度,这也意味着离解对高能电子的能量需求随着温度的升高而进一步降低,这将导致离解率的上升,从而产生更多的转化产物。对于反应R2~R10,CO2离解产物与H的不同反应的ΔH均小于0,且随温度上升而减小,表明这些反应均为放热反应。
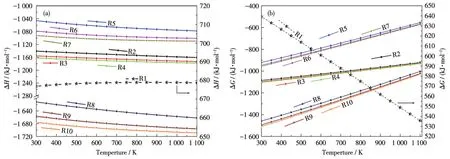
图2 反应R1~R10的(a)标准焓变和(b)自由能变随温度的变化趋势Fig.2 (a)Standard enthalpy change and(b)free energy change of reaction R1-R10 as a function of temperature
在恒温恒压的条件下,自由能的变化可以反映一个化学反应的净驱动力。ΔG为0时,正逆反应达到平衡,图2b表明CO2的离解需要吸收大量的热量才能使其活化,从而产生离解,而这一难度也被高能电子激发离解机制消除。CO2离解产物与H的反应,均是沿着自由能减少的方向,即均为自发反应,虽然在温度升高时ΔG的绝对值明显减小,但依然是趋于消耗H的方向。
2.3 各个反应在不同温度下的Kep和vTST
图3为各个反应的Kep和vTST(s-1)随温度变化的趋势。CO2离解反应的Kep在整个温度区间均小于1,随着温度上升而增加到接近1,这表明其逆反应处于优势;CO2的化学活性增加而逐渐偏向正反应即离解的方向,而CO2裂解产物与H原子的反应一直处于正向反应,这会大量消耗CO2裂解的产物,从而推动CO2的热化学裂解过程;从反应速率来看,裂解产物的消耗是极其迅速的,虽然消耗速率随着温度升高迅速下降,但其反应速率依旧可观。
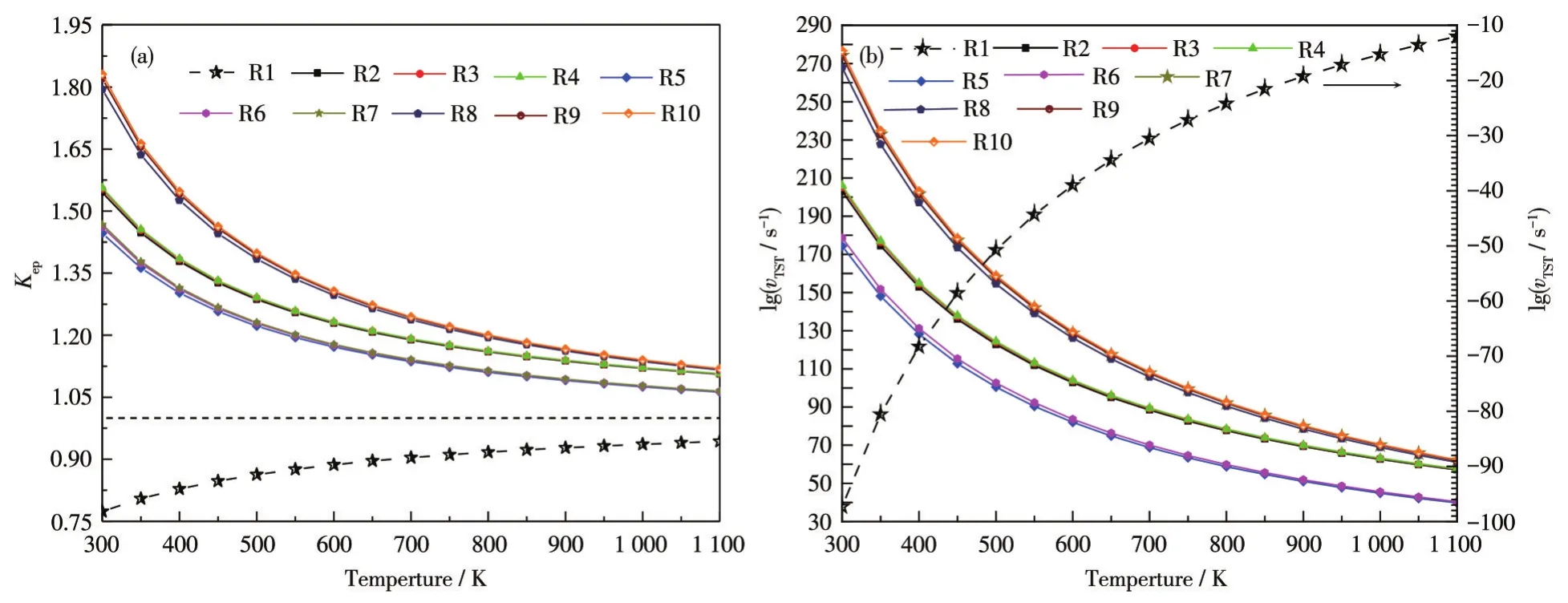
图3 反应R1~R10的(a)Kep和(b)vTST随温度的变化趋势Fig.3 (a)Kepand(b)vTSTof reaction R1-R10 as a function of temperature
反应速率直观反映了反应进行的难易程度,从图3b可以看出,反应速率的大小关系:CO和H反应生成CH4>O和H反应生成H2O>CO和H反应生成CH3OH;同时氢同位素对反应速率也有所影响,表现为相同反应路径下:T参与的反应速率>D参与的反应速率>H参与的反应速率,而且H参与的反应速率明显低于T/D。
在本工作中,等离子体下氢同位素与CO/CO2的相互作用这个复杂的反应体系被分解为10个简单的化学反应来进行研究。同样的,氢同位素与CO/CO2的相互作用依然遵循热力学和动力学规律,从上述结果来看,整个体系中只有CO2的离解需要外在能量驱动,而其他反应均为放热反应(可自发发生),整个反应体系的自由能变化为负值,即反应体系在绝热情况下仅需要CO2的离解的初次启动能,后续反应(R2~R10)产生的热量以及对离解产物的消耗均会推动反应的发生。而在实际实验装置中,反应是在真空的环境下进行,体系产生的热量很容易通过红外辐射等方式流失,很难用于提升环境温度以作用在各个反应过程。
氢同位素与CO/CO2在高能电子作用下,离解产生活性离子。这些活性离子之间的相互作用存在难易差别,体现出反应过程对产物的消耗顺序以及反应物的出产优先级。主要表现为以下2个方面:(1)在氢同位素同时存在的情况下,其消耗顺序:T>D>H,且T/D消耗速率明显高于H;(2)在产物生成方面,CO和H反应生成CH4的难度明显低于生成CH3OH。
这也能解释Eliasson[15]的结论:H2和CO2(VH2∶VCO2=3∶1)在DBD环境下的转化产物中CH4(3%~4%)多于 CH3OH(0.4%~0.5%)。Song等[9]在研究 DT/T2与CO的放射化学反应发现只有T参与了反应,这种同位素带来的影响或许也可以应用在氢同位素分离的工艺设计之中。值得一提的是,虽然同为辐照环境,等离子体放电条件和氚自衰变过程中,氢同位素与CO2的反应产物不同。熊义富等[35]研究表明,氚的自衰变产生的T+也会导致CO2的离解,诱导T与CO2发生反应。然而,在等离子体环境下,虽然高能电子、离子及活性基团诱导着一系列化学反应的发生,但也在不断破坏着产物[34],从而阻止具有更长或者更复杂化学结构的产物出现,从而增加了形成积碳的难度。
3 结论
基于第一性原理计算方法,本工作研究了H2和CO2混合气在高能电子作用下的相互作用,并考虑了温度和氢同位素效应对其的影响。研究表明H2/CO2反应体系在高能电子条件下处于ΔH<0的状态,即放热反应。这些粒子间的相互作用存在2种倾向:(1)CO与H的反应倾向生成CH4多于生成CH3OH。(2)在氢同位素共存的情况下,氢同位素参与反应而被消耗的顺序为T>D>H,且T/D的消耗速率明显高于H。这2种倾向对于基于等离子的CO2定向转化以及聚变堆排气中氢同位素分离/提纯均有参考价值。此外,升高反应的环境温度可以降低CO2裂解的难度,有利于CO2在高能电子作用下的裂解,从而产生更多的转化产物。
致谢:感谢表面物理与化学重点实验室稳定支持项目(No.WDZC202103)对本工作的支持;感谢马邦俊、李强、杨蕊竹博士等参与讨论交流。
- 无机化学学报的其它文章
- Synthesis,Structure,and Properties of Rare-Earth Complexes Based on Pyridine Dicarboxylic Acid Ligands
- Facile Synthesis of Si@LiAlO2 Nanocomposites as Anode for Lithium-Ion Battery
- Solvent-Controlled Morphology of Ni-BTC and Ni-BDC Metal-Organic Frameworks for Supercapacitors
- 基于多金属氧酸盐和多壁碳纳米管的双酚A电化学传感器的构建与性质
- A Fast-Responsive Mitochondria-Targeting Fluorescent Probe Detecting Hypochlorite in Living Cells and Zebrafish
- A Complex of Silver(Ⅰ)with N-O Chelating Agent and Phosphine Ligand:Design,Structures,and Biological Activity

