IL-37 腹腔注射对脓毒血症小鼠心肌损伤的影响及机制
徐嵘 ,王蕾艳 ,2,米柯霖 ,曹新冉 ,2,赵刚 ,2,苑海涛 ,2
1 山东大学齐鲁医学院,济南 250021;2 山东第一医科大学附属省立医院心内科
脓毒症是指由病原体感染引起生理、病理和生化异常导致的器官功能障碍综合征,病死率较高。心肌损伤是脓毒症最严重的并发症之一,主要表现为心肌损伤标志物水平增加,左室收缩和舒张功能障碍,伴或不伴左心室射血分数(LVEF)降低,由于国内外尚缺乏对脓毒症心肌损伤的统一定义,因此其流行病学统计存在差异。临床数据表明,心功能障碍的脓毒症患者较心功能正常的脓毒症患者病死率更高[1]。研究发现,炎症反应、氧化应激损伤、心肌抑制性物质的分泌、线粒体功能障碍及其他能量代谢紊乱等多种因素参与脓毒症的发病过程,其中,炎症风暴发挥重要作用[2-6]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)在脓毒症固有免疫反应中发挥重要作用。NLRP3通过与含CARD的凋亡相关斑点样蛋白(ASC)、半胱氨酸天冬氨酸酶1(Caspase-1)结合形成NLRP3炎症小体,促进炎性因子的成熟和释放,介导病理状态下的组织损伤。白细胞介素-37(IL-37)是IL-1 家族新的调控因子,在人体各组织器官内广泛表达,其蛋白结构有5 种亚型(ae),但在啮齿动物中并未发现其同源基因表达。既往研究证实,IL-37 在多种炎症、自身免疫性疾病及免疫相关的疾病,如哮喘、系统性红斑狼疮、肝硬化、结肠炎恶性转化等疾病病程中,通过抑制炎症细胞的促炎作用,抑制疾病进程[7-10]。本课题组在既往研究中发现,IL-37可通过调节Th17/Treg细胞平衡,在病毒性心肌炎中抑制心肌炎症损伤。然而,IL-37在脓毒症心肌损伤中是否发挥保护作用及其潜在具体机制尚不明确。2019年12月—2021年9月,我们通过构建脓毒症小鼠模型,探究IL-37在脓毒症心肌损伤中对NLRP3炎症小体的影响及其心肌保护的机制。
1 材料与方法
1.1 材料 雄性C57BL/6J 小鼠36 只,购自北京维通利华实验动物技术有限公司,SPF级,4~6周龄,体质量(20.033±0.321)g;动物实验均经山东第一医科大学附属省立医院动物伦理委员会批准(批准号NSFC:NO. 2021-232),严格按照《实验动物管理与使用指南》指导方针进行。脂多糖(LPS)购自美国Sigma 公司(L2630-25MG);重组人IL-37b 购自美国Proteintech 公司;HE 染色试剂盒和 BCA 试剂盒购自上海碧云天生物技术有限公司;TNF-α 抗体(1∶200)、IL-6抗体(1∶400)和IL-1β抗体(1∶250)均购自英国 Abcam 公司;NLRP3 抗体(1∶1 000)、Caspase-1 抗体(1∶1 000)、ASC 抗体(1∶1 000)、GAPDH抗体(1∶1 000)及HRP 标记山羊抗兔二抗(1∶3 000)均购自美国Cell Signaling Technology公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;ECL发光液购自美国Millipore公司。高分辨率超声心动图仪购自加拿大Visual Sonics 公司;Amersham Imager 680(AI 680)超灵敏多功能成像仪购自美国GE 公司;电泳转印系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 动物分组及处理 将C57BL/6J小鼠适应性喂养1 周后,通过随机数字表法将其随机分为3 组,分别为对照组、脓毒症模型组(LPS 组)及LPS+IL-37组(IL-37 组),每组12 只。LPS 组小鼠腹腔注射LPS(20 mg/kg)构建脓毒症模型,IL-37组小鼠予腹腔注射LPS(20 mg/kg)及IL-37(1 mg/kg),对照组小鼠行腹腔注射等体积无菌生理盐水处理。
1.2.2 心脏超声检查 3 组小鼠经药物干预12 h后,应用异氟醚(5%,0.8 L/min)麻醉,脱毛固定后行经胸壁超声心动图扫描,测量小鼠左心室射血分数(LVEF)及缩短分数(FS),连续3次计算平均值。
1.2.3 心肌形态组织学观察 3 组小鼠经药物处理12 h 后,2%戊巴比妥钠(70 mg/kg)腹腔注射麻醉,取小鼠心脏,切去心尖,4%多聚甲醛常规固定,石蜡包埋,连续切片,根据HE 试剂盒步骤做HE 染色:将标记好的切片经3次二甲苯脱蜡处理后,依次置于梯度乙醇(100%、90%、80%、75%)中处理,蒸馏水冲洗2 min;苏木素染色3 min,流水冲洗3 min 洗去浮色,盐酸乙醇分化数秒,流水冲洗;伊红染色2 min,流水冲洗3 min 洗去浮色,梯度乙醇脱水(75%、80%、90%、100%),二甲苯透明2 次,中性树胶封片,晾干。显微镜下观察心肌形态结构并拍照。
1.2.4 心肌组织中炎性因子表达检测 石蜡切片常规脱蜡、水化,热诱导抗原修复,PBS 冲洗,3%过氧化氢孵育10 min;PBS 冲洗,5%牛血清蛋白室温封闭 30 min;甩干血清,抗 TNF-α 抗体、抗 IL-6 抗体或抗IL-1β 抗体4 ℃孵育过夜;PBS 冲洗,室温孵育二抗;PBS 冲洗后DAB 显影。棕黄色颗粒即为阳性结果。应用美国Media Cybernetics 公司的Image-Pro Plus_6.0 软件系统进行组织病理切片图像分析,分别测量 TNF-α、IL-6、IL-1β 的阳性染色面积占心肌面积的比例,进行半定量分析。
1.2.5 心肌组织中NLRP3 炎症小体相关蛋白表达检测 提取心肌组织,在液氮中充分研磨心肌组织,按照组织:细胞裂解液=1 mg∶10 µL 的比例加入细胞裂解液(RIPA:蛋白酶抑制剂=100∶1),提取组织总蛋白。应用BCA 法检测各组织样蛋白浓度,加入5×蛋白上样缓冲液,100 ℃煮沸10 min。制备10%SDS-聚丙烯酰胺凝胶,30µg总蛋白/泳道,进行凝胶电泳(60 V,120 V)分离,转膜(200 mA,1.5 h),室温下应用5%脱脂奶粉封闭2 h,4 ℃孵育一抗(抗GAPDH 抗体、抗 NLRP3 抗体、抗 Caspase-1 抗体、抗ASC 抗体)过夜。室温下孵育二抗1.5 h;ECL 显色,AI 680成像仪行图像分析。应用JAVA公司的ImageJ软件系统对条带强度进行分析。
1.3 统计学方法 采用SPSS21.0和GraphPad Prism统计软件。计量资料符合正态分布以表示,结果比较采用单因素方差分析,组间进一步比较采用Student Newman Keuls 法进行检验。P<0.05 为差异有统计学意义。
2 结果
2.1 IL-37对脓毒症小鼠心功能指标的影响 心脏超声结果显示,对照组、LPS 组、IL-37 组 LVEF 分别为(63.01 ± 4.22)%、(43.84 ± 10.22)%、(55.56 ±6.57)% ,FS 分 别 为(34.35 ± 6.04)% 、(20.96 ±5.45)%、(32.33± 5.02)%,与对照组相比,LPS组小鼠LVEF、FS 均降低(P均<0.05),与LPS 组相比,IL-37组小鼠LVEF、FS均升高(P均<0.05)。
2.2 IL-37对脓毒症小鼠心肌形态结构的影响 对照组小鼠的心肌细胞排列规整,未发现坏死、充血、水肿等病理损伤。LPS 组小鼠的心肌细胞排列紊乱,可见肌膜破裂,同时伴有明显坏死、间质充血和水肿及炎症细胞的浸润;而IL-37组小鼠以上病理变化得到显著改善,心肌结构排列较整齐,局部少量坏死、充血及水肿。见图1。
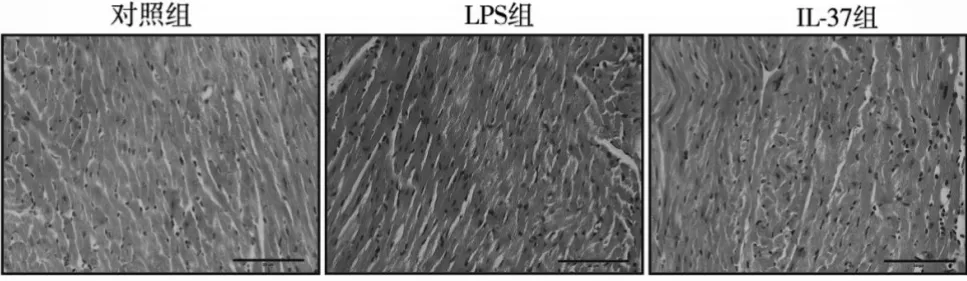
图1 各组小鼠心肌组织HE染色(×40)
2.3 IL-37 对脓毒症小鼠心肌组织炎症反应的影响 LPS 组、对照组、IL-37 组小鼠心肌组织中炎症因子 IL-1β 表达分别为 20.12 ± 1.89、1.00 ± 0.56、8.09 ± 2.89,IL-6 表达分别为 36.56 ± 5.17、1.00 ±0.25、9.92 ± 1.37,TNF-α 表 达 分 别 为 20.87 ±6.35、1.00± 0.44、6.23± 1.29,小鼠心肌组织中炎症因子IL-1β、IL-6、TNF-α表达LPS组高于对照组(P均<0.05),IL-37组低于LPS组(P均<0.05)。
2.4 IL-37 对心肌组织中NLRP3 表达的影响 LPS组、对照组、IL-37 组小鼠心肌组织中NLRP3 蛋白表达分别为6.42±0.16、1.00±0.21、5.39±0.11,小鼠心肌组织中NLRP3 蛋白表达LPS 组高于对照组(P<0.01),IL-37组低于LPS组(P<0.05)。
2.5 IL-37 对脓毒症小鼠心肌组织中NLRP3 炎症小体的影响 LPS 组、对照组、IL-37 组小鼠心肌组织中NLRP3 蛋白相对表达量分别为3.77 ± 0.22、1.00 ± 0.04、1.97 ± 0.13,Caspase-1 蛋白相对表达量分别为 3.04 ± 0.18、1.00 ± 0.07、1.62 ± 0.20,ASC 蛋白相对表达量分别为 2.17 ± 0.12、1.00 ±0.03、0.77 ± 0.13,小鼠心肌组织中 NLRP3、Caspase-1和ASC蛋白相对表达LPS组高于对照组(P均<0.05),IL-37组低于LPS组(P均<0.05)。
3 讨论
心功能障碍是脓毒症的严重并发症。尽管近年来临床对脓毒症的关注度越来越高,但目前的治疗手段仍局限于传统的干预措施,如抗生素应用、液体复苏和血管活性药物的应用,以及具有潜在治疗作用的糖皮质激素的辅助应用[11]。国内外对脓毒症发病机制的探究较多,过度炎症反应是其中重要病因,尽管免疫调节被认为是脓毒症治疗的重点,但目前针对这一发病机制的对因治疗尚不成熟,仍待进一步探索[12]。
IL-37是一种具有双重功能的细胞因子,能分别通过细胞外和细胞内两条途径参与固有免疫和获得性免疫的调节,在多种炎症及免疫相关疾病中发挥重要的调节作用[13-15]。IL-37 在人体多种组织器官中广泛表达,如心、肺、子宫等,尽管在人体正常细胞中维持着较低的表达,但一旦有促炎刺激发生,其表达迅速增加,从而发挥强大的炎症调节作用,在维持人体免疫稳态中占据重要地位[14]。本研究结果显示,在脓毒症小鼠模型中,IL-37 能改善小鼠心肌LVEF 及 FS 水平,抑制炎性因子 IL-1β、IL-6、TNF-α表达。这些结果表明,IL-37不仅改善了脓毒症小鼠心脏的收缩和舒张功能,同时对心肌组织中炎性因子的表达有抑制作用,从而减低心肌炎症损伤。提示IL-37 在LPS 诱导的脓毒症损伤中对心肌发挥保护作用。
近年来,NLRP3 炎症小体在脓毒症相关研究中广受关注。在脓毒症早期,病原体相关的分子模式(PAMP)和损伤相关分子模式(DAMP)识别病原体,与模式识别受体(PRR)相互作用,从而介导了机体的免疫反应。既往实验表明,Toll 样受体4(TLR-4)在其中重要的识别与信号传递作用已被广泛证实[16],然而近年研究发现,NLRP3 也参与其中。LPS通过干扰素基因刺激蛋白(STING)和干扰素调节因子3(IRF3)通路,引起NLRP3 增加,激活炎症小体,参与心肌损伤[17]。本研究免疫组化结果显示,IL-37能明显抑制心肌组织内NLRP3 蛋白表达。进一步Western blotting 实验结果显示,与对照组相比,LPS组心肌组织中NLRP3 炎症小体及相关蛋白表达明显增加,而在IL-37 组心肌组织中,LPS 诱导的NLRP3炎症小体及相关蛋白表达明显受抑制。这些结果提示,IL-37 在脓毒症心肌损伤中对NLRP3 炎症小体活化起抑制作用。
综上所述,IL-37在脓毒症心肌损伤早期通过抑制NLRP3 炎症小体调节促炎因子的表达,进而改善脓毒症心肌损伤和心功能障碍,此为脓毒症心肌损伤的早期临床治疗提供了新靶点。然而IL-37 在治疗脓毒症心肌损伤中的作用机制复杂,仍需后续深入探究。

