NGF介导Fabp4/LCN-2蛋白对骨质疏松大鼠骨微结构及骨强度的影响
邓宁 胡庆芬* 邱宇阳 梁彩虹 张珑维 谭雅琼
1.重庆市开州区人民医院内分泌科,重庆 开州 405400 2.贵阳市第二人民医院急诊科,贵州 贵阳 550081
骨质疏松症(osteoporosis,OP)是一种以低骨量和骨组织微结构破坏为特征,导致骨质脆性增加和易于骨折的全身性代谢性骨病[1]。据流行病学调查结果显示,OP发生率存在性别差异,女性和男性发病率为8∶1,该病致残率较高并影响患者生活质量[2]。OP早期患者无明显症状,随着疾病发展可出现局部或全身性疼痛。近些年随着组织工程学的发展,干细胞移植治疗骨科疾病取得了良好的效果,能够修复骨缺损、改善骨代谢。神经生长因子(nerve growth factor,NGF)在骨代谢中发挥成骨细胞调节作用,能够平衡骨代谢、有利于成骨活动[3]。相关研究[4]证实,NGF能够通过增加骨折骨痂形成加快骨组织修复。间充质干细胞(MSCs)是来源于中胚层、存在于骨髓及多种组织中的多向分化的一类干细胞,MSCs具有广泛的获得性并拥有多向分化的潜能,被认为具有较强促再生能力的MSCs在治疗OP中具有广泛的应用前景。
脂质运载蛋白2(lipocalin-2,ICN-2)是一种分泌型糖蛋白,主要由成骨细胞分泌,能够通过血液循环达到血脑屏障参与骨代谢。大量研究[5]证实,ICN-2与成骨细胞关系密切,当成骨细胞分化降低时能够抑制葡萄糖代谢。在OP患者中发现ICN-2表达异常,且抑制ICN-2能够影响成骨分化能力。脂肪酸结合蛋白4(fatty acid binding protein 4, Fabp4)属于细胞内脂肪酸结合蛋白(FABPs)成员之一,主要在脂肪细胞及巨噬细胞中表达,主要作用为参与细胞内脂肪酸运输作用,被发现在OP疾病中表达降低,说明其异常表达能够参与疾病的发生发展[6]。但是目前关于NGF介导Fabp4/LCN-2水平的研究较少,本研究拟通过腹腔注射NGF,探讨Fabp4/LCN-2对骨微结构及骨强度的影响,为组织工程学防治OP的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物:60只雌性无菌Wistar大鼠购自广东省医学实验动物中心,动物许可证号:SCXK(粤)2018-0015,平均体重225~300 g,在室温、饱和湿度下饲养一周后按照《实验动物管理条例》规定进行实验。本研究经重庆医科大学动物实验伦理委员会批准(批准号201912001)。
1.1.2主要药物、试剂及仪器:注射用鼠神经生长因子(武汉海特生物制药,批准文号:S20020117);维甲酸片(山东良福制药);Fabp4抗体及GAPDH抗体(美国Introvigen公司);LCN抗体(美国Santa cluz公司);苏木素染色液(北京鼎国昌盛生物);戊巴比妥钠(湖北鸿运隆生物科技);双能X线BMD仪(品源博联医疗设备上海公司);Micro CT(杭州越波生物科技);生物力学检测仪(济南中创工业测试系统公司);蛋白电泳系统及PCR仪器(杭州厚泽生物科技)。
1.2 方法
1.2.1OP建模:将维甲酸片剂研磨成细粉末,加入无菌蒸馏水制成维甲酸混悬溶液,制备成足量的溶液,保存在-4 ℃的恒温冰箱中备用。对大鼠采用维甲酸混悬液连续灌胃,每日一次,每次70 mg/kg,连续灌胃4周,同时在室温及饱和湿度下按照标准饮食饲养,获得OP大鼠实验动物模型。
1.2.2分组及干预方法:将60只大鼠按照平均体重分别4组,分别为正常组、OP组、NGF组及干预对照组,每组15只。建模成功后,对NGF组及干预对照组分别行腹腔注射NGF、MSCs,剂量为2.0 μ/kg ,正常组及OP组均经腹腔注射等体积的PBS生理盐水,每日一次,连续注射3 d。
1.2.3酶联免疫试剂盒(ELISA)法检测血清中骨代谢指标:抽取各组大鼠眼眶血1.5 mL,放入无菌EP管中,按照3 000 r/min(半径为10 cm)离心15 min,后采用ELISA检测碱性磷酸酶水平(ALP)、骨钙素(BGP)、血清抗酒石酸酸性磷酸酶(TRAP)含量。具体步骤如下:实验过程中设置空白对照组,在血清样本中加入链霉素45 μL,青霉素45 μL,加入ALP、BGP及TRAP抗体,再次添加链霉素45 μL。将试管轻轻震荡,充分摇晃,在37 ℃下保存60 min。每个孔内部加入50 mL显色液。随后再次加入50 mL显色液,轻轻摇动后,在4 ℃避光环境下进行染色,时间为15 min。中止反应:在每个孔内加入40 μL终止溶液,颜色从蓝色变为黄色。用空白孔凋零点后测定各孔A值,在450 nm处测量每个孔吸光度。
1.2.4组织提取:通过1 %戊巴比妥钠腹腔注射麻醉处死各组大鼠,解剖双下肢股骨,经0.9 %生理盐水冲洗、4 %多聚甲醛固定24 h,用15 %乙二胺四乙酸(EDTA-2Na)脱钙14 d观察骨形态学改变。
1.2.5HE染色观察股骨组织病理形态[7]:将各组大鼠股骨组织切片放入37 ℃复温15 min,经二苯甲脱蜡后分别用100 %、95 %、85 %及75 %乙醇进行逐层脱水,苏木精染色8~10 min,自来水冲洗,1 %盐酸乙醇处理10 s,伊红染色液复染10 s,逐层脱水,中性树脂封片后通过显微镜观察组织形态,在200倍光学显微镜下观察股骨病理。
1.2.6Micro CT测量股骨骨微结构及骨组织形态指标:取股骨组织,将左侧股骨浸泡于10 %甲醛中固定,用于骨微结构Micro CT分析。Micro CT扫描参数:球管电压45 v;电流165 μA;曝光时间500 ms;旋转角度和步长分别为180°和0.4°,采用0.5 AL的Filter分辨率为5 μm。骨组织形态指标:Micro CT分析骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁分离度(Tb.Sp)。
1.2.7测量股骨骨强度:选择各组大鼠左侧全段股骨,股骨组织骨密度(BMD)和骨矿含量(BMC)表示骨强度,采用Hologic双能X线骨密度仪测量,利用该系统软件进行分析并自动统计。
1.2.8免疫印迹检测股骨组织Fabp4/LCN-2蛋白含量[8]:在此实验环节加入Fabp4抑制剂组(对OP大鼠灌胃FABP4抑制剂BMS3094030,40 mg/kg,每日灌胃一次,灌胃3 d),取各组大鼠股骨组织,采用0.125 %胰蛋白酶消化,3 000 r/min(半径10 cm)离心15 min后,保留上清液后加入样孔,进行电泳实验。PVDF膜TBS浸泡10 min,反复PBS冲洗3次,5 min/次,加入1抗Fabp4(1∶2 000)、LCN-2(1∶2 000)和GAPDH抗体(1∶2 000 ),加入HRP标记羊抗鼠IgG2抗(1∶5 000)。膜浸入ECL工作液获取图像。
1.3 统计学分析
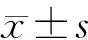
2 结果
2.1 各组大鼠血清生化指标比较
OP组大鼠血清中BGP、ALP及TRAP表达与正常组相比显著升高(P<0.05),与OP组相比,NGF组及干预对照组大鼠血清BGP、ALP及TRAP表达均降低,组间比较存在差异(P<0.05),NGF组及干预对照组血清BGP、ALP及TRAP表达均无差异(P>0.05)。见表1。
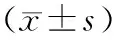
表1 各组大鼠血清生化指标比较Table.1 Comparison of serum biochemical parameters in each
2.2 各组大鼠股骨组织的病理改变
正常组大鼠股骨组织骨小梁分布密集,呈现红紫色,粗细均匀,数目较多,排列紧致,骨髓细胞数目较多。OP组大鼠股骨组织骨小梁分布降低,数目减少且存在断裂及骨髓腔表变大。NGF组和干预对照组与OP组相比,骨小梁数目增多且分布较规则,结构和正常组相似。见图1。

图1 HE染色检测各组大鼠股骨组织形态比较(100×)Fig.1 Comparison of the morphology of femur in each group detected by HE staining (100×)
2.3 各组大鼠股骨组织微结构及骨形态指标比较
采用Micro-CT小动物活体检测系统检测各组大鼠的股骨微结构,经三维重建后,OP组大鼠股骨组织中TB·Th、TB·N含量与正常组相比降低,TB·Sp含量升高,存在差异(P<0.05),NGF组和干预对照组TB·Th、TB·N含量升高,TB·Sp含量降低,和OP组比较存在差异(P<0.05),其余组别比较无差异(P>0.05),见图2、表2。
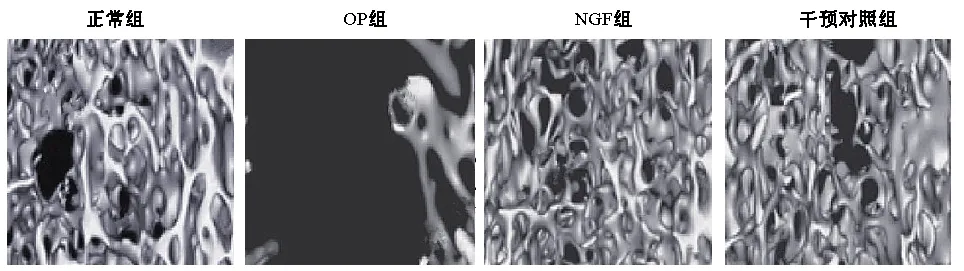
图2 各组大鼠股骨组织微结构比较Fig.2 Comparison of femur microstructure in each group

表2 各组大鼠股骨形态指标比较Table.2 Comparison of morphological indexes of femur in each
2.4 各组大鼠股骨骨强度比较
OP组BMD及BMC降低,与正常组比较存在差异(P<0.05),NGF组和干预对照组BMD及BMC水平升高,与OP组比较存在差异(P<0.05),其余组别无差异(P>0.05),见表3。
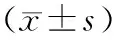
表3 各组大鼠股骨骨强度比较Table.3 Comparison of femoral bone strength of rats in each
2.5 各组大鼠股骨组织中Fabp4及LCN-2蛋白比较
OP组大鼠股骨组织中Fabp4蛋白水平升高,LCN-2蛋白水平降低,与正常组比较存在差异(P<0.05),NGF组和干预对照组Fabp4蛋白降低,LCN-2蛋白升高,与OP组比较存在差异(P<0.05),Fabp4抑制剂组的Fabp4表达低于NGF组(P<0.05),其余组别无差异(P>0.05),见表4、图3、图4。

图3 各组大鼠股骨组织中Fabp4蛋白图Fig.3 Fabp4 protein diagram in femur tissues of rats in each group
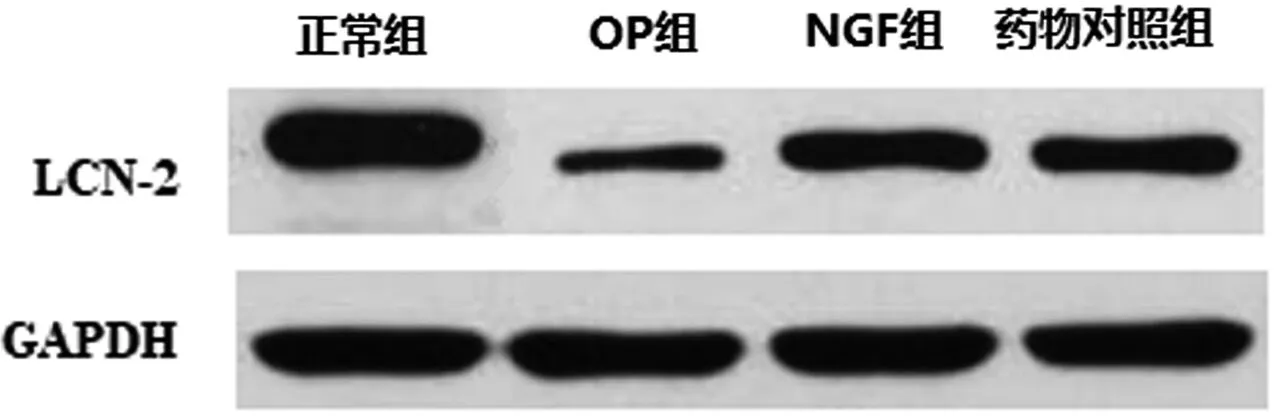
图4 各组大鼠股骨组织中LCN-2蛋白图Fig.4 LCN-2 protein diagram in femur tissue of rats in each group

表4 各组大鼠股骨组织中Fabp4及LCN-2蛋白比较Table.4 Comparison of Fabp4 and LCN-2 proteins in femur tissues of rats in each
3 讨论
在骨代谢过程中新骨形成及旧骨沉积的过程会将骨钙释放到血液循环中,BGP是体液成牙质细胞及肥大软骨细胞分泌合成的非胶质骨带包,表达升高对钙代谢疾病有诊断价值[9-10]。ALP在OP时由于骨吸收增加由静止状态转变为活跃状态是反应破骨细胞活性的重要指标[11-12]。NGF是一种多肽蛋白复合物,主要发挥营养神经的作用,NGF不仅在神经系统发挥促进神经修复及营养作用, 同时在骨
愈合中也有重要意义[13]。NGF能够对神经系统起调控作用,对交感神经发挥稳定作用进而影响骨代谢[14]。随着对NGF研究的深入,内外源性的NGF均可以参与成骨细胞活性调节,能够增加和LNGFR受体的亲和力、促进成骨细胞磷酸化,增加成骨细胞增殖能力。本研究证实,外源性NGF具有改善OP大鼠骨代谢水平、维持骨吸收及骨生成平衡的作用。
本研究采用HE染色及Micro CT分别检测各组大鼠股骨组织病理及微结构,并对其进行量化分析,了解骨小梁结构参数,从而有利于预测骨的力学强度改变。骨微结构可直接决定骨量,目前骨微结构因子有TB·Th、TB·N及TB·Sp等。骨质疏松家兔体外局部注射NGF后进行CT检测发现能够增加骨新生,提高骨小梁分布,这与NGF能够增加成骨、新骨矿化及钙化提高骨质量有关[15]。从骨微结构来看,NGF腹腔注射后能够通过提高相关成骨细胞活性增加基质钙化,进而改善骨小梁分布。刘宇鹏等[16]研究显示对肋骨骨折大鼠损伤部位腹腔注射NGF能够提高骨小梁分布,提高抗折弯度,增加骨强度及抗骨折能力。这与刘治军等[17]研究相似。
本研究证实,NGF能够提高OP大鼠股骨组织中BMD及BMC表达,说明NGF能够通过增加BMD及BMC水平进而提高骨强度。在正常成熟的成骨细胞中发现NGF表达,而OP疾病中表达降低,外源性提高NGF能够提高骨小梁新生,NGF-β能够对成骨细胞成骨能力起促进作用,进而增加骨量,提高骨强度。在骨折发生后NGF能够促进I型胶原蛋白分泌并加快II型胶原蛋白吸收,增加骨结痂形成进而增加愈合。NGF能够提高OP大鼠生物力学,这与NGF可诱导神经引入骨生长中、加快P物质等释放进而调节骨代谢并一进步抑制骨吸收、增加骨形成提高骨密度等有关。
Li等[18-19]研究提示,在OP大鼠骨组织中FABP4表达升高,能够通过与PPARγ结合后靶向一些下游信号通路而增加脂质氧化作用。LCN2主要具有抑制破骨细胞分化及形成的作用。成骨细胞中存在NGF及相关受体LNGFR受体表达,上调NGF能够增加与受体的亲和力而发挥细胞信息传递作用,介导成骨细胞生物学活性而提高成骨形成能力[20]。NGF能够抑制OP大鼠股骨组织中FABP4蛋白及激活LCN2表达而发挥骨保护作用,推测是NGF通过提高成骨细胞活性及成骨能力而上调LCN2活性。玉竹及其多糖主要是通过降血糖、降血脂及激活NFG水平从而降低FABP4水平[21]。本研究推测NGF能够通过上调成骨能力、增加LCN2活性、改善脂肪及糖分进而抑制FABP4表达。
综上所述,对骨质疏松大鼠腹腔注射NGF能够改善大鼠股骨组织生化指标,增加骨强度及骨微结构,原因可能与调节Fabp4/LCN-2表达有关。

