miR-148-5p靶向H型血管调控因子Slit3的实验研究
陈赛楠 黄云梅 林燕萍 黄美雅
1.福建省中医药科学院骨质疏松证候基因组学重点研究室,福建 福州 350003 2.福建中医药大学中西医结合研究院,福建 福州 350122 3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122
2014年Kusumbe等[1-2]学者首次发现小鼠长骨中存在特殊的毛细血管亚型:H型血管,其周围富集大量Osterix+和Runx2+的骨祖细胞并且与骨形成密切相关,称为“成血管-成骨偶联”。研究显示双侧卵巢切除术后小鼠骨量降低的同时伴随H型血管和骨祖细胞数量显著降低[3],而促进H型血管新生可改善骨密度和显微结构[4],H型血管在绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)中的作用逐渐引起学者关注。
多种血管调控因子可直接或间接调控成血管-成骨偶联,如神经轴突导向分子3(Slit3)[5]和血小板衍生生长因子-BB(PDGF-BB)[6]等,截短重组Slit3-LRRD2可缓解去卵巢小鼠骨量丢失[7],然而PMOP骨组织中Slit3的表达变化及其上游miRNAs调控机制未见相关报道。microRNA是内源性基因编码的19-24nt单链非编码RNA,与靶基因3′UTR碱基互补配结合引导靶基因降解或沉默,在PMOP的发生发展中起重要调控作用[8]。本研究通过观察去卵巢快速骨丢失大鼠H型血管调控因子Slit3的表达变化,采用miRNA靶基因预测数据库筛选靶标miRNAs,双荧光素酶报告基因验证其直接作用,旨在初步探讨Slit3的上游调控机制,为后续H型血管的深入研究提供基础。
1 材料与方法
1.1 材料
1.1.1实验动物:SPF级3月龄雌性SD大鼠20只,体重(180±20) g,购自上海杰思捷实验动物有限公司,合格证编码:20180004027331。实验动物饲养于福建省中医药科学院比较医学中心,合格证号:医动学第23-016号;通过动物伦理审查,编号:FJATCM-IAEC2021004,本次实验前适应性喂养1周。
1.1.2细胞株和质粒:293 T人肾胚细胞(SunBio)、DH5a感受态细胞(Takara)、psiCHECK-2质粒(SunBio)、miR-148a-5p、miR-148b-5p、miR-410-3p、miR-129-5p、miR-374-5p、miRNA-NC过表达质粒(吉玛基因)。
1.1.3主要试剂与仪器:通用SP检测试剂盒(Solarbio)、EASYspin Plus骨组织RNA快速提取试剂盒(艾德莱生物)、SYBR®Green Premix Pro Taq HS qPCR Kit(AG11718)、Anti-Slit3 antibody(abcam, ab198726)、Anti-VEGFA antibody(abcam, ab231260)、Opti-MEM培养基(GIBCO)、胎牛血清(BI)、胰酶(Invitrogen)、PrimeSTAR、Taq酶、dNTP(Takara)、无缝克隆试剂盒(SunBio)、限制性内切酶XhoI(NEB)、琼脂糖凝胶DNA回收试剂盒(Takara)、小抽试剂盒(Promega)、Lipo2000 Transfection Reagent(Invitrogen)、Dual-Luciferase Reporter Assay System(Promega)、Real-time PCR(ABI,7500 Fast)、全自动石蜡切片机(Leica,RM2255)、荧光倒置显微镜(Leica,DMI 4000B)、CO2培养箱(ESCO,CCL-240B-8)、酶标仪(Tecan,Infinite M1000)。
1.2 方法
1.2.1大鼠快速骨丢失模型制备:20只SD大鼠随机分为假手术组和模型组,每组10只,采用双侧卵巢切除术制备模型,术前一日大鼠禁食不禁水,称重,2%戊巴比妥钠按照0.2 mL/100 g剂量腹腔注射麻醉,腹部备皮,于腹部正中线作一长约1.5 cm的切口,打开腹腔沿子宫寻找双侧卵巢,结扎并摘除,逐层缝合;假手术组采用相同方法切除卵巢周边等量的脂肪组织;术后3 d连续肌注青霉素8万单位/d,预防感染。术后12周取胫骨和腰椎备检。
1.2.2骨密度测量:去除胫骨周围软组织,生理盐水沾湿纱布包裹并-20 ℃保存,复温后固定扫描位置,双能X线骨密度仪选用小动物高分辨扫描模式扫描胫骨,自选工具选定ROI区域,读取骨密度。
1.2.3Real-timePCR检测Slit3 mRNA表达:液氮研磨组织,骨组织RNA快速提取试剂盒提取总RNA,Nanodrop2000测其浓度,总RNA逆转录cDNA,-20 ℃保存;根据ncbi基因数据库Sli3序列设计合成引物(表1),采用SYBR Green 20 μL反应体系,反应条件为:95 ℃ 15 s,95 ℃ 30 s、60 ℃ 30 s 40个循环,72 ℃ 5 min,β-actin作为内参计算Slit3 mRNA的相对水平。

表1 Real-time引物序列Table.1 Primer sequences for real-time PCR
1.2.4免疫组织化学检测Slit3和VEGFA表达:尽量去除胫骨周围肌肉组织,4%多聚甲醛(pH 7.2~7.4)常温固定72 h,10%EDTA(pH 7.2~7.4)常温脱钙,每3日换液至刀切无阻力感,样本经脱水、透明和浸蜡,石蜡包埋,选择冠状面为切面,4 μm厚切片,摊片,多聚赖氨酸防脱载玻片捞片和60 ℃拷片3 h;切片脱蜡至水,3%H2O2常温10 min灭活内源性酶,蒸馏水洗涤3次,20 μg/mL蛋白酶K 37 ℃抗原修复,PBS洗涤3次,山羊血清37 ℃封闭20 min,1∶50 Slit3和1∶50 VEGFA一抗湿盒4 ℃分别孵育过夜,PBS洗涤3次,1∶100羊抗小鼠/兔IgG 37 ℃孵育30 min,PBS洗涤3次,1∶100链酶亲和素-POD 37 ℃孵育30 min,PBS洗涤5次,DAB显色,苏木素复染,封片,200倍镜下拍摄,每张切片选取12个不同视野,Image Pro Plus 6.0图像半定量分析。
1.2.5预测靶向Slit3基因的miRNA:采用http://www.targetscan.org/vert_72/、http://mirdb.org/和http://www.mircode.org/index.php 3个miRNA靶基因预测数据库,输入靶基因Slit3预测miRNA,选取数据库交集用于后续实验。
1.2.6构建双荧光素酶报告基因载体:https://www.ncbi.nlm.nih.gov/pmc/基因数据库中检索大鼠Slit3基因3′UTR序列NM_031 321.1,设计合成引物并引入相关酶切位点,扩增引物序列上游:5’-GTAATTCTAGGCGATCGCTCGAG-3′,下游:5’-GTTTAAACGAATTCCCGGG-3′;根据Slit3基因3′UTR序列与miR-148b-5p结合位点设计点突变合成突变体引物,上游:5’-ATAATAA AAACGCTGCAGA TTTTTTTGTTTATTTTACAATATAC-3′,下游:5’-ACAAAAAAATCTGCAGCGTTTTTATTATGG AAAGTGACTATTT-3′;PCR反应条件为98 ℃ 3 min,98 ℃ 10 s、55 ℃ 15 s、72 ℃ 1 min共30个循环,72 ℃ 10 min,扩增Slit3基因3′UTR野生型与突变型,扩增产物琼脂糖凝胶纯化回收。限制性内切酶XhoI对psiCHECK-2质粒载体进行酶切,回收6273bp载体片段;目的DNA片段和线性化载体以摩尔比2∶1同源重组入表达载体,同源重组载体转化感受态细胞,Luria-Bertani平板挑取转化子,琼脂糖凝胶电泳鉴定,转化子保种并送测序,测序正确再接种抽提质粒,完成Slit3基因3′UTR野生型与突变型载体构建。
1.2.7细胞转染:293 T细胞培养于含10%胎牛血清的DMEM中,置37 ℃、5%CO2培养箱中培养,制备细胞悬液按30%~50%的汇合度接种于24孔板,实验分为4组:miRNA-NC+Slit3-3′UTR WT、miR-148b-5p+Slit3-3′UTR WT、miRNA-NC+Slit3-3′UTR mut、和miR-148b-5p+Slit3-3′UTR mut,每组设置3个复孔,种板12 h后按照RNA∶DNA∶转染试剂=50 nmol/L∶200 ng∶3 μL比例转染质粒,转染6 h后换液。
1.2.8荧光素酶活性检测:293 T细胞质粒转染48 h后吸除原培养基,PBS洗涤1次,吸除PBS,配置1×PLB并恢复至室温,每孔加入1×PLB 100 μL,摇床常温15 min裂解细胞,反复吹吸后将24孔板置于冰上;采用白色不透光96孔板用于后续检测,每孔加入预混合LAR II 20 μL,加入细胞裂解液上清1 μL,再加入水29 μL,静置2 s酶标仪检测萤火虫荧光素酶活性;立即再向每孔加入预混合Stop&Glo Reagent 20 μL,静置2 s酶标仪检测海肾荧光素酶活性;以萤火虫荧光素酶为实验报告基因,海肾荧光素酶为对照报告基因,两者的比值显示Slit3基因的激活程度。
1.3 统计学分析
2 结果
2.1 胫骨骨密度
与假手术组[(0.414 8±0.009 8) g/mm2]相比,术后12周模型组胫骨近端骨密度[(0.317 7±0.015 7) g/mm2]显著降低,降低约24.5%(P<0.001),提示快速骨丢失模型制备成功。
2.2 Slit3 mRNA表达水平
与假手术组(1.000±0.000)相比,模型组骨组织中Slit3 mRNA表达水平(1.126 9±0.256)略有上调,但不具有统计学意义(P=0.682)。
2.3 Slit3和VEGFA表达情况
图1A为Slit3的阴性对照,棕黄色即为阳性表达区域;显微镜下可见Slit3表达于骨小梁周边的成骨细胞和血管内皮细胞,定位细胞质;假手术组骺线下骨小梁数量多并且周径长,然而Slit3表达强度较弱(图1B);模型组骨小梁稀疏并且髓腔内脂肪细胞堆积,表达范围较假手术组稍小(P=0.289),然而平均光密度显著增强(P=0.004),其表达水平呈上调状态(图1C,表2)。VEGFA同为促血管生成因子,图1 D为阴性对照,主要表达于骨细胞其周围和血管内皮细胞定位细胞质;与假手术组相比(图1E),模型组(图1F)平均光密度稍高,然表达面积较低故累计光密度略小,但未达到统计学意义(表3)。
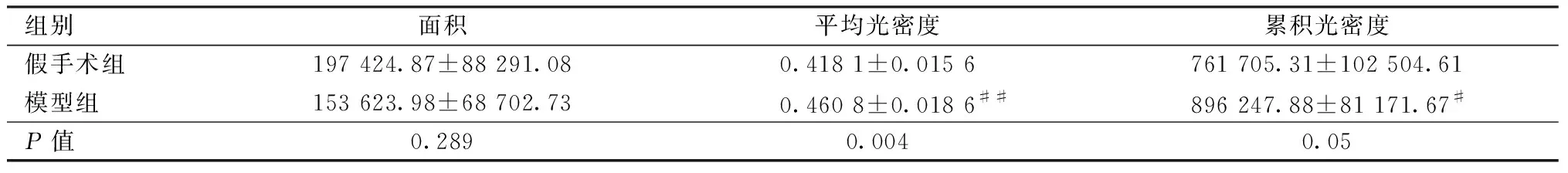
表2 两组大鼠胫骨Slit3蛋白表达情况Table.2 Expression of Slit3 in the rats tibia
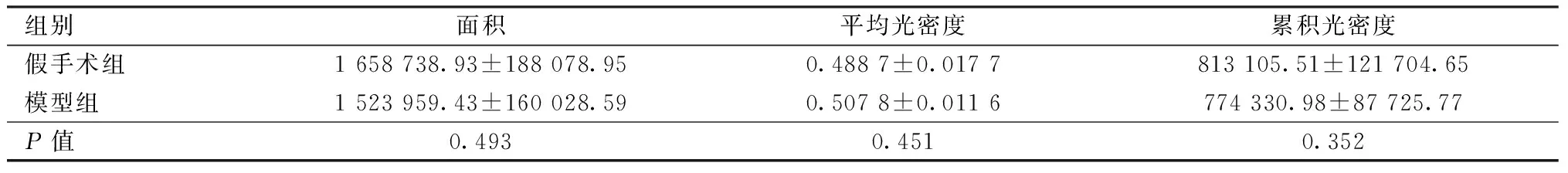
表3 两组大鼠胫骨VEGFA蛋白表达情况Table.3 Expression of VEGFA in the rats tibia
2.4 Slit3基因与miRNAs的靶向关系预测
上述实验结果显示去卵巢大鼠骨量和血管生成情况均降低,H型血管调控因子Slit3表达显著上调,表明Slit3在疾病中可能发挥重要作用,因此研究其上游调控miRNAs。targetscan、miRDB和miRcode数据库预测大鼠Slit3基因与miRNAs的靶向关系,TargetScan预测到259个miRNAs,miRDB预测到15个miRNAs,miRcode预测到121个miRNAs;取数据库交集并且评分高优先,选择最佳5个miRNAs:miR-148a-5p、miR-148b-5p、miR-410-3p、miR-129-5p和miR-374-5p。见图2。
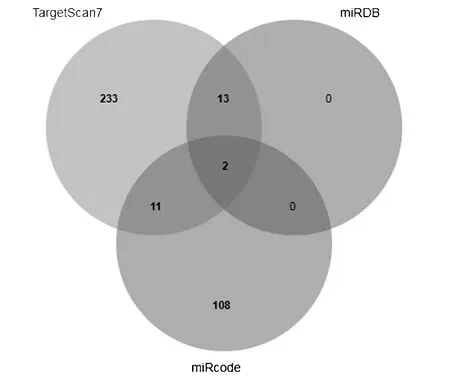
图2 miRNAs生物信息学预测结果Fig.2 Results of bioinformatics prediction of miRNAs
2.5 重组双荧光素酶报告基因载体构建
LB平板挑取转化子,琼脂糖凝胶电泳获得592 bp的阳性克隆,DL2000 DNA Marker自上而下为2 kb、1 kb、750 bp、500 bp、250 bp和100 bp,与预期设计的目的片段长度相符(图3A)。基因测序绿色标记为载体序列,黄色标记为目的基因Slit3 3'UTR序列,蓝色标记为点突变处,粉色标记为酶切位点,结果显示目的基因序列无突变和缺失,表明重组双荧光素酶报告基因载体构建成功(图3B),终载体图谱见(图3C)。
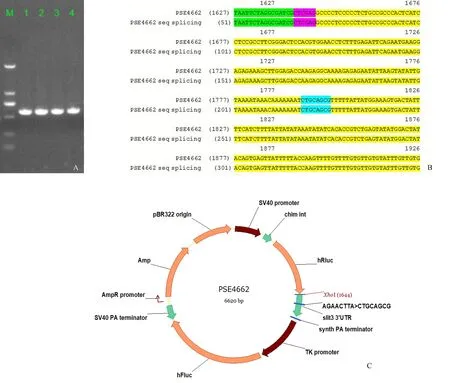
图3 psiCHECK-2/Slit3-3′UTR mut和psiCHECK-2/Slit3-3′UTR WT质粒构建A:PCR鉴定候选转化子;B:阳性克隆测序分析;C:质粒载体Fig.3 Construction of psiCHECK-2/Slit3-3′UTR mut and psiCHECK-2/Slit3-3′UTR WT plasmidA: The candidate transformants were identified by PCR; B: Positive clones were chosen for sequencing; C: Plasmid vector
2.6 双荧光素酶报告基因检测结果
上述5个miRNAs和psiCHECK-2-Slit3-3′UTR载体质粒共转染293 T细胞,双荧光素酶报告基因检测其活性;与miRNA-NC对照组相比,miR-148b-5p荧光活性下调至68.91%(P=0),miR-129-5p荧光活性下调至79.19%(P=0),miR-148a-5p荧光活性下调至83.19%(P=0),miR-410-3p荧光活性为92.56%,miR-374-5p荧光活性为114.99%;结果表明,miR-148b-5p对于slit3-3'UTR有一定的负调控作用,miR-148a-5p、miR-129-5p对其有微弱的负调控作用,miR-410-3p、miR-374-5p对其无明显作用,因此选择miR-148b-5p和slit3-3'UTR进行下一步实验。见表4。
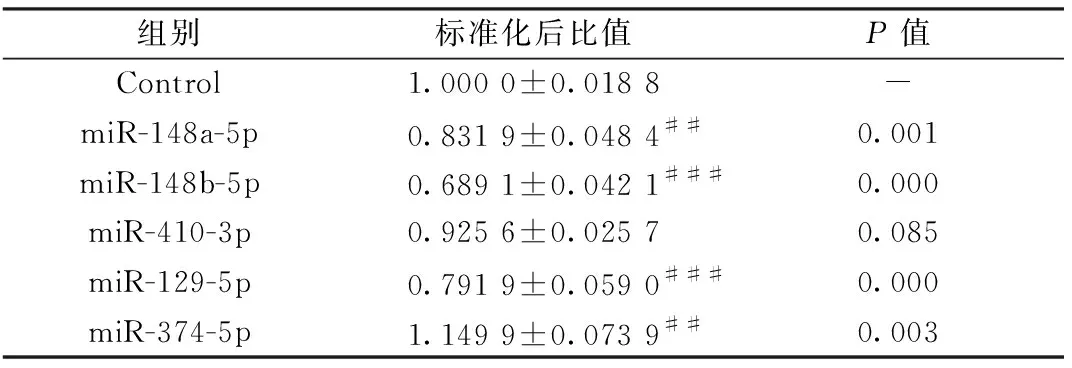
表4 荧光素酶活性比值Table.4 Results of ratio of luciferase activity
2.7 miR-148b-5p靶向调控Slit3基因表达
targetscan数据库预测Slit3-3′UTR和miR-148b-5p存在潜在的结合位点(图4A),位于第147-154碱基AGAACTTA,将Slit3-3'UTR预测的结合位点点突变构建psiCHECK-2/Slit3-3′UTR mut质粒,与miR-148b-5p mimic共转染293 T细胞。与miRNA-NC+Slit3-3′UTR WT相比,miR-148b-5p+Slit3-3′UTR WT荧光活性下调至72.24%(P=0);与miRNA-NC+Slit3-3′UTR mut相比,miR-148b-5p+Slit3-3′UTR mut的荧光活性未见降低;结果表明miR-148b-5p特异性结合Slit3-3′UTR调控其表达水平(图4B)。
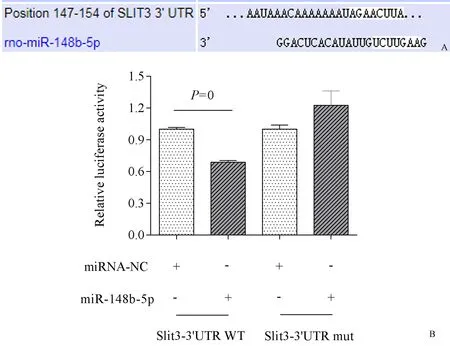
图4 Slit3-3′UTR点突变后双荧光素酶活性比值A:Slit3-3′UTR与rno-miR-148b-5p结合位点预测;B:Slit3-3′UTR点突变后双荧光素酶活性比值Fig.4 Ratio of dual luciferase activity after Slit3-3′UTR point mutationA: The prediction results of rno-miR-148b-5p binding sites in the Slit3-3′UTR; B: Ratio of double luciferase activity after Slit3-3′UTR point mutation
3 讨论
Wang等[9]首次证实人体骨组织同样存在H型血管,其数量与骨密度呈正相关。H型血管的表面标记物、分布和功能区别于其他毛细血管亚型,表面血小板内皮细胞粘附分子-1(platelet endothelial cell adhesion molecule-1,CD31)和内皮粘蛋白(endomucin,Emcn)呈高表达,纵行排列交织成网主要分布于干骺端和骨内膜,空间上其周边骨祖细胞密布与骨形成紧密相关,时间上血管生成介导骨形成,这种时空上的紧密联系称“成血管-成骨偶联”,将经典骨重建二元调控理论丰富为“H型血管-成骨细胞-破骨细胞”三元调控理论。检测绝经后女性髋部骨折标本发现,H型血管数量随骨密度降低而显著降低[10],并且血管面积大小与非绝经后骨质疏松症骨折患者间存在差异[11],均与文献报道动物实验结果相符合[3];腹腔注射去铁胺(HIF-1α激活剂)可增强去卵巢小鼠H型血管形成从而改善骨密度和骨显微结构[4];因此有效调控H型血管或将成为PMOP治疗的新方向。
1984年,Nüsslein-Volhard等[12]学者发现神经轴突导向分子家族(SLIT guidance ligand,Slit),最早作为中枢神经系统抑制因子被发现,是高度保守的大分子分泌型糖蛋白,与靶细胞膜上的单次跨膜受体蛋白ROBO(Roundabout)家族相结合,调控神经轴突的定向生长以阻止中线交叉[13]。近年来研究发现Slit3是新型有效的促血管生成因子[14],在骨组织等非神经系统中同样起重要作用,Slit3的rs10036727单核苷酸多态性与绝经后妇女股骨颈骨密度显著相关[15];Slit3OSX小鼠出现H型血管数量减少和骨量降低;采用Slit3重组蛋白干预去卵巢小鼠,提高H型血管数量以上调骨密度[5]。本研究结果显示,去卵巢大鼠骨密度和血管生成情况降低,组织Slit3 mRNA表达水平略升高和蛋白表达水平显著升高;其可能原因是Slit3与H型血管密切相关,PMOP为高转换型骨质疏松症,破骨细胞和成骨细胞均过度活跃,导致其Slit3表达水平上调。结合文献报道均表明Slit3是调控成血管-成骨偶联的关键因子之一,可能成为POMP诊断和治疗的新靶点,进一步探讨其上游潜在的miRNA调控机制势在必行。
miRNAs是内源基因编码的19-24nt非编码单链RNA,初级转录产物pri-miRNA经剪切后成miRNA前体pre-miRNA,再转运至胞浆经Dicer酶切成成熟miRNA,与靶基因3′UTR碱基配对结合,依赖RISC降低靶基因稳定性引导降解或抑制表达,在PMOP病程中起重要调控作用。Wang等[8]发现去卵巢小鼠外泌体中miR-214-3p表达水平增高,过表达miR-214-3p出现H型血管新生减少和小管形成数量降低。Lin等[16]发现miR-338靶向Runx2/Sox4/调控成骨细胞分化,PMOP患者和OVX小鼠血清中miR-338表达水平均显著增高,并且注射miR-338抑制剂可显著预防卵巢切除导致的快速骨丢失。近年来miR-148b-5p的生物学功能研究逐渐增加,miR-148b-5p可通过靶向负调控CALR表达以调节雪旺细胞的增殖和迁移,可能是周围神经损伤治疗的新靶点[17];胃癌(gastric cancer,GC)患者miR-148b-5p表达显著下调,过表达miR-148b-5p在体内外均可显著抑制GC细胞增殖和侵袭,靶向ATPIF1直接抑制免疫微环境和胃癌进展[18]。
本研究结果显示,miR-148b-5p通过靶向结合Slit3-3'UTR调控H型血管关键调控因子Slit3表达,可能参与成血管-成骨偶联的调控,可能是PMOP发生发展的分子机制之一。综上所述,本研究初步探讨miR-148b-5p和Slit3的作用机制,后续将进一步研究PMOP中miR-148b-5p的差异表达,并通过gain-of-function和loss-of-function观察其调控H型血管表型的变化,以成血管-成骨偶联切入点深入阐释PMOP的病理机制,为疾病的诊断和治疗提供新思路和方向。
——一道江苏高考题的奥秘解读和拓展

